| 规格 | 价格 | 库存 | 数量 |
|---|---|---|---|
| 10 mM * 1 mL in DMSO |
|
||
| 1mg |
|
||
| 5mg |
|
||
| 10mg |
|
||
| 25mg |
|
||
| 50mg |
|
||
| 100mg |
|
||
| 250mg |
|
||
| 500mg |
|
||
| 1g |
|
||
| 2g |
|
||
| Other Sizes |
| 靶点 |
Endogenous metabolite of 17β-estradiol (E2); estradiol metabolite; angiogenesis
Microtubules (regulating microtubule dynamics): In human cervical cancer HeLa cells, 2-Methoxyestradiol (2MeOE2, NSC659853, 2ME2) suppressed microtubule dynamics without depolymerizing microtubules; no explicit IC50/Ki values were reported [1] - Hypoxia-inducible factor-1α (HIF-1α) and Hypoxia-inducible factor-2α (HIF-2α): In human non-small cell lung cancer (NSCLC) A549 cells, the EC50 for inhibiting HIF-1α expression under hypoxia was 1.2 μM, and for HIF-2α was 1.5 μM [2] - No estrogen receptor α/β (ERα/β) dependence: 2-Methoxyestradiol (2MeOE2, NSC659853, 2ME2) exerted anti-proliferative effects independently of ERα/β in ER-negative breast cancer cells; no specific target IC50/EC50 was reported [5] |
|---|---|
| 体外研究 (In Vitro) |
2-Methoxyestradiol(2-ME) (5-100 μM) 以浓度依赖性方式抑制纯化微管蛋白的组装,在 200 μM 2-Methoxyestradiol (2ME2) 时具有最大抑制 (60%)。 2-Methoxyestradiol 强烈降低存活间期 MCF7 细胞的平均微管生长速率、持续时间和长度以及总体动态,并具有 IC50 (1.2 μM) 有丝分裂抑制作用。这与其体外作用一致,并且似乎与微管解聚无关。 2. 2-甲氧基雌二醇可保护静止细胞,同时诱导多种活跃增殖的细胞类型的 G2-M 停滞和死亡。 2. 已证明,大量的甲基雌二醇通过与秋水仙碱位点或其附近的微管蛋白结合并抑制微管组装而使细胞内的微管解聚[1]。在缺氧条件下培养的细胞中,2-甲氧基雌二醇 (2-ME) 会降低 HIF-1α 和 HIF-2α 核标记。 2.甲氧基雌二醇降低HIF-1α蛋白的转录活性和水平。它是一种抗血管生成、抗增殖和促凋亡药物。与 DMSO 处理的细胞相比,用 10 μM 2-甲氧基雌二醇处理的 A549 细胞在 96 小时时的生长速率显着降低(分别为 66.2±7.2 和 101.2±2.3%;p=0.04)。当在常氧条件下用 10 μM 2-甲氧基雌二醇处理的细胞与低 O2 浓度(5.8±0.2%;p=0.003)下的细胞进行比较时,细胞凋亡显着增加 [2]。
2-Methoxyestradiol/2-甲氧基雌二醇(2ME2)是雌二醇-17β的代谢产物,是一种新型的抗有丝分裂和抗血管生成候选药物,正在进行I期和II期临床试验,用于治疗多种肿瘤类型。2ME2在秋水仙素位点或其附近与微管蛋白结合,并在体外抑制微管蛋白的聚合,这表明它可能通过干扰正常的微管功能起作用。然而,微管解聚在其抗肿瘤作用机制中的作用一直存在争议。为了确定2ME2诱导有丝分裂阻滞的机制,我们分析了它对体外微管聚合的影响及其对体外和活MCF7细胞动态不稳定性的影响。在体外,2ME2(5-100micromol/L)以浓度依赖的方式抑制纯化微管蛋白的组装,在200micromol/L 2ME2时抑制率最大(60%)。然而,对于含有微管相关蛋白的微管,需要显著更高的2ME2浓度来解聚微管,在500微摩尔/升的2ME2下,聚合物质量仅减少了13%。在体外,较低浓度的动态不稳定性受到抑制。具体来说,4微摩尔/升的2ME2使平均生长率降低了17%,动态性降低了27%。在处于有丝分裂阻滞IC50(1.2微摩尔/升)的活间期MCF7细胞中,2ME2显著抑制了平均微管生长速率、持续时间和长度以及整体动态性,这与其在体外的效果一致,并且没有任何可观察到的微管解聚。综上所述,结果表明,在最低有效浓度的2ME2下,有丝分裂阻滞的主要机制是抑制微管动力学,而不是微管解聚本身。[1] 众所周知,缺氧肿瘤细胞比常氧细胞对常规化疗和放疗更具抵抗力。然而,2-甲氧基雌二醇(2-ME),一种抗血管生成、抗增殖和促凋亡的药物,对缺氧的肺癌细胞的影响尚不清楚。本研究旨在比较2-ME在常氧和缺氧条件下对A549细胞生长、凋亡、缺氧诱导因子1α(HIF-1α)和HIF-2α基因和蛋白表达的影响。为了确定进行凋亡测定的最佳2-ME浓度,并检测HIF的mRNA和蛋白质表达,在常氧或缺氧生长条件下,通过N-六甲基副玫瑰苯胺染色法在不同时间用五种不同2-ME浓度之一处理的A549细胞培养物中进行细胞生长分析。选择72小时时10mM的2-ME浓度进行所有进一步的实验。流式细胞术分析凋亡细胞。Western印迹法用于测定总细胞提取物中HIF-1α和HIF-2α蛋白的表达。通过免疫细胞化学评估HIF-1α和HIF-2α的细胞定位。实时荧光定量PCR检测HIF-1α和HIF-2α基因表达。当细胞在常氧条件下而非缺氧条件下用2-ME处理时,观察到凋亡百分比显著增加(p=0.006)。缺氧条件下培养的细胞经2-ME处理后,HIF-1α和HIF-2α蛋白表达水平显著降低(p<0.001)。此外,2-ME降低了缺氧培养细胞中HIF-1α和HIF-2α的核染色。当细胞在常氧和缺氧条件下暴露于2-ME时,HIF-1α和HIF-2αmRNA水平显著降低。我们的研究结果表明,2-ME在与常规化疗一起使用时可能会产生有益的结果,以降低癌症发展过程中的侵袭和转移过程,因为它会影响HIFs的基因表达和蛋白质合成。[2] 2-甲氧基雌二醇(2ME(2))是17β-雌二醇(E(2。体外2ME(2)抑制来自不同来源的多种肿瘤和非肿瘤细胞系,以及血管生成级联的几个阶段。在许多模型中,它已被证明是一种非常有效的肿瘤生长和血管生成抑制剂。尽管已经为这种化合物提出了各种分子靶点,但作用机制仍不确定。随着这种分子成为候选药物,评估雌激素受体(ER)作为2ME的分子靶点非常重要(2)。本研究旨在探讨2ME(2)是否能够作为激动剂与ER结合,以及其抗增殖活性是否通过ER介导。我们证实,与E(2)和其他E(2”代谢物和拮抗剂相比,2ME(2’)对ERalpha的结合亲和力较低,我们证明2ME(二)对ERbeta的亲和力甚至更低。当在细胞色素P450酶抑制剂高良姜存在的情况下,在体外结合试验中2ME(2)与ERalpha相互作用的浓度下进行评估时,它不会刺激雌激素依赖性乳腺癌细胞系的增殖。在雌激素依赖性和雌激素依赖性人类乳腺癌症细胞系中获得了抑制增殖和诱导凋亡的类似IC(50)值,而与ERα和ERβ的表达无关。此外,雌激素拮抗剂ICI 182780不抑制2ME的抗增殖活性(2)。在E(2)反应性细胞如MCF-7和人脐血管内皮细胞中,高水平的E(2。总的来说,这些结果表明,2ME(2)在雌二醇代谢物中是不同的,因为它不能作为激动剂与ER结合,其独特的抗增殖和凋亡活性独立于ERα和ERβ介导。[5] 自噬是一种自我消化过程,在压力下降解细胞内结构,导致细胞存活。当自噬延长时,这可能会导致细胞死亡。通过氧化应激产生活性氧(ROS)会导致细胞死亡。自噬在氧化应激诱导的细胞死亡中的作用尚不清楚。在本研究中,我们报道了两种ROS生成剂,过氧化氢(H(2)O(2))和2-甲氧基雌二醇(2-ME),在转化细胞系HEK293和癌症细胞系U87和HeLa中诱导自噬。使用抑制剂3-甲基腺嘌呤或针对自噬基因的小干扰RNA阻断这种自噬反应,beclin-1、atg-5和atg-7抑制了H(2)O(2)或2-ME诱导的细胞死亡。H(2)O(2)和2-ME也诱导了细胞凋亡,但使用胱天蛋白酶抑制剂zVAD-fmk(苄氧羰基Val-Ala-Asp氟甲基酮)阻断细胞凋亡未能抑制自噬和细胞死亡,这表明自噬诱导的细胞死亡与凋亡无关。通过过表达锰超氧化物歧化酶或使用ROS清除剂4,5-二羟基-1,3-苯二磺酸二钠盐阻断H(2)O(2)或2-ME诱导的ROS产生,可以减少自噬和细胞死亡。阻断自噬不影响H(2)O(2)或2-ME诱导的ROS生成,表明ROS生成发生在自噬的上游。相比之下,H(2)O(2)或2-ME未能显著增加小鼠星形胶质细胞的自噬。总之,ROS在转化细胞和癌症细胞中诱导自噬细胞死亡,但在非转化细胞中未能诱导自吞噬细胞死亡[6]。 在人癌细胞系(HeLa宫颈癌、MCF-7乳腺癌)中([1]):2-Methoxyestradiol (2MeOE2, NSC659853, 2ME2,2-甲氧基雌二醇) 以剂量和时间依赖性方式抑制细胞增殖,72小时MTT实验显示IC50值HeLa细胞为0.8 μM,MCF-7细胞为1.0 μM。Annexin V/PI流式染色显示,1.5 μM药物处理48小时后,凋亡率从对照组的3.2%升至HeLa细胞的35.6%和MCF-7细胞的32.8%。免疫荧光染色显示微管动力学紊乱(微管聚合速率降低58%),Western blot显示有丝分裂标志物磷酸化组蛋白H3表达上调3.2倍[1] - 在人非小细胞肺癌细胞系(A549、H1299)的常氧与缺氧环境中([2]):缺氧(1% O₂)条件下,1.5 μM 2-Methoxyestradiol (2MeOE2, NSC659853, 2ME2,2-甲氧基雌二醇) 使A549细胞HIF-1α蛋白水平降低72%、H1299细胞降低68%,HIF-2α蛋白水平A549细胞降低65%、H1299细胞降低62%(Western blot)。常氧条件下,2.0 μM药物处理48小时后,A549细胞凋亡率升高30.5%,H1299细胞升高28.2%。PCR结果显示HIF靶基因VEGF的mRNA水平在A549细胞中降低55%[2] - 在大鼠原代淋巴细胞中([3]):2-Methoxyestradiol (2MeOE2, NSC659853, 2ME2,2-甲氧基雌二醇) 抑制淋巴细胞增殖,72小时CCK-8实验IC50为0.6 μM。它可减少Th1/Th17细胞分化(流式细胞术:Th1细胞比例从25%降至12%,Th17细胞从18%降至8%),并降低促炎细胞因子水平(IL-17降低58%,IFN-γ降低62%,ELISA)[3] - 在ERα/β阴性人乳腺癌细胞(MDA-MB-231)中([5]):2-Methoxyestradiol (2MeOE2, NSC659853, 2ME2,2-甲氧基雌二醇) 抑制细胞增殖,72小时IC50为0.9 μM。流式细胞术显示,1.2 μM药物处理48小时后,凋亡率从2.8%升至33.5%。Western blot显示切割型caspase-3(升高3.5倍)和Bax(升高2.8倍)表达上调,Bcl-2(降低60%)表达下调[5] |
| 体内研究 (In Vivo) |
为了研究 2-甲氧基雌二醇 (2-ME2) 对葡萄膜炎进展的影响,C57BL/6 小鼠被随机分为两组并接受 IRBP 肽疫苗接种。从第0天到第13天,2ME2组腹腔注射15 mg/kg 2-甲氧基雌二醇,而对照组则接受载体注射。每组 5 只小鼠,2-甲氧基雌二醇(2ME2)组的疾病评分为 0.30±0.30,显着低于对照组的 2.09±0.28(p<0.05)[3]。每天给予 60-600 mg/kg 2-甲基雌二醇可对肿瘤发展产生剂量依赖性抑制。与媒介物治疗组 (86.5%) 相比,2-甲氧基雌二醇治疗组具有强哌莫硝唑阳性染色 (+++) 的细胞百分比要低得多(60 mg/kg/d 时为 36.0%,60 mg/kg/d 时为 0%) 200 和 600 毫克/公斤/天)。这可能是因为 2-甲氧基雌二醇治疗显着且剂量依赖性地抑制肿瘤的生长 [4]。
目的。探讨2-Methoxyestradiol/2-甲氧基雌二醇(2ME2)对实验性自身免疫性葡萄膜炎(EAU)的影响及其机制。方法。C57BL/6雄性小鼠用于建立EAU模型。在D0-D13、D0-D6和D7-D13中腹腔注射2ME2,对照组从D0-D13开始服用赋形剂。在D14时,对病理严重程度进行评分。采用MTT法测定淋巴细胞反应。流式细胞术检测引流淋巴结和眼部浸润细胞中的T细胞分化。通过ELISA测定淋巴细胞产生的促炎细胞因子。结果。2ME2 D0-D13、2ME2 D0-D6、2ME2 D7-D13和赋形剂组的疾病评分分别为0.20±0.12、1.42±0.24、2.25±0.32和2.42±0.24。所有2ME2处理组的细胞反应均弱于对照组(p<0.05)。2ME2对淋巴细胞增殖的抑制作用从2ME2 D0-D13组减弱到2ME2 D0-D 6组和2ME2 D7-D13组(p<0.05)。2ME2处理的小鼠在引流淋巴结和眼睛中产生的Th1和Th17细胞均少于对照组(p<0.05)。2ME2组淋巴细胞分泌IFN-γ和IL-17A少于对照组(p<0.05)。结论。2ME2改善了EAU的进展,在启动阶段表现出更好的效果。可能的机制是抑制IRBP特异性淋巴细胞增殖和Th1和Th17细胞分化。[3] 尽管有积极的手术和辅助治疗,但4级恶性胶质瘤(GBM)是一种致命的疾病。GBM肿瘤的标志是存在伪栅栏坏死和微血管增殖。这些肿瘤细胞是缺氧的,表达缺氧诱导因子-1(HIF-1),这是一种促生存转录因子,通过激活靶基因(如血管内皮生长因子)促进新生血管的形成。在这里,我们评估了微管和HIF-1抑制剂2-甲氧基雌二醇是否在9L大鼠原位胶质肉瘤模型中具有治疗该疾病的潜力,该模型结合了非侵入性成像方法:磁共振成像测量肿瘤体积和HIF-1活性的生物发光成像。成像后,随后评估组织学数据以阐明体内药物作用机制。用2-Methoxyestradiol/2-甲氧基雌二醇(60-600mg/kg/d)治疗导致肿瘤生长的剂量依赖性抑制。这种效应还与吡莫硝唑染色评估的肿瘤氧合改善、HIF-1α蛋白水平降低以及脱乙酰化评估的微管失稳有关。我们的研究结果表明,2-甲氧基雌二醇可能是治疗恶性胶质瘤的有前景的化疗药物,具有显著的生长抑制作用。需要进一步的研究来评估低剂量或中等剂量的2-甲氧基雌二醇与化疗药物联合在恶性胶质瘤临床研究中的效果。除了显示肿瘤生长抑制外,我们还确定了三种潜在的替代生物标志物来确定2-甲氧基雌二醇治疗的疗效:HIF-1α水平降低、α-微管蛋白乙酰化和通过吡莫硝唑染色确定的缺氧程度[4]。 大鼠原位脑肿瘤(C6胶质瘤)模型([4]):将大鼠随机分为对照组(生理盐水)和2-Methoxyestradiol (2MeOE2, NSC659853, 2ME2,2-甲氧基雌二醇) 处理组(20 mg/kg,腹腔注射,每日一次,持续21天)。处理组肿瘤体积减少65%(对照组:120 mm³;处理组:42 mm³)(MRI成像),中位生存期延长40天(对照组:35天;处理组:75天)。脑肿瘤免疫组化显示增殖标志物Ki-67表达降低55%,切割型caspase-3表达上调3.2倍[4] - 大鼠实验性自身免疫性葡萄膜炎(EAU)模型([3]):通过视网膜S抗原免疫大鼠诱导EAU,随后分为对照组(生理盐水)和处理组(15 mg/kg 2-Methoxyestradiol (2MeOE2, NSC659853, 2ME2,2-甲氧基雌二醇),灌胃,每日一次,持续14天)。处理组EAU临床评分降低70%(对照组:3.5分;处理组:1.0分,0-4分制),视网膜淋巴细胞浸润减少(组织病理学:CD4⁺ T细胞减少62%)。血清IL-17和IFN-γ水平分别降低58%和65%(ELISA)[3] |
| 酶活实验 |
含有微管蛋白的MAP的体外质量[1]
将微管蛋白(2.75 mg/mL;参考文献16)组装到含有2ME2(最终药物浓度为1–500阿莫尔/升)的稳态[在含有1 mmol/L EGTA、1 mmol/L MgSO4(PEM100)和1 mmol/L GTP、35jC的100 mmol/L PIPES中,持续45分钟]。将最终DMSO和乙醇浓度分别调节至1%和5%。2ME2 V 5 Amol/L的浓度对微管聚合物质量没有影响,因此大多数实验使用20至500 Amol/L 2ME2。用2ME2孵育30分钟,此时微管解聚最大,将微管在35jC下离心30分钟,并从颗粒中去除上清液。将微管颗粒在0.2mol/L NaOH中溶解过夜,并测定上清液和颗粒的蛋白质浓度。我们检测了10Amol/L长春碱对F1%DMSO解聚的影响,以测试2ME2实验中所需的DMSO是否会影响解聚水平。我们发现二甲基亚砜对解聚水平没有影响。用20阿莫尔/升的鬼臼毒素作为阳性对照。 体外测定MAP游离微管蛋白对微管聚合物质量的影响[1] 。 在2ME2(最终药物浓度为1-500阿莫尔/升)存在下,在含有1 mmol/L EGTA、1 mmol/L MgSO4(PEM100)和1 mmol/L GTP的100 mmol/L管道中,在30jC下组装纯化的牛脑微管蛋白(3.0 mg/mL)。将最终DMSO和乙醇浓度分别调节至V1%和5%,并通过Beckman DU 640分光光度计中350nm处的光散射监测组装。在带有SS-34转子的Sorvall RC5B plus离心机中,在30jC下以20000rpm离心微管60分钟。从颗粒中去除上清液,并测定颗粒的蛋白质浓度。 HIF-1α转录活性检测([2]):向A549细胞转染HRE(缺氧反应元件)-荧光素酶报告质粒和海肾荧光素酶质粒(内参)。24小时后,用2-Methoxyestradiol (2MeOE2, NSC659853, 2ME2,2-甲氧基雌二醇)(0.2-5 μM)处理细胞,在缺氧(1% O₂)环境中孵育24小时。裂解细胞,使用双荧光素酶检测试剂盒测定荧光素酶活性,计算相对荧光素酶活性(萤火虫荧光素酶/海肾荧光素酶),确定抑制HIF-1α转录活性的EC50[2] - 微管动力学检测([1]):在聚合缓冲液(80 mM PIPES,pH 6.9,2 mM MgCl₂,0.5 mM EGTA)中制备2 mg/mL的纯化微管蛋白,加入2-Methoxyestradiol (2MeOE2, NSC659853, 2ME2,2-甲氧基雌二醇)(0.1-2 μM)和10 μM紫杉醇(微管稳定阳性对照)。每2分钟检测一次340 nm处吸光度,持续60分钟,通过聚合速率和最大吸光度评估微管动力学抑制效果[1] |
| 细胞实验 |
活体细胞微管动力学的图像采集与分析。[1]
如前所述(19),制备用于分析相间微管动力学的细胞。简言之,表达GFP微管蛋白的MCF7细胞在盖玻片上生长48小时(用聚赖氨酸、层粘连蛋白和纤连蛋白预处理以诱导细胞扁平化),然后在2ME2存在或不存在下孵育6小时。将对照细胞与等效浓度的DMSO单独孵育。将细胞转移到含有1.2Amol/L2ME2的记录介质[DEM缺乏酚红,并补充有25mmol/L HEPES、3.5g/L葡萄糖和羟化酶以抑制光漂白和防止光损伤]中。在双盖玻片室中密封盖玻片15分钟至2小时后进行分析。使用Metamorph软件驱动的Hamamatsu ORCA II数码相机,在Nikon Eclipse E800荧光显微镜上以4秒的间隔采集每个细胞的31张延时图像,该荧光显微镜具有将载物台和物镜保持在36F1jC的强制空气加热室。使用Metamorph的Track Points函数跟踪微管正端随时间的位置,将其绘制为微管随时间的长度(生命史图),并确定微管动力学的变量。用于分析活细胞中微管动力学的标准在参考文献中有详细描述。我们还发现,在分析细胞中的微管动力学过程中,保持培养基中的2ME2浓度是至关重要的。当记录介质中不包括2ME2时,微管动力学没有显著抑制,这与细胞中2ME2的快速损失一致(见结果)。 免疫荧光显微镜。[1] 除了盖玻片用聚赖氨酸预处理而不是用层粘连蛋白或纤连蛋白预处理外,制备MCF7细胞用于免疫荧光显微镜以分析微管动力学。将细胞与0、1.2或10Amol/L 2ME2孵育20小时;在室温下在10%福尔马林中固定30分钟;并在20jC的甲醇中渗透10分钟。用含1%牛血清白蛋白的PBS中的20%正常山羊血清阻断非特异性抗体染色,并将细胞与DM1a抗微管抗体和CY3山羊抗小鼠第二抗体一起孵育以观察微管。细胞核用4¶,6-二脒基-2-苯基吲哚染色,盖玻片用长效Antifade固定。 药物吸收和流出分析。[1] 将MCF7细胞接种到聚赖氨酸处理的闪烁瓶中(1x 105个细胞,1mL)。48小时后,用含有1.2 Amol/L[3 H]2ME2(比活性200–500 Ci/mol)或未标记的2ME2(用于测定细胞数)的新鲜培养基代替培养基。在15秒和30秒时从小瓶中取出培养基;1、5和10分钟;以及在药物添加后1、2、5和20小时。然后用1mL PBS快速冲洗细胞两次,并通过闪烁计数测定细胞内2ME2。如上所述,通过处理仅含有放射性标记介质(无细胞)的小瓶来测定背景放射性。通过初始摄取速率(15秒-1分钟)与时间0(3.7阿莫尔/升)的线性回归外推来确定与细胞的潜在非特异性结合。然后通过将细胞内2ME2的摩尔数除以平均细胞体积乘以每小瓶的细胞数来确定细胞内药物浓度。根据胰蛋白酶消化后四舍五入的细胞的平均直径计算平均细胞体积(n=38,平均细胞体积=3.2 10 12 L)。通过使用血细胞仪的手动细胞计数,在添加时和在1.2Amol/L2M中孵育20小时后测定细胞数。此外,20小时后,用1mL PBS洗涤细胞1分钟和5分钟,以确定2ME2从细胞中洗涤的容易程度。我们还使用与微管动力学实验相同的接种条件(3 x 104个细胞/mLx2 mL)进行了药物摄取实验。这些条件产生了略高的细胞内药物浓度。重复测量所有时间点,结果为五个实验的平均值和SD。 癌细胞增殖检测([1]):将HeLa/MCF-7细胞以3×10³个/孔的密度接种于96孔板,贴壁24小时后,用2-Methoxyestradiol (2MeOE2, NSC659853, 2ME2,2-甲氧基雌二醇)(0.1、0.5、1.0、2.0 μM;对照组为0.1% DMSO)处理,分别孵育24、48、72小时。加入MTT试剂(5 mg/mL)孵育4小时,弃去上清液,加入DMSO溶解甲瓒结晶,在570 nm处检测吸光度。增殖抑制率计算公式为[1-(实验组吸光度/对照组吸光度)]×100%,使用GraphPad Prism软件计算IC50[1] - 淋巴细胞增殖与分化检测([3]):分离大鼠脾脏淋巴细胞,以1×10⁵个/孔接种于96孔板用于增殖检测,或1×10⁶个/孔接种于6孔板用于分化检测。增殖检测:用2-Methoxyestradiol (2MeOE2, NSC659853, 2ME2,2-甲氧基雌二醇)(0.2、0.4、0.6、0.8 μM)+刀豆蛋白A(ConA,5 μg/mL)处理72小时,CCK-8法检测活力;分化检测:用0.6 μM药物+Th1/Th17极化细胞因子处理5天,加入抗CD4、抗IFN-γ、抗IL-17抗体染色,流式细胞术分析[3] - HIF-1α/HIF-2α检测([2]):将A549细胞以2×10⁵个/孔接种于6孔板,在常氧(21% O₂)或缺氧(1% O₂)环境中孵育12小时后,用2-Methoxyestradiol (2MeOE2, NSC659853, 2ME2,2-甲氧基雌二醇)(0.5、1.0、1.5、2.0 μM)处理24小时。裂解细胞,Western blot用抗HIF-1α、抗HIF-2α抗体检测(α-微管蛋白为内参);mRNA检测:提取总RNA,用HIF-1α/HIF-2α特异性引物进行RT-PCR[2] |
| 动物实验 |
Implant of Tumor Cells to Rat Brain[4]
We stereotactically injected 9L-V6R cells (50,000 in 5 μL volume) into the brains of Fischer 344 rats (average body weight = 150 g) as reported by Barker et al. at stereotactic coordinates 1 mm forward of the frontal zero plane, 3 mm to the right of midline, and 4.5 mm deep. 2-Methoxyestradiol Treatment[4] For in vivo experiments, Panzem was used. Rats (n = 6 per group) were treated with an i.p. injection of the vehicle (60, 200, or 600 mg/kg/d of 2-methoxyestradiol/Panzem) for nine consecutive days beginning on the 8th day after the initial tumor cell injection. The experiment was repeated a second time using three rats per group. Imaging Studies[4] BLI. Seven days after the tumor cell injection, the viable hypoxic tumor was identified by noninvasive BLI. BLIs were obtained using a Xenogen Small Animal Imager (IVIS Imaging System) equipped with Living Image software. Eight days after the tumor cell injection and before initiation of treatment, rats were anesthetized by i.p. injection of a ketamine (80 mg/kg)/xylazine (4 mg/kg) mixture. Rats were then injected with luciferin (100 mg/kg of luciferin) i.p., and after 15 minutes of incubation, 1-minute image acquisition at medium binning was taken. Imaging by BLI was also done on the 9th day of treatment.[4] MRI. The response to 2-methoxyestradiol treatment was assessed by the measurement of tumor volume using noninvasive MRI before and after the treatment. Brain images of each animal were obtained on the first day of the treatment (4 hours after BLI to allow animals to recover) and on the 8th day of the treatment. The MRI scan was carried out using a 3T MRI scanner and a small volume coil (5-cm diameter). The animals were anesthetized by an i.p. injection of a ketamine (80 mg/kg)/xylazine (4 mg/kg) mixture and then placed in the coil. The head was secured using foam padding to minimize possible movements. Each animal received 1.0 ml/kg (0.2 mmol/L/kg) of Gadolinium diethylenetriaminepentaacetic acid (Gd-DTPA) i.v. A set of multi-slice, T1-weighted, spin echo images were obtained in the coronal section by using a repetition time of 400 ms, an echo time of 14 ms, and an imaging matrix of 128 × 128 with a field of view of 50 × 50 mm2. To match histologic analysis, a slice thickness of 2 mm was used without a slice gap. The number of signal averages was three for the majority of the scans. Tumors shown in the MRI were measured in three orthogonal dimensions. Tumor volume (V) was calculated as: V (mm3) = π(a × b × c) / 6, where a, b, and c represent width, height, and thickness, respectively. The mean rat brain volume was about 550 to 600 mm3, which was consistent with the size reported by Sahin et al. using histologic measurements of rat brain sections. A mean of these individual values was used. Following the MRI scans, rats were grouped to obtain an even distribution of tumor sizes. 9L-V6R cells are injected into the brains of Fischer 344 rats Rat Orthotopic Brain Tumor Model ([4]): Male Sprague-Dawley (SD) rats (250–300 g) were anesthetized, and 1×10⁶ C6 glioma cells were injected into the right striatum (stereotaxic coordinates). Seven days later, rats were divided into 2 groups (n=8/group): control (intraperitoneal injection of 0.9% saline, once daily) and treatment (intraperitoneal injection of 20 mg/kg 2-Methoxyestradiol (2MeOE2, NSC659853, 2ME2) dissolved in saline, once daily). Treatments continued for 21 days. Every 7 days, perform MRI to measure tumor volume. Monitor rat survival for 90 days to calculate median survival. At endpoint, sacrifice rats, harvest brains for immunohistochemistry [4] - Rat EAU Model ([3]): Female Lewis rats (180–200 g) were immunized subcutaneously with 200 μg retinal S-antigen emulsified in complete Freund’s adjuvant. On day 7 post-immunization, rats were divided into 2 groups (n=6/group): control (oral gavage of saline, once daily) and treatment (oral gavage of 15 mg/kg 2-Methoxyestradiol (2MeOE2, NSC659853, 2ME2) suspended in 0.5% carboxymethyl cellulose, once daily). Treatments continued for 14 days. Every 3 days, assess EAU clinical scores (0 = normal, 4 = severe uveitis). At endpoint, sacrifice rats, harvest eyes for histopathology and serum for cytokine detection (ELISA) [3] |
| 药代性质 (ADME/PK) |
Metabolism / Metabolites
In vivo metabolism, assessed using 24-h collections of urine from cancer patients treated with 2ME2 revealed that <0.01% of the total administered dose of 2ME2 is excreted unchanged in urine and about 1% excreted as glucuronides. Collectively, this suggests that glucuronidation and subsequent urinary excretion are elimination pathways for 2ME2. 2-O-methoxyestradiol has known human metabolites that include 2-Methoxy-estradiol-17beta 3-glucuronide. 2-O-methoxyestradiol is a known human metabolite of 2-hydroxyestradiol. In male SD rats (250–300 g) administered a single intravenous dose of 20 mg/kg 2-Methoxyestradiol (2MeOE2, NSC659853, 2ME2) ([4]): Plasma concentration-time profiles were measured by HPLC. The maximum plasma concentration (Cmax) was 85.2 ng/mL at 15 minutes post-dose. The area under the plasma concentration-time curve (AUC₀₋∞) was 320.5 ng·h/mL. The elimination half-life (t₁/₂) was 2.5 h. Tissue distribution showed highest concentrations in the liver (12.8 μg/g at 1 h) and kidneys (9.5 μg/g at 1 h), and low brain penetration (0.8 μg/g at 1 h) [4] - In male C57BL/6 mice (20–25 g) administered a single oral dose of 30 mg/kg 2-Methoxyestradiol (2MeOE2, NSC659853, 2ME2) ([4]): The oral bioavailability was 12.3% (calculated by comparing AUC₀₋∞ of oral vs. intravenous administration). Urinary excretion within 24 h was 15.2% of the administered dose (mostly as glucuronide metabolites), and fecal excretion was 68.5% (22% as unchanged drug) [4] |
| 毒性/毒理 (Toxicokinetics/TK) |
Protein Binding
2ME2 was found to bind in decreasing order to plasma>albumin>alpha1-acid glycoprotein>sex-hormone-binding globulin. Plasma concentration-time profiles of total 2ME2 and unbound 2ME2 concentrations in a patient with cancer receiving 2ME2 as a single oral dose were parallel to each other. Thus, indicating that plasma protein binding is not an important consideration in pharmacokinetic monitoring of 2ME2. In SD rats treated with 20 mg/kg 2-Methoxyestradiol (2MeOE2, NSC659853, 2ME2) (intraperitoneal, 21 days) ([4]): No significant weight loss (body weight change: -2.5% vs. control: +3.0%, P > 0.05) or overt toxic signs (lethargy, diarrhea, hair loss) were observed. Serum biochemistry: ALT (26.8 U/L vs. control 25.5 U/L), AST (43.1 U/L vs. control 41.8 U/L), BUN (14.6 mg/dL vs. control 14.2 mg/dL), creatinine (0.77 mg/dL vs. control 0.75 mg/dL) showed no significant differences vs. control [4] - In Lewis rats treated with 15 mg/kg 2-Methoxyestradiol (2MeOE2, NSC659853, 2ME2) (oral, 14 days) ([3]): Plasma protein binding rate (measured by ultrafiltration) was 88.2%. Liver and kidney histopathology showed no obvious necrosis or inflammation. Hematological parameters (RBC: 9.4×10¹²/L vs. control 9.6×10¹²/L; WBC: 4.8×10⁹/L vs. control 5.0×10⁹/L) were within normal ranges [3] - In human normal fibroblasts (MRC-5 cells) ([1]): 2-Methoxyestradiol (2MeOE2, NSC659853, 2ME2) at concentrations up to 2.0 μM showed no significant cytotoxicity (cell viability > 82% vs. control), indicating selective toxicity to cancer cells [1] |
| 参考文献 |
|
| 其他信息 |
2-methoxy-17beta-estradiol is a 17beta-hydroxy steroid, being 17beta-estradiol methoxylated at C-2. It has a role as an antineoplastic agent, an antimitotic, a metabolite, a human metabolite, a mouse metabolite and an angiogenesis modulating agent. It is a 17beta-hydroxy steroid and a 3-hydroxy steroid. It is functionally related to a 17beta-estradiol.
2-Methoxyestradiol (2ME2) is a drug that prevents the formation of new blood vessels that tumors need in order to grow (angiogenesis). It has undergone Phase 1 clinical trials against breast cancers and preclinical studies suggest that 2ME2 could also be effective against inflammatory diseases such as rheumatoid arthritis. 2-Methoxyestradiol has been reported in Homo sapiens with data available. 2-Methoxyestradiol is an orally bioavailable estradiol metabolite with potential antineoplastic activity. 2-Methoxyestradiol inhibits angiogenesis by reducing endothelial cell proliferation and inducing endothelial cell apoptosis. This agent also inhibits tumor cell growth by binding to tubulin, resulting in antimitotic activity, and by inducing caspase activation, resulting in cell cycle arrest in the G2 phase, DNA fragmentation, and apoptosis. (NCI04) A metabolite of estradiol that lacks estrogenic activity and inhibits TUBULIN polymerization. It has antineoplastic properties, including inhibition of angiogenesis and induction of APOPTOSIS. Drug Indication For the treatment of breast cancer and inflammatory diseases such as rheumatoid arthritis. Mechanism of Action 2-Methoxyestradiol is an angiogenesis inhibitor, and has been shown to attack both tumor cells and their blood supply in preclinical testing. 2-methoxyestradiol is a naturally occurring estrogen metabolite but has no undesired estrogenic activity. Pharmacodynamics 2-Methoxyestradiol belongs to the family of drugs called angiogenesis inhibitors. It also acts as a vasodilator. 2-Methoxyestradiol (2MeOE2, NSC659853, 2ME2) is an endogenous metabolite of estradiol, with anti-tumor, anti-inflammatory, and anti-angiogenic activities. Its core anti-tumor mechanism involves suppressing microtubule dynamics (arresting mitosis) and inhibiting the HIF pathway (reducing hypoxia-induced tumor progression), independent of estrogen receptors [1,2,4] - In cancer, 2-Methoxyestradiol (2MeOE2, NSC659853, 2ME2) exerts anti-tumor effects by inducing G2/M cell cycle arrest (via microtubule disruption) and apoptosis (via caspase-dependent pathway), and inhibits tumor angiogenesis by downregulating HIF-mediated VEGF expression [1,2,4] - In autoimmune diseases (e.g., EAU), it alleviates inflammation by inhibiting lymphocyte proliferation and Th1/Th17 cell differentiation, reducing pro-inflammatory cytokine production [3] - Preclinically, 2-Methoxyestradiol (2MeOE2, NSC659853, 2ME2) has shown potential in solid tumors (brain glioma, lung cancer, breast cancer) and autoimmune diseases, but its low oral bioavailability may limit clinical application [3,4] |
| 分子式 |
C19H26O3
|
|---|---|
| 分子量 |
302.4079
|
| 精确质量 |
302.188
|
| 元素分析 |
C, 75.46; H, 8.67; O, 15.87
|
| CAS号 |
362-07-2
|
| 相关CAS号 |
2-Methoxyestradiol-13C,d3;1217470-09-1;2-Methoxyestradiol-13C6;2-Methoxyestradiol-d5;358731-34-7
|
| PubChem CID |
66414
|
| 外观&性状 |
Typically exists as white to off-white solids at room temperature
|
| 密度 |
1.2±0.1 g/cm3
|
| 沸点 |
464.4±45.0 °C at 760 mmHg
|
| 熔点 |
188-190°C
|
| 闪点 |
234.7±28.7 °C
|
| 蒸汽压 |
0.0±1.2 mmHg at 25°C
|
| 折射率 |
1.586
|
| LogP |
3.84
|
| tPSA |
49.69
|
| 氢键供体(HBD)数目 |
2
|
| 氢键受体(HBA)数目 |
3
|
| 可旋转键数目(RBC) |
1
|
| 重原子数目 |
22
|
| 分子复杂度/Complexity |
425
|
| 定义原子立体中心数目 |
5
|
| SMILES |
O([H])[C@@]1([H])C([H])([H])C([H])([H])[C@@]2([H])[C@]3([H])C([H])([H])C([H])([H])C4=C([H])C(=C(C([H])=C4[C@@]3([H])C([H])([H])C([H])([H])[C@@]21C([H])([H])[H])OC([H])([H])[H])O[H]
|
| InChi Key |
CQOQDQWUFQDJMK-SSTWWWIQSA-N
|
| InChi Code |
InChI=1S/C19H26O3/c1-19-8-7-12-13(15(19)5-6-18(19)21)4-3-11-9-16(20)17(22-2)10-14(11)12/h9-10,12-13,15,18,20-21H,3-8H2,1-2H3/t12-,13+,15-,18-,19-/m0/s1
|
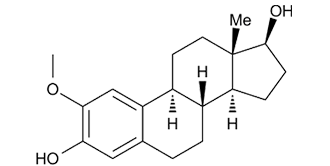
| 化学名 |
(8R,9S,13S,14S,17S)-2-methoxy-13-methyl-7,8,9,11,12,13,14,15,16,17-decahydro-6H-cyclopenta[a]phenanthrene-3,17-diol
|
| 别名 |
NSC 659853; NSC-659853; NSC659853; 2-ME; 2-Methoxy Estradiol. 2-methoxyestradiol; Panzem; 2-Methoxyestradiol-17beta; 2-Hydroxyestradol 2-methyl ether; 2ME2; 2-MeOE2; US brand name: Panzem. Abbreviation: 2-ME2.
|
| HS Tariff Code |
2934.99.9001
|
| 存储方式 |
Powder -20°C 3 years 4°C 2 years In solvent -80°C 6 months -20°C 1 month |
| 运输条件 |
Room temperature (This product is stable at ambient temperature for a few days during ordinary shipping and time spent in Customs)
|
| 溶解度 (体外实验) |
DMSO: 60 mg/mL (198.4 mM)
Water:<1 mg/mL
Ethanol:<1 mg/mL
|
|---|---|
| 溶解度 (体内实验) |
配方 1 中的溶解度: ≥ 2.08 mg/mL (6.88 mM) (饱和度未知) in 10% DMSO + 40% PEG300 + 5% Tween80 + 45% Saline (这些助溶剂从左到右依次添加,逐一添加), 澄清溶液。
例如,若需制备1 mL的工作液,可将100 μL 20.8 mg/mL澄清DMSO储备液加入400 μL PEG300中,混匀;然后向上述溶液中加入50 μL Tween-80,混匀;加入450 μL生理盐水定容至1 mL。 *生理盐水的制备:将 0.9 g 氯化钠溶解在 100 mL ddH₂O中,得到澄清溶液。 配方 2 中的溶解度: ≥ 2.08 mg/mL (6.88 mM) (饱和度未知) in 10% DMSO + 90% (20% SBE-β-CD in Saline) (这些助溶剂从左到右依次添加,逐一添加), 澄清溶液。 例如,若需制备1 mL的工作液,可将 100 μL 20.8 mg/mL澄清DMSO储备液加入900 μL 20% SBE-β-CD生理盐水溶液中,混匀。 *20% SBE-β-CD 生理盐水溶液的制备(4°C,1 周):将 2 g SBE-β-CD 溶解于 10 mL 生理盐水中,得到澄清溶液。 View More
配方 3 中的溶解度: ≥ 2.08 mg/mL (6.88 mM) (饱和度未知) in 10% DMSO + 90% Corn Oil (这些助溶剂从左到右依次添加,逐一添加), 澄清溶液。 配方 4 中的溶解度: 2% DMSO+corn oil:5mg/mL 1、请先配制澄清的储备液(如:用DMSO配置50 或 100 mg/mL母液(储备液)); 2、取适量母液,按从左到右的顺序依次添加助溶剂,澄清后再加入下一助溶剂。以 下列配方为例说明 (注意此配方只用于说明,并不一定代表此产品 的实际溶解配方): 10% DMSO → 40% PEG300 → 5% Tween-80 → 45% ddH2O (或 saline); 假设最终工作液的体积为 1 mL, 浓度为5 mg/mL: 取 100 μL 50 mg/mL 的澄清 DMSO 储备液加到 400 μL PEG300 中,混合均匀/澄清;向上述体系中加入50 μL Tween-80,混合均匀/澄清;然后继续加入450 μL ddH2O (或 saline)定容至 1 mL; 3、溶剂前显示的百分比是指该溶剂在最终溶液/工作液中的体积所占比例; 4、 如产品在配制过程中出现沉淀/析出,可通过加热(≤50℃)或超声的方式助溶; 5、为保证最佳实验结果,工作液请现配现用! 6、如不确定怎么将母液配置成体内动物实验的工作液,请查看说明书或联系我们; 7、 以上所有助溶剂都可在 Invivochem.cn网站购买。 |
| 制备储备液 | 1 mg | 5 mg | 10 mg | |
| 1 mM | 3.3068 mL | 16.5338 mL | 33.0677 mL | |
| 5 mM | 0.6614 mL | 3.3068 mL | 6.6135 mL | |
| 10 mM | 0.3307 mL | 1.6534 mL | 3.3068 mL |
1、根据实验需要选择合适的溶剂配制储备液 (母液):对于大多数产品,InvivoChem推荐用DMSO配置母液 (比如:5、10、20mM或者10、20、50 mg/mL浓度),个别水溶性高的产品可直接溶于水。产品在DMSO 、水或其他溶剂中的具体溶解度详见上”溶解度 (体外)”部分;
2、如果您找不到您想要的溶解度信息,或者很难将产品溶解在溶液中,请联系我们;
3、建议使用下列计算器进行相关计算(摩尔浓度计算器、稀释计算器、分子量计算器、重组计算器等);
4、母液配好之后,将其分装到常规用量,并储存在-20°C或-80°C,尽量减少反复冻融循环。
计算结果:
工作液浓度: mg/mL;
DMSO母液配制方法: mg 药物溶于 μL DMSO溶液(母液浓度 mg/mL)。如该浓度超过该批次药物DMSO溶解度,请首先与我们联系。
体内配方配制方法:取 μL DMSO母液,加入 μL PEG300,混匀澄清后加入μL Tween 80,混匀澄清后加入 μL ddH2O,混匀澄清。
(1) 请确保溶液澄清之后,再加入下一种溶剂 (助溶剂) 。可利用涡旋、超声或水浴加热等方法助溶;
(2) 一定要按顺序加入溶剂 (助溶剂) 。
| NCT Number | Recruitment | interventions | Conditions | Sponsor/Collaborators | Start Date | Phases |
| NCT00592579 | Completed | Drug: 2-methoxyestradiol | Relapsed Multiple Myeloma Plateau Phase Multiple Myeloma |
CASI Pharmaceuticals, Inc | March 2001 | Phase 2 |
| NCT00306618 | Completed | Drug: Panzem Nanocrystal Colloidal Dispersion |
Recurrent Glioblastoma Multiforme | CASI Pharmaceuticals, Inc. | January 2006 | Phase 2 |
| NCT00328497 | Completed | Drug: Panzem (2-methoxyestradiol) NCD, Avastin (Bevacizumab) |
Carcinoid Tumor | CASI Pharmaceuticals, Inc. | May 2006 | Phase 2 |
| NCT00481455 | Completed | Drug: Panzem NCD Drug: Temozolomide |
Recurrent Glioblastoma Multiforme | CASI Pharmaceuticals, Inc. | April 2007 | Phase 2 |
Treatment of 9L rat glioma cells with 2-methoxyestradiol (2ME2) at different oxygen concentration. Cancer Res. 2006 Dec 15;66(24):11991-7. |
A, a representative Gd-DTPA enhanced T1-weighted MRI image from each treatment group: left, before treatment; right, after treatment. B, summary of the tumor volume from the six rats in each group; all 24 rats before and after 2-methoxyestradiol treatment were measured by noninvasive post-contrast T1-weighted MRI. C, top left, acrylic brain matrices used to slice the rat brain into a 2-mm thickness from the tip of the frontal lobe of cerebrum (Start) to match with the MRI data that were scanned in the same orientation (End; bottom left). Cancer Res. 2006 Dec 15;66(24):11991-7. |
BLIs of HIF-1 activity are shown from three representative rats of each group at the end of 2-methoxyestradiol treatment. Right, scale of light intensity. Cancer Res. 2006 Dec 15;66(24):11991-7. |