| 规格 | 价格 | 库存 | 数量 |
|---|---|---|---|
| 10 mM * 1 mL in DMSO |
|
||
| 1mg |
|
||
| 2mg |
|
||
| 5mg |
|
||
| 10mg |
|
||
| 25mg |
|
||
| 50mg |
|
||
| 100mg |
|
||
| 250mg |
|
||
| Other Sizes |
|
| 靶点 |
GSK-3β (IC50 = 6.7 nM); GSK-3α (IC50 = 10 nM)
|
|---|---|
| 体外研究 (In Vitro) |
GSK-3 对 CHIR-99021 的选择性比其最接近的同源物 CDC2 和 ERK2 以及其他蛋白激酶高 500 倍以上。此外,CHIR-99021 仅对 23 种非激酶具有适度的抑制作用,并且与 22 种具有药理学意义的受体仅具有微弱的结合。 CHIR-99021 的 EC50 为 0.763 μM,可激活表达胰岛素受体的 CHO-IR 细胞中的糖原合酶 (GS)。 [1] 除了模拟胰岛素的作用外,CHIR-99021 (3 μM) 对 GSK-3 的抑制还导致游离胞质 - 连环蛋白增加 1.9 倍,模拟 3T3-L1 前脂肪细胞中的经典 Wnt 信号通路。通过在分化前三天的任何一天阻止 CCAAT/增强子结合蛋白 (C/EBP) 和过氧化物酶体增殖物激活受体 γ (PPARγ) 的诱导,CHIR-99021 治疗可防止前脂肪细胞分化,IC50 为 0.3 μM。 [2] 与氯化锂和 AR-A014418 不同,即使在高浓度下,CHIR-99021 处理也不会降低 INS-1E 细胞的活力。相反,CHIR-99021 以浓度依赖性方式显着降低高葡萄糖和高棕榈酸盐引起的 INS-1E 细胞死亡率。它还可以显着且剂量依赖性地增加 INS-1E 细胞增殖率。在低至 1 μM 的浓度下,CHIR-99021 可刺激离体大鼠胰岛中的原代 β 细胞复制,用 5 μM CHIR-99021 处理后,细胞复制增加 2-3 倍。 [3]
|
| 体内研究 (In Vivo) |
在 2 型糖尿病啮齿动物模型中,口服 30 mg/kg CHIR-99021 可改善葡萄糖代谢。口服给药后三到四个小时,血浆葡萄糖最大程度降低(大约 150 mg/dl),血浆胰岛素水平保持在或低于控制水平。在 ZDF 大鼠中,在口服葡萄糖挑战前每小时口服 16 或 48 mg/kg 剂量的 CHIR-99021 可显着改善葡萄糖耐量,在 16 mg/kg 和 48 mg/kg 剂量下血浆葡萄糖水平分别下降 14% 和 33%分别为 mg/kg 剂量。较高剂量的 CHIR-99021 还可减轻口服葡萄糖挑战前的高血糖。 [1]
|
| 酶活实验 |
聚丙烯 96 孔板填充有 300 μL/孔缓冲液(50 mM tris HCl、10 mM MgCl2、1 mM EGTA、1 mM 二硫苏糖醇、25 mM β-甘油磷酸、1 mM NaF、0.01% BSA、pH 7.5),其中含有 27 nM GSK-3α 或 29 nM GSK-3β 和 0.5 μM 生物素-CREB 肽底物。在所有无细胞测定中,先将不同浓度的 CHIR-99021 添加到 3.5 μL DMSO,然后添加 50 μL ATP 库存,以产生 1 M ATP 的终浓度。孵育后,将一式三份的 100 μL 等分试样添加到 Combiplate 8 板中,其中每孔含有 100 μL 浓度的 50 mM ATP 和 20 mM EDTA。 1小时后,用PBS冲洗孔5次,加入200μL闪烁液,密封,放置30分钟,在闪烁计数器中计数。所有步骤均在室温下进行。
激酶和激酶测定。[1] Erk2、蛋白激酶C(PKC)-α、PKC-ζ、p90RSK2、C-src、AMPK和pdk1激酶购自Upstate Biotechnology。如前所述,从HeLa细胞中纯化DNA-PK。其他重组人蛋白激酶在具有“glu”或六肽标签的SF9细胞中表达。如前所述纯化Glu标记蛋白,并根据制造商的说明纯化他的标记蛋白。 所有激酶测定都遵循相同的核心方案,肽底物和激活剂浓度变化如下所述。聚丙烯96孔板填充300μl/孔缓冲液(50 mmol/l三HCl、10 mmol/l MgCl2、1 mmol/l EGTA、1 mmol/1二硫苏糖醇、25 mmol/lβ-甘油磷酸、1 mmol/l NaF、0.01%BSA、pH 7.5),其中含有激酶、肽底物和任何激活剂。这些测定的激酶浓度、肽底物和激活剂(如适用)信息如下:GSK-3α(27 nmol/l和0.5μmol/l生物素CREB肽);GSK-3β(29 nmol/l,和0.5μmol/l生物素CREB肽);cdc2(0.8 nmol/l和0.5μmol/l生物素组蛋白H1肽);erk2(400单位/ml,和髓鞘碱性蛋白包被的闪板;PKC-α(1.6 nmol/l,0.5μmol/l生物素组蛋白H1肽,和0.1 mg/ml磷脂酰丝氨酸+0.01 mg/ml二甘油酯);PKC-ζ(0.1 nmol/l,0.5μmol/l生物素-PKC-86肽和50μg/ml磷脂酰丝氨酸+5μg/ml二酰甘油);akt1(5.55nmol/l和0.5μmol/l生物素磷酸化AKT肽);p70 S6激酶(1.5 nmol/l和0.5μmol/l生物素GGGKRRRLASLRA);p90 RSK2(0.049单位/ml和0.5μmol/l生物素GGGKRRRLASLRA);c-src(4.1单位/ml和0.5μmol/l生物素KVEKIGEGTYGVVYK);Tie2(1μg/ml和200 nmol/l生物素GGGGAPEDL-YKDFLT);flt1(1.8 nmol/l和0.25μmol/l KDRY1175[B91616]生物素GGGGQDGKDYIVLPI-NH2);KDR(0.95 nmol/l和0.25μmol/l KDRY1175[B91616]生物素-GGGQDGKDYIVLPI-NH2);bFGF受体酪氨酸激酶(RTK;2 nmol/l和0.25μmol/l KDRY1175[B91616]生物素-GGGGGQDGKDYIVLPI-NH2);IGF1 RTK(1.91 nmol/l和1μmol/l生物素GGGGKKKSPGEYVNIEFG酰胺);胰岛素RTK(使用DG44 IR细胞;见33);AMP激酶(470单位/ml、50μmol/l SAMS肽和300μmol/l AMP);pdk1(0.25 nmol/l、2.9 nmol/l未活化的Akt和20μmol/l DOPC和DOPS+2μmol/l PIP3);CHK1(1.4 nmol/l和0.5μmol/l生物素-cdc25肽);CK1-ε(3 nmol/l,和0.2μmol/l生物素肽);DNA PK(见31);和磷脂酰肌醇(PI)3-激酶(5nmol/l和2μg/ml PI)。在所有无细胞测定中,将受试化合物或对照加入3.5μl DMSO中,然后加入50μl ATP储备,以产生1μmol/l ATP的最终浓度。孵育后,将一式三份的100μl等分试样转移到含有100μl/孔50μmol/l ATP和20 mmol/l EDTA的Combiplate八块板中。1小时后,用PBS冲洗孔5次,填充200μl闪烁液,密封,静置30分钟,并在闪烁计数器中计数。所有步骤均在室温下进行。抑制计算为100%×(抑制−无酶对照)/(DMSO对照−无酶控制)。 酶和受体面板。[1] 在Cerep“酶”面板上测试了对非激酶的选择性,包括乙酰胆碱酯酶;腺苷酸环化酶;Na/K-ATP酶;组织蛋白酶B和G;环氧合酶1和2;ECE;上皮生长因子受体;弹性蛋白酶;鸟苷酸环化酶;HIV-1蛋白酶;诱导型一氧化氮合酶;5-脂氧合酶;单胺氧化酶A和B;磷酸二酯酶I、II、III和IV;PKC;磷脂酶A2和C;和酪氨酸羟化酶。在MDS“图谱”面板上测试了对受体的选择性,包括腺苷A1;肾上腺素能(α1和α2非选择性和β1和β2);L型钙通道;多巴胺D1和D2;雌激素α;GABAA(激动剂位点和钠通道);糖皮质激素;谷氨酸(NMDA/苯环利定和非选择性);甘氨酸(对士的宁敏感);组胺H1(中枢);胰岛素毒蕈碱M2和M3;阿片类药物δ、κ和μ;佛波酯;钾通道;孕酮;5-羟色胺(5-HT1和5-HT2/非选择性);西格玛(非选择性);钠通道(位点2);和睾酮。 GS活性测定。[1] 表达人胰岛素受体的CHO-IR细胞在含有10%胎牛血清且不含次黄嘌呤的Hamm’s F12培养基中生长至80%汇合。将胰蛋白酶化细胞以1×106个细胞/孔的速度接种在6孔板中的2ml不含胎牛血清的培养基中。24小时后,用1 ml含有GSK-3抑制剂或对照(最终DMSO浓度<0.1%)的无血清培养基在37°C下替换培养基30分钟。通过在50 mmol/l tris(pH 7.8)中冷冻/解冻裂解细胞,该溶液含有1 mmol/l EDTA、1 mmol/lDTT、100 mmol/l NaF、1 mmol/l苯基甲基磺酰氟和25μg/ml亮蛋白肽(缓冲液A),并在4°C/14000g下离心15分钟。GS的活性比使用Thomas等人的滤纸测定法计算为在不存在葡萄糖-6-磷酸的情况下的GS活性除以在存在5mmol/l葡萄糖-6-磷酸时的活性。 在水稻肝脏实验室制备体重<140 g的雄性Sprague-Dawley大鼠的原代肝细胞,并在分离后1-3小时使用。将1×106细胞在1 ml DMEM/F12培养基加0.2%BSA和GSK-3抑制剂或对照中的等分试样在12孔板中在37°C的低速摇床上在富含CO2的气氛中孵育30分钟,通过离心收集并通过在缓冲液a加0.01%NP40中冷冻/解冻裂解;再次使用Thomas等人的方法进行GS测定。 |
| 细胞实验 |
细胞在饥饿培养基(仅含 5 mM 葡萄糖、1% 胎牛血清的培养基)中维持 24 小时。然后,将细胞暴露于不同浓度的 CHIR-99021 1、3 或 4 天。细胞 DNA 用 CyQuant 染料染色,当与 DNA 结合时,该染料会发出荧光,以便计算存在的细胞数量。使用 FLUOstar Optima 读数器,在孵育 30 分钟后测量荧光。 BrdUrd 掺入控制细胞复制。在用 FixDenat 溶液固定细胞并与单克隆抗 BrdUrd-POD 抗体一起孵育之前,在实验的最后 4 小时将 BrdUrd 标记溶液添加到培养基中。将底物溶液添加到每个孔后,使用 Analyst HT 检测系统在微孔板发光计中测量光发射。
|
| 动物实验 |
Female db/db mice or male ZDF rats with type 2 diabetes
~48 mg/kg Oral Administration Efficacy models.[1] Blood was obtained by shallow tail snipping at lidocaine-anesthetized tips. Blood glucose was measured directly or heparinized plasma was collected for measurement of glucose or insulin. Animals were prebled and randomized to vehicle control or GSK-3 inhibitor treatment groups. For glucose tolerance tests (GTTs), animals were fasted throughout the procedure with food removal early in the morning, 3 h before first prebleed (db/db mice), or the previous night, 16 h before the bleed (ZDF rats). When the time course of plasma glucose and insulin changes in fasting ZDF rats was measured, food was removed ∼16 h before test agent administration. The glucose challenges in the GTT were 1.35 g/kg i.p. (ipGTT) or 2 g/kg via oral gavage (oGTT). Test inhibitors were formulated as solutions in 20 mmol/l citrate-buffered 15% Captisol or as fine suspensions in 0.5% carboxymethylcellulose. |
| 参考文献 | |
| 其他信息 |
Insulin resistance plays a central role in the development of type 2 diabetes, but the precise defects in insulin action remain to be elucidated. Glycogen synthase kinase 3 (GSK-3) can negatively regulate several aspects of insulin signaling, and elevated levels of GSK-3 have been reported in skeletal muscle from diabetic rodents and humans. A limited amount of information is available regarding the utility of highly selective inhibitors of GSK-3 for the modification of insulin action under conditions of insulin resistance. In the present investigation, we describe novel substituted aminopyrimidine derivatives that inhibit human GSK-3 potently (K(i) < 10 nmol/l) with at least 500-fold selectivity against 20 other protein kinases. These low molecular weight compounds activated glycogen synthase at approximately 100 nmol/l in cultured CHO cells transfected with the insulin receptor and in primary hepatocytes isolated from Sprague-Dawley rats, and at 500 nmol/l in isolated type 1 skeletal muscle of both lean Zucker and ZDF rats. It is interesting that these GSK-3 inhibitors enhanced insulin-stimulated glucose transport in type 1 skeletal muscle from the insulin-resistant ZDF rats but not from insulin-sensitive lean Zucker rats. Single oral or subcutaneous doses of the inhibitors (30-48 mg/kg) rapidly lowered blood glucose levels and improved glucose disposal after oral or intravenous glucose challenges in ZDF rats and db/db mice, without causing hypoglycemia or markedly elevating insulin. Collectively, our results suggest that these selective GSK-3 inhibitors may be useful as acute-acting therapeutics for the treatment of the insulin resistance of type 2 diabetes.[1]
We have identified Wnt10b as a potent inhibitor of adipogenesis that must be suppressed for preadipocytes to differentiate in vitro. Here, we demonstrate that a specific inhibitor of glycogen synthase kinase 3, CHIR 99021, mimics Wnt signaling in preadipocytes. CHIR 99021 stabilizes free cytosolic beta-catenin and inhibits adipogenesis by blocking induction of CCAAT/enhancer-binding protein alpha and peroxisome proliferator-activated receptor gamma. Preadipocyte differentiation is inhibited when 3T3-L1 cells are exposed to CHIR 99021 for any 24 h period during the first 3 days of adipogenesis. Consistent with this time frame of inhibition, expression of Wnt10b mRNA is suppressed upon induction of differentiation, with a 50% decline by 6 h and complete inhibition by 36 h. Of the agents used to induce differentiation, exposure of 3T3-L1 cells to methyl-isobutylxanthine or cAMP is sufficient to suppress expression of Wnt10b mRNA. Inhibition of adipogenesis by Wnt10b is likely mediated by Wnt receptors, Frizzled 1, 2, and/or 5, and co-receptors low density lipoprotein receptor-related proteins 5 and 6. These receptors, like Wnt10b, are highly expressed in preadipocytes and stromal vascular cells. Finally, we demonstrate that disruption of extracellular Wnt signaling by expression of secreted Frizzled related proteins causes spontaneous adipocyte conversion.[2] Recent developments indicate that the regeneration of beta cell function and mass in patients with diabetes is possible. A regenerative approach may represent an alternative treatment option relative to current diabetes therapies that fail to provide optimal glycemic control. Here we report that the inactivation of GSK3 by small molecule inhibitors or RNA interference stimulates replication of INS-1E rat insulinoma cells. Specific and potent GSK3 inhibitors also alleviate the toxic effects of high concentrations of glucose and the saturated fatty acid palmitate on INS-1E cells. Furthermore, treatment of isolated rat islets with structurally diverse small molecule GSK3 inhibitors increases the rate beta cell replication by 2-3-fold relative to controls. We propose that GSK3 is a regulator of beta cell replication and survival. Moreover, our results suggest that specific inhibitors of GSK3 may have practical applications in beta cell regenerative therapies.[3] |
| 分子式 |
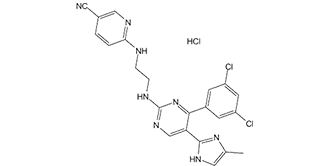
C22H19CL3N8
|
|---|---|
| 分子量 |
501.7989
|
| 精确质量 |
500.079
|
| 元素分析 |
C, 52.66; H, 3.82; Cl, 21.19; N, 22.33
|
| CAS号 |
1797989-42-4
|
| 相关CAS号 |
Laduviglusib;252917-06-9;Laduviglusib trihydrochloride;1782235-14-6
|
| PubChem CID |
71295844
|
| 外观&性状 |
White to yellow solid powder
|
| LogP |
0
|
| tPSA |
115Ų
|
| 氢键供体(HBD)数目 |
4
|
| 氢键受体(HBA)数目 |
7
|
| 可旋转键数目(RBC) |
7
|
| 重原子数目 |
33
|
| 分子复杂度/Complexity |
645
|
| 定义原子立体中心数目 |
0
|
| SMILES |
ClC1C=C(C=CC=1C1C(=CN=C(N=1)NCCNC1C=CC(C#N)=CN=1)C1=NC=C(C)N1)Cl.Cl
|
| InChi Key |
SCQDMKUZHIGAIB-UHFFFAOYSA-N
|
| InChi Code |
InChI=1S/C22H18Cl2N8.ClH/c1-13-10-29-21(31-13)17-12-30-22(32-20(17)16-4-3-15(23)8-18(16)24)27-7-6-26-19-5-2-14(9-25)11-28-19;/h2-5,8,10-12H,6-7H2,1H3,(H,26,28)(H,29,31)(H,27,30,32);1H
|
| 化学名 |
6-[2-[[4-(2,4-dichlorophenyl)-5-(5-methyl-1H-imidazol-2-yl)pyrimidin-2-yl]amino]ethylamino]pyridine-3-carbonitrile;hydrochloride
|
| 别名 |
GSK 3IXV; CHIR99021; CHIR 99021; CHIR-911; CHIR911; CHIR 911; CT- 99021; GSK 3 inhibitor XVI; CT-99021; CT- 99021; CHIR-73911; CHIR73911; CHIR 73911
|
| HS Tariff Code |
2934.99.9001
|
| 存储方式 |
Powder -20°C 3 years 4°C 2 years In solvent -80°C 6 months -20°C 1 month 注意: 请将本产品存放在密封且受保护的环境中,避免吸湿/受潮。 |
| 运输条件 |
Room temperature (This product is stable at ambient temperature for a few days during ordinary shipping and time spent in Customs)
|
| 溶解度 (体外实验) |
DMSO: ~100 mg/mL (~199.3 mM)
Water: ~1.5 mg/mL(~3 mM) Ethanol: ~100 mg/mL(~199.3 mM) |
|---|---|
| 溶解度 (体内实验) |
配方 1 中的溶解度: ≥ 3 mg/mL (5.98 mM) (饱和度未知) in 10% DMSO + 40% PEG300 + 5% Tween80 + 45% Saline (这些助溶剂从左到右依次添加,逐一添加), 澄清溶液。
例如,若需制备1 mL的工作液,可将100 μL 30.0 mg/mL 澄清的 DMSO 储备液加入到400 μL PEG300中,混匀;再向上述溶液中加入50 μL Tween-80,混匀;然后加入450 μL 生理盐水定容至1 mL。 *生理盐水的制备:将 0.9 g 氯化钠溶解在 100 mL ddH₂O中,得到澄清溶液。 配方 2 中的溶解度: ≥ 3 mg/mL (5.98 mM) (饱和度未知) in 10% DMSO + 90% (20% SBE-β-CD in Saline) (这些助溶剂从左到右依次添加,逐一添加), 澄清溶液。 例如,若需制备1 mL的工作液,可将 100 μL 30.0 mg/mL澄清DMSO储备液加入900 μL 20% SBE-β-CD生理盐水溶液中,混匀。 *20% SBE-β-CD 生理盐水溶液的制备(4°C,1 周):将 2 g SBE-β-CD 溶解于 10 mL 生理盐水中,得到澄清溶液。 View More
配方 3 中的溶解度: ≥ 3 mg/mL (5.98 mM) (饱和度未知) in 10% DMSO + 90% Corn Oil (这些助溶剂从左到右依次添加,逐一添加), 澄清溶液。 配方 4 中的溶解度: ~20 mg/mL (40 mM) in 5% DMSO+30% PEG 300+ddH2O, 澄清溶液 配方 5 中的溶解度: ~5 mg/mL (10 mM) in PBS, 澄清溶液 配方 6 中的溶解度: ≥ 3 mg/mL (6 mM) in 10% DMSO + 40% PEG300 + 5% Tween80 + + 45% Saline, 澄清溶液 例如,要配制1 mL工作液,可取100 μL 30 mg/mL DMSO储备液,加入tO+400 μL PEG300,混匀(澄清液); 然后向上述溶液中加入50 μL Tween 80,混匀(澄清溶液); 最后在上述溶液中加入450 μL生理盐水,混匀(澄清溶液). *生理盐水的制备:将 0.9 g 氯化钠溶解在 100 mL ddH 2 O 中,得到溶液。 配方 7 中的溶解度: ≥ 3 mg/mL (6 mM) in 10% DMSO + 90% (20% SBE-β-CD in saline), 澄清溶液 例如,若要配制1 mL工作液,可取100 μL 30 mg/mL DMSO储备液,加入900 μL 20% SBE-β-CD生理盐水中,混匀(澄清溶液) 。 *20% SBE-β-CD 生理盐水溶液的制备((4°C,1 周)):将 2 g SBE-β-CD 溶解于 10 mL 生理盐水中,得到溶液 配方 8 中的溶解度: ≥ 3 mg/mL (6 mM) in 10% DMSO + 90% Corn oil, 澄清溶液 例如,要配制1 mL工作液,可取100 μL 30 mg/mL DMSO储备液,加入900 μL玉米油中,混匀(澄清溶液)。 配方 9 中的溶解度: 5 mg/mL (9.96 mM) in PBS (这些助溶剂从左到右依次添加,逐一添加), 澄清溶液; 超声助溶. 1、请先配制澄清的储备液(如:用DMSO配置50 或 100 mg/mL母液(储备液)); 2、取适量母液,按从左到右的顺序依次添加助溶剂,澄清后再加入下一助溶剂。以 下列配方为例说明 (注意此配方只用于说明,并不一定代表此产品 的实际溶解配方): 10% DMSO → 40% PEG300 → 5% Tween-80 → 45% ddH2O (或 saline); 假设最终工作液的体积为 1 mL, 浓度为5 mg/mL: 取 100 μL 50 mg/mL 的澄清 DMSO 储备液加到 400 μL PEG300 中,混合均匀/澄清;向上述体系中加入50 μL Tween-80,混合均匀/澄清;然后继续加入450 μL ddH2O (或 saline)定容至 1 mL; 3、溶剂前显示的百分比是指该溶剂在最终溶液/工作液中的体积所占比例; 4、 如产品在配制过程中出现沉淀/析出,可通过加热(≤50℃)或超声的方式助溶; 5、为保证最佳实验结果,工作液请现配现用! 6、如不确定怎么将母液配置成体内动物实验的工作液,请查看说明书或联系我们; 7、 以上所有助溶剂都可在 Invivochem.cn网站购买。 |
| 制备储备液 | 1 mg | 5 mg | 10 mg | |
| 1 mM | 1.9928 mL | 9.9641 mL | 19.9283 mL | |
| 5 mM | 0.3986 mL | 1.9928 mL | 3.9857 mL | |
| 10 mM | 0.1993 mL | 0.9964 mL | 1.9928 mL |
1、根据实验需要选择合适的溶剂配制储备液 (母液):对于大多数产品,InvivoChem推荐用DMSO配置母液 (比如:5、10、20mM或者10、20、50 mg/mL浓度),个别水溶性高的产品可直接溶于水。产品在DMSO 、水或其他溶剂中的具体溶解度详见上”溶解度 (体外)”部分;
2、如果您找不到您想要的溶解度信息,或者很难将产品溶解在溶液中,请联系我们;
3、建议使用下列计算器进行相关计算(摩尔浓度计算器、稀释计算器、分子量计算器、重组计算器等);
4、母液配好之后,将其分装到常规用量,并储存在-20°C或-80°C,尽量减少反复冻融循环。
计算结果:
工作液浓度: mg/mL;
DMSO母液配制方法: mg 药物溶于 μL DMSO溶液(母液浓度 mg/mL)。如该浓度超过该批次药物DMSO溶解度,请首先与我们联系。
体内配方配制方法:取 μL DMSO母液,加入 μL PEG300,混匀澄清后加入μL Tween 80,混匀澄清后加入 μL ddH2O,混匀澄清。
(1) 请确保溶液澄清之后,再加入下一种溶剂 (助溶剂) 。可利用涡旋、超声或水浴加热等方法助溶;
(2) 一定要按顺序加入溶剂 (助溶剂) 。
| NCT Number | Status | Interventions | Conditions | Sponsor/Collaborators | Start Date | Phases |
| NCT03616223 | Completed | Drug: FX-322 Drug: Placebo |
Sensorineural Hearing Loss |
Frequency Therapeutics | July 3, 2018 | Phase 1 Phase 2 |
|
|---|
|