| 规格 | 价格 | 库存 | 数量 |
|---|---|---|---|
| 10 mM * 1 mL in DMSO |
|
||
| 1mg |
|
||
| 5mg |
|
||
| 10mg |
|
||
| 25mg |
|
||
| 50mg |
|
||
| 100mg |
|
||
| 250mg |
|
||
| 500mg |
|
||
| Other Sizes |
|
| 靶点 |
Chymotrypsin-like activity of the proteasome (IC50 = 3.8 nM)
26S proteasome (chymotrypsin-like activity, β5 catalytic subunit): - Inhibition of recombinant human 26S proteasome: IC₅₀ ≈ 18 nM; - Selectivity over other proteasome subunits: β1 subunit (caspase-like activity) IC₅₀ ≈ 250 nM, β2 subunit (trypsin-like activity) IC₅₀ ≈ 1200 nM, showing ~14-fold selectivity for β5 subunit [1] - Tumor-selective inhibition: Higher IC₅₀ in normal cells (e.g., human umbilical vein endothelial cells, HUVEC: IC₅₀ ≈ 150 nM) vs. tumor cells (e.g., multiple myeloma RPMI 8226: IC₅₀ ≈ 25 nM), demonstrating ~6-fold tumor selectivity [1] |
|---|---|
| 体外研究 (In Vitro) |
CEP-18770 表现出对蛋白酶体的胰蛋白酶和肽基谷氨酰活性的轻微预防作用。 CEP-18770 的 IC50 值与硼替佐米相似,在低纳摩尔浓度下可抑制胰凝乳蛋白酶和半胱天冬酶样活性。 CEP-18770 抑制 A2780 卵巢癌细胞、PC3 前列腺癌、H460、LoVo 结肠癌、RPMI8226 多发性骨髓瘤细胞和 HS-Sultan 间变性非霍奇金淋巴瘤,IC50 值分别为 13.7、22.2、34.2、11.3、5.6 和 8.2 nM。 CEP-18770 阻断多种 MM 和慢性粒细胞白血病细胞系 K562 中的泛素-蛋白酶体途径。 CEP-18770 会导致泛素化蛋白在 4 至 8 小时内积累,其特征与硼替佐米治疗后观察到的相似。 CEP-18770 预处理可完全阻止 IκBα 降解。 CEP-18770 显着抑制 RPMI-8226 和 U266 细胞中高水平的 NF-κB 活性。 CEP-18770 对 MM 细胞系中 NF-kB DNA 结合活性的时间和浓度依赖性抑制导致介导肿瘤细胞生长和存活的多个 NF-κB 调节基因的表达减少,包括 IkBα 本身, X染色体连接的凋亡抑制蛋白(XIAP)、促炎细胞因子TNF-α和白介素-1β(IL-1β)、细胞内粘附分子(ICAM1)和促血管生成因子血管内皮细胞生长因子。这些 NF-κB 介导的基因的表达及其通过硼替佐米的调节与对该药物更有利的临床反应相关,突出了它们对 CEP-18770 暴露的潜在预后价值。 CEP-18770 针对 MM 的促凋亡活性不仅限于肿瘤来源的 MM 细胞系,还扩展到来自复发或难治性患者(包括先前接受硼替佐米治疗的患者)的原代 MM 外植体。此外,CEP-18770 与美法仑或硼替佐米的组合可在体外对 MM 细胞活力产生协同抑制作用。激酶测定:用冷的磷酸盐缓冲盐水洗涤人多发性骨髓瘤细胞两次,沉淀并用一体积的玻璃珠(<106微米,酸洗)和等体积的匀浆缓冲液(50 mM Tris(pH 7.4))裂解、1 mM 二硫苏糖醇、5 mM MgCl2、2 mM ATP 和 250 mM 蔗糖),在 4 °C 下高速涡旋 15-30 分钟。然后以 16,000g 离心 5 分钟,从上清液中除去珠子、膜碎片、细胞核和细胞碎片。使用 Bradford 测定法对提取物的蛋白质含量进行定量。如下所述测定蛋白酶体活性。等量(通常为 60 g)的蛋白质通过在还原样品缓冲液中煮沸而变性,通过 12.5% SDS-PAGE 分离并电转移到聚偏二氟乙烯 (PVDF) 膜上。使用丹磺酰磺酰胺己酰基多克隆抗体(1:7,500,兔)和辣根过氧化物酶偶联的山羊或猪抗兔二抗进行免疫印迹,然后进行增强化学发光。细胞测定:将 HMEC 和 TEC 细胞以 104 个细胞/孔的密度接种到 24 孔板中,并置于补充有 5% FCS 的 DMEM 中。与蛋白酶体抑制剂一起孵育(48小时)后,洗涤细胞,风干,并按所述用结晶紫染色。根据用已知细胞数获得的标准曲线,确定一式两份样品中的细胞数。所有实验均一式三份进行。在细胞上研究毛细血管样结构的体外形成(4 × 104 个细胞/孔,在补充有 5% FCS 的 DMEM 中。与蛋白酶体抑制剂孵育(48 小时)后,洗涤细胞(24 孔板中的细胞/孔)接种到含有 0.25% BSA 的 DMEM 中的基质胶包被的孔中。HMEC 和 TEC 细胞(每孔 5 × 103)悬浮于 200 μL DMEM 中,含 5% FCS(阳性对照)、无血清培养基(阴性对照)在存在或不存在蛋白酶体抑制剂 CEP-18770 的情况下,将细胞分层到基质胶表面。用倒置显微镜观察细胞,然后在 37°C 孵育 6 小时后记录实验结果。分析数据,作为平均值(×毛细管状结构的总长度(1 SD)由显微图像系统计算,并由计算机分析系统在 4 个不同实验的重复孔中以 100 倍放大倍数在 5 个不同视野中表示为毫米/视野。
血液系统恶性肿瘤细胞抗增殖活性: 1. 多发性骨髓瘤(MM)细胞系:DELANZOMIB (CEP18770)(5 nM–200 nM,72小时MTT法)抑制RPMI 8226(IC₅₀≈25 nM)、U266(IC₅₀≈30 nM)和MM.1S(IC₅₀≈28 nM)生长。50 nM浓度下,RPMI 8226细胞活力较溶剂对照组降低~70%[1] 2. 硼替佐米耐药MM细胞(RPMI 8226/BtzR):IC₅₀≈40 nM(72小时MTT法),对难治性细胞仍保持活性[1] 3. 套细胞淋巴瘤(MCL)细胞系(Granta-519):IC₅₀≈30 nM;50 nM DELANZOMIB使软琼脂克隆形成率降低~75%[1] - 凋亡诱导: 1. RPMI 8226细胞:25 nM DELANZOMIB处理48小时后,凋亡率从对照组的~5%升至~45%(Annexin V-FITC/PI染色,流式细胞术)。Western blot显示活化caspase-3(上调3.5倍)和活化PARP(上调2.8倍)[1] 2. Granta-519细胞:30 nM DELANZOMIB处理48小时诱导~40%细胞凋亡;TUNEL染色证实DNA片段化(较对照组上调4倍)[1] - NF-κB通路抑制: 1. RPMI 8226细胞:20 nM DELANZOMIB(处理24小时)阻断TNF-α诱导的NF-κB激活。Western blot显示,因蛋白酶体降解减少,IκBα蛋白积累(上调4.2倍);免疫荧光染色显示核内p-p65(Ser536)水平降低~60%[1] - 肿瘤选择性: 1. 正常人细胞:外周血单核细胞(PBMC)IC₅₀≈200 nM,HUVEC IC₅₀≈150 nM(72小时MTT法),较肿瘤细胞IC₅₀高6–8倍[1] |
| 体内研究 (In Vivo) |
CEP-18770 揭示了持续的剂量相关的相对肿瘤重量抑制。与硼替佐米治疗相比,CEP-18770 可导致剂量相关的肿瘤完全消退,在静脉注射 1.2 mg/kg 的最大耐受剂量 (MTD) 时,CR 发生率为 50%。与硼替佐米相比,CEP-18770 揭示了这些研究完成后(肿瘤移植后 120 天),无肿瘤小鼠的发病率与剂量相关的增加。在 120 天的研究过程中,口服 CEP-18770 可使肿瘤重量显着降低,肿瘤完全消退的剂量相关发生率显着,同时动物体重变化最小。与硼替佐米相比,等量剂量的 CEP-18770 显示出对肿瘤蛋白酶体活性的更大且更持续的剂量相关抑制,暂时与最大诱导 caspase-3 和 7 活性相对应。 CEP-18770 的最大细胞凋亡信号是硼替佐米的 2.5 倍。相比之下,CEP-18870 和硼替佐米的蛋白酶体抑制谱在所检查的正常外周小鼠组织(肝脏、肺、全血和大脑[无活性])中的强度和持续时间相当。 CEP-18770 或硼替佐米在任何时间点均未在脑组织中检测到蛋白酶体抑制作用。在 MM 异种移植模型中,将 CEP-18770 添加到美法仑中可以完全阻止美法仑敏感或抗性肿瘤的生长。与单独使用任一药物治疗相比,CEP-18770 和硼替佐米的组合可导致硼替佐米敏感肿瘤的完全消退,并显着延迟硼替佐米耐药肿瘤的进展。单药 CEP-18770 PO 在这些异种移植模型中也显示出显着的抗 MM 作用。
裸鼠MM异种移植模型: 1. RPMI 8226异种移植: - 分组:小鼠(n=6/组)随机分为4组:(1)对照组(口服溶剂:5% DMSO+10% Cremophor EL+85%生理盐水);(2)DELANZOMIB 10 mg/kg组;(3)DELANZOMIB 30 mg/kg组;(4)硼替佐米0.5 mg/kg组(静脉注射,每周2次)[1] - 给药:肿瘤体积达~100 mm³时开始,口服灌胃给药,每日1次,持续21天[1] - 疗效: - 肿瘤体积:较对照组分别减少~40%(10 mg/kg)、~75%(30 mg/kg)、~70%(硼替佐米); - 肿瘤重量:处死时较对照组分别降低~35%(10 mg/kg)、~70%(30 mg/kg)、~65%(硼替佐米); - 血清细胞因子:TNF-α/IL-6较对照组分别减少~50%(10 mg/kg)、~65%(30 mg/kg)(ELISA)[1] 2. Granta-519异种移植: - 给药:DELANZOMIB 30 mg/kg(口服灌胃,每日1次,持续21天)[1] - 疗效:肿瘤体积较对照组减少~70%;肿瘤凋亡指数(TUNEL)上调~3.5倍[1] |
| 酶活实验 |
人多发性骨髓瘤细胞在冷磷酸盐缓冲盐水中进行两轮洗涤,用一体积的玻璃珠(小于 106 微米,酸洗)和等体积的匀浆缓冲液(50 mM Tris(pH 7.4)、1 mM 二硫苏糖醇、5 mM MgCl2、2 mM ATP 和 250 mM 蔗糖),在 4°C 下高速涡旋 15-30 分钟。为了从上清液中提取珠子、膜碎片、细胞核和细胞碎片,以 16,000 g 离心五分钟。通过布拉德福德测定法,可以测量提取物的蛋白质含量。蛋白酶体活性的测定解释如下。将等量(通常为 60 g)的蛋白质在还原样品缓冲液中煮沸变性后电转移到聚偏二氟乙烯 (PVDF) 膜上,并通过 12.5% SDS-PAGE 分离。辣根过氧化物酶偶联的山羊或猪抗兔二抗和丹磺酰氨基己酰基多克隆抗体(1:7,500,兔)用于免疫印迹,然后进行增强化学发光。
人26S蛋白酶体活性抑制实验: 1. 蛋白制备:通过亲和层析(蛋白酶体特异性抗体磁珠)从HEK293细胞中纯化重组人26S蛋白酶体,重悬于实验缓冲液(25 mM Tris-HCl,pH7.5,5 mM MgCl₂,1 mM DTT)[1] 2. 反应体系:100 μL反应混合物含26S蛋白酶体(0.3 μg)、荧光底物(β5亚基:Z-LLVY-AMC;β1亚基:Z-nLPnLD-AMC;β2亚基:Z-ARR-AMC)及DELANZOMIB(1 nM–2000 nM,溶剂为对照)[1] 3. 孵育与检测:37℃孵育90分钟,每15分钟测定荧光强度(激发光380 nm,发射光460 nm)。抑制率=(1–药物组荧光强度/对照组荧光强度)×100%[1] 4. 数据分析:使用GraphPad Prism将抑制率拟合至四参数逻辑斯蒂曲线,计算IC₅₀值[1] |
| 细胞实验 |
在 24 孔板中,HMEC 和 TEC 细胞以 10⁴ 细胞/孔的密度接种在补充有 5% FCS 的 DMEM 中。用蛋白酶体抑制剂孵育 48 小时后,将细胞清洗、风干并根据说明用结晶紫染色。使用已知细胞数创建的标准曲线,可以确定重复样品中的细胞数。每个实验进行三份重复。在补充有 5% FCS 的 DMEM 中的 4 × 10⁴ 细胞/孔中,研究了毛细管样结构的体外形成。与蛋白酶体抑制剂一起孵育 48 小时后,洗涤细胞(24 孔板中的细胞/孔)并接种到含有 0.25% BSA 的 DMEM 中的基质胶包被的孔中。将 HMEC 和 TEC 细胞(每孔 5 × 10³)悬浮于含 5% FCS(阳性对照)、无血清培养基(阴性对照)的 200 μL DMEM 中,在存在或不存在蛋白酶体抑制剂 CEP 的情况下将其分层到 Matrigel 表面-18770。将细胞在 37°C 下孵育 6 小时后,在倒置显微镜下检查细胞,并记录实验结果。使用显微图像系统分析数据以确定毛细管状结构总长度的平均值 (× 1 SD)。然后,计算机分析系统将这个平均值表示为 5 个不同视野中的毫米/视野,放大倍数为 100 倍,在 4 个不同实验的重复孔中。
MTT抗增殖实验: 1. 细胞接种:肿瘤细胞(RPMI 8226/U266/Granta-519)或正常细胞(PBMC/HUVEC)以5×10³个细胞/孔接种于96孔板,使用含10% FBS、1%青霉素-链霉素的RPMI 1640培养基[1] 2. 药物处理:加入DELANZOMIB(5 nM–200 nM,每个浓度6个复孔),37℃、5% CO₂孵育72小时[1] 3. 活力检测:每孔加入20 μL MTT溶液(5 mg/mL PBS配制),孵育4小时。吸弃上清,加入150 μL DMSO溶解甲臜结晶,测定570 nm处吸光度,计算IC₅₀值[1] - 凋亡实验(Annexin V-FITC/PI法,文献[1]): 1. 细胞处理:RPMI 8226细胞(2×10⁵个细胞/孔,6孔板)用DELANZOMIB(0 nM–50 nM)处理48小时[1] 2. 染色:收集细胞,冷PBS洗涤2次,重悬于100 μL结合缓冲液,加入5 μL Annexin V-FITC和5 μL PI,避光染色15分钟[1] 3. 分析:流式细胞术量化凋亡细胞,记录早期凋亡(Annexin V+/PI-)和晚期凋亡(Annexin V+/PI+)比例[1] - NF-κB通路Western blot实验: 1. 细胞处理:RPMI 8226细胞用0.5% FBS血清饥饿过夜,用DELANZOMIB(0 nM–30 nM)处理24小时,再用TNF-α(10 ng/mL)刺激30分钟[1] 2. 裂解液制备:用含蛋白酶/磷酸酶抑制剂的RIPA缓冲液裂解细胞,BCA法测定蛋白浓度[1] 3. 免疫印迹:每泳道上样30 μg蛋白,经10% SDS-PAGE分离后转印至PVDF膜,用5%脱脂牛奶封闭1小时(室温),加入抗IκBα、抗p-p65(Ser536)及β-actin一抗(4℃过夜)。加入HRP偶联二抗(室温1小时),ECL化学发光检测信号[1] |
| 动物实验 |
SCID mice injected with RPMI 8226 cells[1]
7.8 mg/kg, 10 mg/kg, 13 mg/kg Oral administration; twice a week; for 4 weeks Nude mouse RPMI 8226 xenograft protocol: 1. Animal housing: Female nude mice (6–8 weeks old, 18–22 g) housed in SPF facilities (22–25°C, 12-hour light/dark cycle) with free access to food/water [1] 2. Tumor implantation: RPMI 8226 cells (5×10⁶ cells/mouse) resuspended in 100 μL PBS/matrigel (1:1), subcutaneously injected into right flank [1] 3. Grouping and treatment: Tumors reaching ~100 mm³ (day 0) randomized into 4 groups. DELANZOMIB dissolved in solvent (5% DMSO + 10% Cremophor EL + 85% normal saline) and administered via oral gavage (10 μL/g body weight) at 10 mg/kg or 30 mg/kg, once daily. Bortezomib (0.5 mg/kg) administered via intravenous injection twice weekly. Control received solvent alone. Treatment lasted 21 days [1] 4. Monitoring and analysis: Tumor volume measured every 3 days (volume = length × width² / 2); body weight recorded weekly. Mice euthanized via CO₂ inhalation; tumors excised, weighed, and lysed for Western blot (anti-cleaved caspase-3). Serum collected for TNF-α/IL-6 ELISA [1] - Nude mouse Granta-519 xenograft protocol: 1. Tumor implantation: Granta-519 cells (2×10⁶ cells/mouse) resuspended in 100 μL PBS/matrigel (1:1), subcutaneously injected [1] 2. Treatment: DELANZOMIB 30 mg/kg (oral gavage, once daily, 21 days) when tumors reached ~100 mm³ [1] 3. Analysis: Tumor volume measured every 4 days; tumors excised for TUNEL staining to assess apoptosis [1] |
| 药代性质 (ADME/PK) |
Oral pharmacokinetics in mice:
1. Oral bioavailability: ~45% (mouse, 30 mg/kg oral dose vs. intravenous dose) [1] 2. PK parameters (30 mg/kg oral, mouse): - Cmax (peak plasma concentration): ~120 ng/mL (Tmax = 1.5 hours); - AUC₀-24h (area under the curve): ~850 ng·h/mL; - Terminal half-life (t₁/₂): ~6.5 hours; - Clearance (CL): ~18 mL/min/kg [1] 3. Tissue distribution: At 2 hours post-oral dose (30 mg/kg), DELANZOMIB concentration in RPMI 8226 tumors was ~380 ng/g, with tumor/plasma ratio ~3.2 [1] 4. Metabolism: Primarily metabolized in the liver via CYP3A4; no major active metabolites detected [1] 5. Excretion: ~65% of administered dose excreted in feces (unchanged drug: ~30%) within 72 hours; ~15% excreted in urine (primarily metabolites) [1] |
| 毒性/毒理 (Toxicokinetics/TK) |
In vitro toxicity:
1. Normal human cells: 100 nM DELANZOMIB (72-hour treatment) reduced PBMC viability by <12% and HUVEC viability by <15%, vs. ~60% reduction in RPMI 8226 cells at the same concentration [1] - In vivo toxicity: 1. Subacute toxicity (mouse, 30 mg/kg oral, daily, 21 days): - No significant weight loss (<5% vs. baseline) or mortality; - Serum biochemical parameters (ALT, AST, creatinine, BUN) within normal ranges; - No histopathological lesions in liver, kidney, spleen, or heart (H&E staining) [1] 2. Acute toxicity: Single oral dose of 100 mg/kg caused no mortality; transient mild diarrhea in 2/6 mice, resolved within 24 hours [1] - Plasma protein binding: ~92% (human plasma, equilibrium dialysis at 37°C) [1] |
| 参考文献 | |
| 其他信息 |
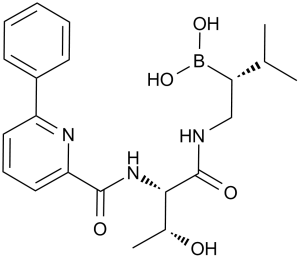
Delanzomib is a C-terminal boronic acid peptide inhibitor which induces apoptosis in multiple myeloma, hematological and solid tumor cell lines. It has a role as a proteasome inhibitor, an apoptosis inducer and an antineoplastic agent. It is a threonine derivative, a phenylpyridine, a C-terminal boronic acid peptide and a secondary alcohol. It is functionally related to a L-threonine.
Delanzomib has been used in trials studying the treatment of Solid Tumors, Multiple Myeloma, and Lymphoma, Non-Hodgkin. Delanzomib is an orally bioavailable synthetic P2 threonine boronic acid inhibitor of the chymotrypsin-like activity of the proteasome, with potential antineoplastic activity. Delanzomib represses the proteasomal degradation of a variety of proteins, including inhibitory kappaBalpha (IkappaBalpha), resulting in the cytoplasmic sequestration of the transcription factor NF-kappaB; inhibition of NF-kappaB nuclear translocation and transcriptional up-regulation of a variety of cell growth-promoting factors; and apoptotic cell death in susceptible tumor cell populations. In vitro studies indicate that this agent exhibits a favorable cytotoxicity profile toward normal human epithelial cells, bone marrow progenitors, and bone marrow-derived stromal cells relative to the proteasome inhibitor bortezomib. The intracellular protein IkappaBalpha functions as a primary inhibitor of the proinflammatory transcription factor NF-kappaB. Mechanism of action: DELANZOMIB (CEP18770) is an orally active, tumor-selective 26S proteasome inhibitor that selectively binds to the β5 subunit, inhibiting chymotrypsin-like activity. This blocks degradation of ubiquitinated proteins (e.g., IκBα, pro-apoptotic proteins), leading to NF-κB inhibition and cancer cell apoptosis [1] - Clinical advantage: Distinguished from bortezomib by oral bioavailability (~45%) and tumor selectivity (lower toxicity to normal cells), addressing limitations of bortezomib (intravenous administration, off-target toxicity) [1] - Preclinical efficacy focus: Effective against bortezomib-sensitive and -resistant MM cells, and MCL cells, supporting potential for relapsed/refractory hematologic malignancies [1] |
| 分子式 |
C21H28BN3O5
|
|
|---|---|---|
| 分子量 |
413.28
|
|
| 精确质量 |
413.212
|
|
| 元素分析 |
C, 61.03; H, 6.83; B, 2.62; N, 10.17; O, 19.36
|
|
| CAS号 |
847499-27-8
|
|
| 相关CAS号 |
|
|
| PubChem CID |
24800541
|
|
| 外观&性状 |
Off-white to yellow solid powder
|
|
| 密度 |
1.207
|
|
| 折射率 |
1.563
|
|
| LogP |
2.89
|
|
| tPSA |
138.76
|
|
| 氢键供体(HBD)数目 |
5
|
|
| 氢键受体(HBA)数目 |
6
|
|
| 可旋转键数目(RBC) |
9
|
|
| 重原子数目 |
30
|
|
| 分子复杂度/Complexity |
557
|
|
| 定义原子立体中心数目 |
3
|
|
| SMILES |
C(C1C=CC=C(C2C=CC=CC=2)N=1)(=O)N[C@@H]([C@H](O)C)C(=O)N[C@H](B(O)O)CC(C)C
|
|
| InChi Key |
SJFBTAPEPRWNKH-CCKFTAQKSA-N
|
|
| InChi Code |
InChI=1S/C21H28BN3O5/c1-13(2)12-18(22(29)30)24-21(28)19(14(3)26)25-20(27)17-11-7-10-16(23-17)15-8-5-4-6-9-15/h4-11,13-14,18-19,26,29-30H,12H2,1-3H3,(H,24,28)(H,25,27)/t14-,18+,19+/m1/s1
|
|
| 化学名 |
[(1R)-1-[[(2S,3R)-3-hydroxy-2-[(6-phenylpyridine-2-carbonyl)amino]butanoyl]amino]-3-methylbutyl]boronic acid
|
|
| 别名 |
|
|
| HS Tariff Code |
2934.99.9001
|
|
| 存储方式 |
Powder -20°C 3 years 4°C 2 years In solvent -80°C 6 months -20°C 1 month |
|
| 运输条件 |
Room temperature (This product is stable at ambient temperature for a few days during ordinary shipping and time spent in Customs)
|
| 溶解度 (体外实验) |
|
|||
|---|---|---|---|---|
| 溶解度 (体内实验) |
配方 1 中的溶解度: ≥ 2.17 mg/mL (5.25 mM) (饱和度未知) in 10% DMSO + 40% PEG300 + 5% Tween80 + 45% Saline (这些助溶剂从左到右依次添加,逐一添加), 澄清溶液。
例如,若需制备1 mL的工作液,可将100 μL 21.7 mg/mL澄清DMSO储备液加入400 μL PEG300中,混匀;然后向上述溶液中加入50 μL Tween-80,混匀;加入450 μL生理盐水定容至1 mL。 *生理盐水的制备:将 0.9 g 氯化钠溶解在 100 mL ddH₂O中,得到澄清溶液。 配方 2 中的溶解度: 2.17 mg/mL (5.25 mM) in 10% DMSO + 90% (20% SBE-β-CD in Saline) (这些助溶剂从左到右依次添加,逐一添加), 悬浊液; 超声助溶。 例如,若需制备1 mL的工作液,可将 100 μL 21.7 mg/mL澄清DMSO储备液加入900 μL 20% SBE-β-CD生理盐水溶液中,混匀。 *20% SBE-β-CD 生理盐水溶液的制备(4°C,1 周):将 2 g SBE-β-CD 溶解于 10 mL 生理盐水中,得到澄清溶液。 View More
配方 3 中的溶解度: ≥ 2.17 mg/mL (5.25 mM) (饱和度未知) in 10% DMSO + 90% Corn Oil (这些助溶剂从左到右依次添加,逐一添加), 澄清溶液。 1、请先配制澄清的储备液(如:用DMSO配置50 或 100 mg/mL母液(储备液)); 2、取适量母液,按从左到右的顺序依次添加助溶剂,澄清后再加入下一助溶剂。以 下列配方为例说明 (注意此配方只用于说明,并不一定代表此产品 的实际溶解配方): 10% DMSO → 40% PEG300 → 5% Tween-80 → 45% ddH2O (或 saline); 假设最终工作液的体积为 1 mL, 浓度为5 mg/mL: 取 100 μL 50 mg/mL 的澄清 DMSO 储备液加到 400 μL PEG300 中,混合均匀/澄清;向上述体系中加入50 μL Tween-80,混合均匀/澄清;然后继续加入450 μL ddH2O (或 saline)定容至 1 mL; 3、溶剂前显示的百分比是指该溶剂在最终溶液/工作液中的体积所占比例; 4、 如产品在配制过程中出现沉淀/析出,可通过加热(≤50℃)或超声的方式助溶; 5、为保证最佳实验结果,工作液请现配现用! 6、如不确定怎么将母液配置成体内动物实验的工作液,请查看说明书或联系我们; 7、 以上所有助溶剂都可在 Invivochem.cn网站购买。 |
| 制备储备液 | 1 mg | 5 mg | 10 mg | |
| 1 mM | 2.4197 mL | 12.0983 mL | 24.1967 mL | |
| 5 mM | 0.4839 mL | 2.4197 mL | 4.8393 mL | |
| 10 mM | 0.2420 mL | 1.2098 mL | 2.4197 mL |
1、根据实验需要选择合适的溶剂配制储备液 (母液):对于大多数产品,InvivoChem推荐用DMSO配置母液 (比如:5、10、20mM或者10、20、50 mg/mL浓度),个别水溶性高的产品可直接溶于水。产品在DMSO 、水或其他溶剂中的具体溶解度详见上”溶解度 (体外)”部分;
2、如果您找不到您想要的溶解度信息,或者很难将产品溶解在溶液中,请联系我们;
3、建议使用下列计算器进行相关计算(摩尔浓度计算器、稀释计算器、分子量计算器、重组计算器等);
4、母液配好之后,将其分装到常规用量,并储存在-20°C或-80°C,尽量减少反复冻融循环。
计算结果:
工作液浓度: mg/mL;
DMSO母液配制方法: mg 药物溶于 μL DMSO溶液(母液浓度 mg/mL)。如该浓度超过该批次药物DMSO溶解度,请首先与我们联系。
体内配方配制方法:取 μL DMSO母液,加入 μL PEG300,混匀澄清后加入μL Tween 80,混匀澄清后加入 μL ddH2O,混匀澄清。
(1) 请确保溶液澄清之后,再加入下一种溶剂 (助溶剂) 。可利用涡旋、超声或水浴加热等方法助溶;
(2) 一定要按顺序加入溶剂 (助溶剂) 。
| NCT Number | Recruitment | interventions | Conditions | Sponsor/Collaborators | Start Date | Phases |
| NCT01348919 | Completed | Drug: CEP-18770 Drug: Lenalidomide |
Multiple Myeloma | Teva Branded Pharmaceutical Products R&D, Inc. |
August 3, 2011 | Phase 1 Phase 2 |
| NCT01023880 | Terminated | Drug: CEP-18770 | Multiple Myeloma | Cephalon | January 2010 | Phase 1 Phase 2 |
| NCT00572637 | Completed | Drug: CEP-18770 | Solid Tumors Lymphoma, Non-Hodgkin |
Ethical Oncology Science | November 2007 | Phase 1 |
 |
|---|
 |
 |
 |
|---|
 |
 |