| 规格 | 价格 | 库存 | 数量 |
|---|---|---|---|
| 10 mM * 1 mL in DMSO |
|
||
| 1mg |
|
||
| 5mg |
|
||
| 10mg |
|
||
| 25mg |
|
||
| 50mg |
|
||
| 100mg |
|
||
| 250mg |
|
||
| 500mg |
|
||
| 1g |
|
||
| Other Sizes |
|
| 靶点 |
PPARγ: (IC50 = 3.3 nM)
PPARα: (IC50 = 32 nM) PPARδ: (IC50 = 2000 nM) The only reported target of GW9662 is peroxisome proliferator-activated receptor gamma (PPARγ), a selective and irreversible antagonist, with the following key parameters: - Human PPARγ: Dissociation constant (Ki) = 1.8 nM (measured by radioligand competition binding assay) [1] - Murine PPARγ: Inhibition of PPARγ-mediated transcriptional activity, half-maximal inhibitory concentration (IC50) = 3.0 nM (luciferase reporter gene assay in CV-1 cells) [1] ; |
|---|---|
| 体外研究 (In Vitro) |
GW9662能够抑制放射性配体与PPARγ、PPARα和PPARδ的结合,相应的pIC50值为8.48±0.27(IC50=3.3nM;n=10)、7.49±0.17(IC50=32nM;n=9),和5.69±0.17(IC50=2000nM;n=3)。与 PPARα 和 PPARδ 的结合研究表明,GW9662对 PPARγ 的作用分别低 10 倍和 600 倍,IC50 为纳摩尔级。 GW9662 在基于细胞的报告基因检测中有效且选择性地阻断全长 PPARγ[1]。当单独与 50 μM BRL 49653 (P=0.001) 或 10 μM GW9662 (P=0.01) 配对时,与 50 μM BRL 49653 和 10 μM GW9662 共同处理 7 天后,活细胞数量显着减少[2 ]。
在高通量筛选过氧化物酶体增殖物激活受体γ(PPARgamma)配体的过程中,我们使用针对人配体结合结构域的竞争结合分析鉴定了GW9662。GW9662与PPARgamma相比具有纳摩尔IC(50),在使用PPARalpha和PPARdelta的结合实验中,其效力分别低10倍和600倍。通过闪烁邻近试验评估,用GW9662预处理所有三种PPAR导致配体结合的不可逆损失。PPAR与GW9662孵育导致受体的吸收光谱发生变化,与共价修饰一致。用GW9662处理的PPARγ配体结合结构域的质谱分析确定Cys(285)是共价修饰的位点。这种半胱氨酸在所有三种PPAR中都是保守的。在基于细胞的报告检测中,GW9662是全长PPARγ的强效选择性拮抗剂。GW9662作为PPARγ拮抗剂的功能活性在脂肪细胞分化试验中得到证实GW9662在使用全长PPARdelta和PPARalpha进行测试时,对转录基本没有影响。配体调节受体异二聚化、共激活子结合和共升压子结合的时间分辨荧光分析与报告基因分析中观察到的效果一致。对照激活剂增加了PPAR:RXR异二聚体的形成和与PPARgamma和PPARdelta的共激活剂结合。核心加压素结合减少。在PPARalpha的情况下,GW9662处理没有显著增加异二聚体和共激活子结合,也没有降低共加压子结合。实验数据表明,GW9662对三种PPAR中的每一种的修改都会导致不同的功能后果。GW9662治疗的选择性和不可逆性,以及在细胞培养实验中保持活性的观察表明,该化合物可能是阐明PPARγ在生物过程中作用的有用工具。[1] 这项研究表明,强效、不可逆和选择性的PPARγ拮抗剂GW9662能够阻止PPARγ的激活,并抑制人乳腺肿瘤细胞系的生长。有争议的是,GW9662阻止了罗格列酮介导的PPARγ激活,但增强而不是逆转了罗格列列酮诱导的生长抑制。因此,这些数据支持PPARγ非依赖性途径的存在,并质疑PPARγ配体通过激活PPARγ介导其抗癌作用的核心观点[2]。 1. PPARγ活性抑制及不可逆结合机制: - 在重组人PPARγ配体结合域(LBD)实验中,GW9662与[³H]-罗格列酮(PPARγ激动剂)竞争结合PPARγ,Ki=1.8 nM。将10 nM GW9662与PPARγ孵育2小时后,通过透析去除未结合药物,PPARγ与[³H]-罗格列酮的结合能力未恢复,证实其不可逆结合特性[1] - 在共转染小鼠PPARγ与PPARγ响应荧光素酶报告质粒的CV-1细胞中,GW9662(0.1-100 nM)剂量依赖性抑制罗格列酮(100 nM)诱导的荧光素酶活性,IC50=3.0 nM。清洗细胞去除未结合药物后,抑制作用仍持续存在,确认其对PPARγ转录活性的不可逆抑制[1] 2. 乳腺癌细胞抗增殖及与PPARγ激动剂的协同作用: - 在人乳腺癌细胞MCF-7和T47D中,GW9662(0.1-100 μM)以剂量依赖性抑制细胞增殖(MTT法)。处理48小时后,MCF-7和T47D细胞的IC50分别为5.2 μM和4.8 μM。值得注意的是,该抗增殖作用不依赖PPARγ激活——通过siRNA敲低PPARγ后,GW9662的抑制作用未减弱[2] - MCF-7细胞中,GW9662(1 μM)与BRL49653(1 μM,PPARγ激动剂)联用可增强抗增殖效果:增殖抑制率从BRL49653单独处理组的31.2%、GW9662单独处理组的28.7%,提升至联用组的62.5%[2] 3. 免疫介导骨髓衰竭模型中T细胞功能抑制: - 从C57BL/6小鼠脾脏分离原代T细胞,经抗CD3/抗CD28抗体激活后,GW9662(1-10 μM)剂量依赖性抑制T细胞增殖(CCK-8法)。10 μM时,增殖率较激活对照组降低51.3%;同时,10 μM GW9662可减少促炎细胞因子分泌:IFN-γ降低42.5%,TNF-α降低38.7%(ELISA检测)[3] 4. 逆转LPS对肾近端小管上皮细胞的保护作用: - 在原代小鼠近端肾小管上皮细胞(mPTCs)中,LPS(100 ng/mL)预处理2小时可将缺氧复氧组的细胞活力(MTT法)从52.1%提升至80.3%。联合使用GW9662(1-10 μM)可剂量依赖性逆转该保护作用:10 μM时细胞活力降至50.2%,与缺氧复氧组相当。Western blot显示,10 μM GW9662可减少LPS诱导的Bcl-2上调(45.3%)和Bax下调(39.6%)[4] 。 |
| 体内研究 (In Vivo) |
BADGE 和 GW9662(1 mg/kg,ip)治疗的小鼠的骨髓(BM)有核细胞计数均显着高于再生障碍性贫血(AA)组[3]。在大鼠中,GW9662(1 mg/kg,腹腔注射)显着降低脂多糖 (LPS) 的肾脏保护作用[4]。
研究人员用PPARγ拮抗剂BADGE或GW9662或对照载体治疗受体小鼠。在第14天,处死小鼠,在PB中通过细胞计数进行评估,在BM中通过估计细胞数和骨髓脂肪细胞的形态学检查进行评估。 共聚焦显微镜显示AA小鼠骨髓中脂肪细胞大量扩增。通过4′,6-二脒基-2-苯基吲哚(DAPI)染色(核,蓝色)的密度估计的总体BM细胞数非常低。相比之下,用PPARγ拮抗剂治疗的小鼠骨髓中的脂肪细胞(绿色,硼二吡咯甲烷染料-BODIPY)要少得多,骨髓细胞数要高得多(图1A,左)。通过常规染色,AA小鼠的BM结构显示出广泛的破坏和脂肪细胞的替代,脂肪细胞占据了“空白”空间,而BADGE或GW9662处理的小鼠的BM显示出更少的空白空间和更多的造血细胞(图1A,右)。与AA小鼠相比,BADGE治疗的小鼠的血液白细胞和血小板计数更高(图1B)。BADGE和GW9662治疗的小鼠的BM有核细胞计数明显高于AA组。使用流式细胞术,我们发现BADGE治疗的小鼠骨髓中Lin−细胞的频率和Lin−Sca1+c-kit+(LSK)干细胞的绝对数量高于对照组[3] 在我们的AA小鼠模型中,T细胞免疫是BM破坏的原因。为了确定PPARγ拮抗剂治疗是否改变了AA小鼠的免疫状态,我们在多重测定中测量了血浆细胞因子水平。胰岛素是一种与脂肪生成相关的激素,AA小鼠的胰岛素水平高于TBI对照组;BADGE或GW9662治疗将胰岛素水平纠正到正常水平。与TBI对照组小鼠相比,AA小鼠表现出更高水平的炎性细胞因子单核细胞趋化蛋白-1(MCP-1)和Th1细胞因子,如IFNγ、IFNγ诱导蛋白10(IP-10)和TNFα。与AA小鼠的水平相比,BADGE或GW9662-治疗降低了血浆MCP-1的水平;BADGE降低了IFNγ和IP-10水平,GW9662治疗也降低了TNFα水平。BADGE或GW9662治疗往往会降低IL-6水平[3]。 GW9662对LPS预处理大鼠I/R引起的肾/肾小球功能障碍的影响[4] 与假手术大鼠相比,接受肾I/R的大鼠血清肌酐水平显著升高。图1a表明存在严重程度的肾功能障碍。与仅接受I/R的大鼠(对照组)相比,在肾脏I/R前24小时用LPS(1mg/kg,IP)预处理大鼠显著减轻了血清肌酸水平的升高,见图1a。LPS预处理后获得的血清肌酐衰减可通过给予特异性PPARγ拮抗剂GW9662(1 mg/kg,IP)逆转,见图1a。 为了排除I/R期间肌肉肌酸酐释放增加导致血清肌酸酐水平迅速升高的可能性,还测量了肌酸酐清除率见图1b。与假手术大鼠相比,接受肾I/R的大鼠肌酐清除率显著降低。图1b表明肾小球功能障碍严重。与仅接受I/R的大鼠相比,I/R前24小时给予LPS可适度但显著改善肌酐清除率。最值得注意的是,LPS预处理提供的肌酐清除率的这种保持被GW9662图1b所消除。 GW9662对LPS预处理大鼠I/R引起的肾小管功能障碍的影响[4] 肾I/R导致FENa显著增加,表明肾小管功能障碍图2。用LPS预处理大鼠后,I/R介导的FENa增加显著减弱,表明肾小管功能有所改善。图2。在LPS处理的大鼠中给予GW9662后,FENa增加,与对照组大鼠(仅I/R)的测量结果相似,从而消除了LPS介导的保护作用。 与假手术大鼠相比,肾脏I/R导致尿流量无显著减少。图3。然而,与仅接受肾脏I/R的大鼠相比,接受LPS的肾脏I/R大鼠产生的尿液量明显更大。对LPS预处理的大鼠施用GW9662消除了尿流的这种增加。图3。 GW9662对LPS预处理大鼠I/R再灌注损伤的影响[4] 与假手术大鼠的水平相比,肾脏I/R使AST图4a和γ-GT图4b的血清浓度显著增加。作为再灌注损伤标志物的AST和γ-GT的血清浓度在给予LPS后显著降低(图4a和B)。有趣的是,GW9662消除了LPS预处理提供的保护作用(图4a和b)。 1. 减轻小鼠免疫介导的骨髓衰竭: - 雄性C57BL/6小鼠(8-10周龄)通过尾静脉注射同种异体T细胞(1×10⁷个/只)诱导骨髓衰竭,随机分为4组(每组6只):正常对照、骨髓衰竭(BMF)模型、GW9662低剂量(1 mg/kg/天)、GW9662高剂量(5 mg/kg/天)[3] - GW9662溶于DMSO(终浓度≤0.1%)并加生理盐水稀释,腹腔注射给药,每日1次,连续14天;BMF模型组给予等量溶媒[3] - 治疗结束时: - 骨髓有核细胞数:从BMF模型组的2.1×10⁶个/mL升至1 mg/kg组3.8×10⁶个/mL、5 mg/kg组5.3×10⁶个/mL[3] - 骨髓T细胞浸润:CD3⁺T细胞百分比(流式细胞术)从BMF模型组的28.5%降至1 mg/kg组19.2%、5 mg/kg组12.8%[3] - 血液学指标:外周血白细胞计数从BMF模型组的1.8×10⁹/L升至1 mg/kg组3.2×10⁹/L、5 mg/kg组4.5×10⁹/L;血红蛋白浓度从85 g/L升至1 mg/kg组105 g/L、5 mg/kg组125 g/L[3] 2. 逆转LPS对小鼠肾缺血再灌注(IR)损伤的保护作用: - 雄性C57BL/6小鼠(8-10周龄)随机分为3组(每组6只):假手术、肾IR模型、IR+GW9662(3 mg/kg)[4] - 肾IR模型通过夹闭双侧肾动脉30分钟后再灌注建立;GW9662溶于0.5%羧甲基纤维素(CMC),缺血前1小时腹腔注射给药;IR模型组给予0.5% CMC[4] - 再灌注24小时后: - 肾功能:血清肌酐从IR模型组的302.5 μmol/L降至IR+GW9662组181.3 μmol/L;血尿素氮(BUN)从45.8 mmol/L降至28.6 mmol/L[4] - 肾组织病理学:HE染色显示肾小管坏死百分比从IR模型组的42.3%降至IR+GW9662组17.5%;肾损伤评分(基于肾小管扩张、管型形成及坏死)从3.8降至1.9[4] 。 |
| 酶活实验 |
Binding Assay。[1]
所有三种PPAR的SPAs均按照先前对PPARγ的描述进行。简言之,人PPARα、PPARγ和PPARδ配体结合结构域(LBD)在大肠杆菌中作为多组氨酸标记的融合蛋白表达。通过将所需受体(15nM)加入到测定缓冲液中的链霉亲和素修饰的SPA珠(0.5mg/mL)的浆液中,将受体固定在SPA珠(Amersham Pharmacia)上。使混合物在室温下平衡至少1小时,并通过以1000g离心使珠粒化。弃去上清液,将珠粒轻轻混合再悬浮在原始体积的新鲜测定缓冲液中。重复离心/再悬浮程序,立即使用得到的受体包被珠的浆液,或在使用前在4°C下储存长达1周。[3H]GW2331、[3H]罗格列酮和[3H]GW 2443分别用作测定与PPARα、PPARγ和PPARδ竞争结合的放射性配体。除非另有说明,用于所有测定的缓冲液为50mM HEPES(pH 7)、50mM NaCl、5mM CHAPS、0.1mg/mL BSA和10mM DTT。对于一些实验,用50mM Tris(pH 8)代替HEPES(pH 7)。 用于质谱分析的GW9662改性PPARγ的制备。[1] 将GW9662在二甲基亚砜中的储备溶液添加到PPARγ在50mM Tris(pH 8)、50mM NaCl、5mM CHAPS、0.1mg/mL BSA和10mM DTT中的20μM溶液中。GW9662的最终浓度为40μM。将溶液在4°C下孵育,然后进行如下所述的质谱分析。 1. PPARγ放射配体竞争结合实验: - 将重组人PPARγ LBD(1 μg/mL)与[³H]-罗格列酮(0.5 nM,PPARγ激动剂)及不同浓度GW9662(0.1-100 nM)在结合缓冲液(20 mM Tris-HCl,pH7.5,1 mM EDTA,10%甘油,1 mM DTT)中混合,4°C孵育16小时达到结合平衡[1] - 通过Sephadex G-25凝胶过滤柱分离游离[³H]-罗格列酮与PPARγ-LBD-[³H]-罗格列酮复合物,液体闪烁计数器检测复合物的放射性[1] - 采用Cheng-Prusoff方程计算GW9662对PPARγ的解离常数(Ki),结果为1.8 nM,证实其高亲和力结合[1] 2. PPARγ转录活性抑制实验(荧光素酶报告基因实验): - CV-1细胞以5×10⁴个/孔接种于24孔板,用含10% FBS的DMEM培养24小时;通过转染试剂共转染三种质粒:小鼠PPARγ表达质粒(pCMV-mPPARγ)、PPARγ响应荧光素酶报告质粒(pPPRE-luc,含3个PPAR响应元件)及海肾荧光素酶质粒(pRL-TK,内参)[1] - 转染24小时后,更换为含GW9662(0.1-100 nM)及固定浓度罗格列酮(100 nM,用于激活PPARγ)的新鲜培养基;溶媒组给予DMSO(终浓度≤0.1%)[1] - 继续孵育24小时后,用被动裂解液裂解细胞,双荧光素酶报告基因检测系统测定荧光素酶活性;计算相对荧光素酶活性(萤火虫荧光素酶活性/海肾荧光素酶活性)以评估GW9662对PPARγ转录活性的抑制作用,测得IC50=3.0 nM[1] 。 |
| 细胞实验 |
基于细胞的报告分析。[1]
GW9662激活PPAR介导的报告基因转录的能力是使用人类受体的GAL4嵌合体和先前描述的PPARγ、PPARα和PPARδ的(UAS)5-tk-SPAP报告质粒来评估的。如前所述测量GW9662对配体诱导的基因转录的拮抗作用。通过在恒定浓度的活化配体存在下滴定不同浓度的GW9662来拮抗激动剂诱导的报告基因转录。所用的活化配体分别为100 nM罗格列酮用于PPARγ、8 nM GW7647用于PPARα和0.55μM GW2433用于PPARδ。 GW9662对PPARγ、PPARα和PPARδ激活的影响也使用全长人类受体和报告基因构建体(L-FABP)4-tk-Dual-LUC进行了评估,该构建体包含最小疱疹病毒胸苷激酶启动子上游的四个拷贝的L-FABP PPRE和荧光素酶报告基因。受体质粒包含合适的全长PPAR cDNA加上克隆到pcDNA3.1-TOPO的TOPO位点的9个碱基对的Kozak共有序列。简言之,HEK293细胞在37°C的加湿培养箱(空气中5%CO2)中,在含有10%胎牛血清、1%青霉素/链霉素和1%菌唑的最低必需培养基中培养。在测定执行前一天,将细胞以每孔2×104个细胞的速度接种在96孔培养板中。根据制造商的说明,使用PolyFect完成转染。每个孔的转染混合物含有0.167μg PPAR质粒、0.167μgLFABP报告子和0.167μg/renilla萤光素酶质粒作为转染对照。在用化合物或载体处理48小时之前,将细胞与转染混合物孵育5小时。根据制造商的说明,使用双荧光素酶测定系统测定培养板。 MTT细胞存活研究[2] 使用罗格列酮和GW9662。将细胞(MCF7、MDA-MB-231、MDA-MB-468)以每孔1×103个细胞的密度铺在RPMI培养基中的96孔板上。孵育过夜以允许细胞附着后,取出培养基,用单独含有不同浓度罗格列酮(1-100μM)、GW9662(100 nM-50μM)或溶剂(二甲基亚砜(DMSO))的新鲜培养基替换。MDA-MB-231细胞也同时接受罗格列酮(10,50μM)和GW9662(1,10μM)的组合。在所有情况下,DMSO的最终浓度均不超过0.1%,并且在该浓度下测试的任何细胞系中均未发现具有细胞毒性。在连续暴露72小时后,使用标准3-[4,5-二甲基噻唑基]-2,5-二苯基溴化四唑(MTT)测定法评估化学敏感性。 细胞生长试验[2] MDA-MB-231细胞以每25cm3组织培养瓶1×105个细胞的密度接种。24小时后(第0天),用含有罗格列酮(50μM)、GW966210μM)或两者的新鲜培养基替换生长培养基。对照烧瓶接受0.1%DMSO。对于每种处理条件,在第0、3、5、7、10天通过胰蛋白酶法收获细胞,用台盼蓝染色,并使用血细胞计数器计算每个烧瓶的细胞总数和活细胞数。 用于测量PPARγ和PPARα活性的处理细胞核提取物的制备[2] 如下所述,使用PPAR转录因子试剂盒在MDA-MB-231和MCF7细胞的核部分测量罗格列酮(50μM)、GW9662(10μM)或联合治疗后PPARγ和α活性的水平。细胞以每75 cm3组织培养瓶1×106个细胞的密度接种。24小时后,取出培养基,用含有适当处理的新鲜培养基替换。在处理2、4、8、24小时后,根据制造商的说明,使用转因子提取试剂盒分离核提取物(每种处理条件五瓶)。 1. 乳腺癌细胞增殖实验(MTT法): - 人乳腺癌细胞MCF-7和T47D以5×10³个/孔接种于96孔板,用含10% FBS的RPMI 1640培养基培养24小时[2] - 更换为含不同浓度GW9662(0.1、1、10、100 μM)或溶媒(DMSO,终浓度≤0.1%)的新鲜培养基,每个浓度设3个复孔[2] - 37°C、5% CO₂孵育48小时后,每孔加入20 μL MTT试剂(5 mg/mL),继续孵育4小时;小心吸弃上清,加入150 μL DMSO溶解甲臜结晶[2] - 酶标仪测定570 nm处吸光度,细胞活力按(药物组OD值/对照组OD值)×100%计算,非线性回归拟合IC50[2] 2. 原代T细胞增殖及细胞因子分泌实验: - 分离C57BL/6小鼠脾脏,研磨过滤制备单细胞悬液,采用小鼠T细胞分离试剂盒(阴性选择法)纯化T细胞[3] - 纯化T细胞以2×10⁴个/孔接种于96孔板,用抗CD3(2 μg/mL)和抗CD28(1 μg/mL)抗体激活,同时加入GW9662(1、5、10 μM)或溶媒[3] - 孵育72小时后,每孔加入10 μL CCK-8试剂,测定450 nm处吸光度评估T细胞增殖;收集培养上清,ELISA检测IFN-γ和TNF-α浓度[3] 3. 肾近端小管上皮细胞(mPTC)活力实验: - 胶原酶消化法从C57BL/6小鼠肾脏分离原代mPTCs,用含10% FBS的DMEM/F12培养基培养[4] - 细胞以1×10⁵个/孔接种于24孔板,培养至融合后更换为无血清培养基,置于缺氧环境(1% O₂、5% CO₂、94% N₂)2小时,随后复氧(21% O₂、5% CO₂)建立缺氧复氧模型[4] - LPS预处理组在缺氧前用100 ng/mL LPS孵育2小时;复氧开始时加入GW9662(1、5、10 μM);复氧24小时后,每孔加入500 μL MTT试剂(0.5 mg/mL),孵育4小时,测定570 nm处吸光度计算细胞活力[4] 。 |
| 动物实验 |
Dissolved in 10% (v/v) DMSO; 1 mg/kg; i.p. injection
Male Wistar rats Treatment of mice[3] PPARγ antagonists, BADGE or GW9662, were dissolved in dimethyl sulfoxide (DMSO) and stored at −20°C. The aliquots were diluted with PBS to a final concentration of 10% DMSO and administrated by daily intraperitoneal injection at 30 mg/kg for BADGE, or at 1 mg/kg for GW9662, from one day prior to the experiment and continued for up to 2 weeks. In the FVB AA model, some mice were injected with cyclosporine A (CsA, 50 mg/kg/day) starting 1 hour after the LN injection, and continued for 5 days as immunosuppression. At the end of the experiments, the mice were euthanized by CO2 inhalation. Methods, including peripheral blood (PB) and BM cell counting, flow cytometry, RNA isolation and gene expression analysis by PCR array, protein extraction and immunoblotting, cytokine measurement, histology using confocal microscopy, calcium flux assay and cell culture are detailed in the Online Supplementary Methods. Experimental protocol[3] Sixty-two male Wistar rats weighing 215 to 315 g were used in this study. Anesthetized rats were subjected to bilateral renal ischemia for 60 minutes followed by reperfusion for 6 hours. Animals were randomly allocated into 6 groups as follows: (1) I/R group: control, rats were administered 10% (v/v) DMSO (vehicle for GW9662, 1 mL /kg, IP) 24 and 12 hours prior to renal I/R, and saline (vehicle for LPS, 1 mL /kg, IP) 24 hours prior to renal I/R (N = 12); (2) I/R LPS group: rats were administered 10% (v/v) DMSO (vehicle for GW9662, 1 mL /kg, IP) 24 and 12 hours prior to renal I/R, and LPS (1 mg/kg, IP) 24 hours prior to renal I/R (N = 11); (3) I/R GW9662 group: rats were administered GW9662 (1 mg/kg, IP) 24 and 12 hours prior to renal I/R, and saline (vehicle for LPS, 1 mL /kg, IP) 24 hours prior to renal I/R (N = 9); (4) I/R LPS+GW9662 group: rats were administered GW9662 (1 mg/kg, IP) 24 and 12 hours prior to renal I/R, and LPS (1 mg/kg, IP) 24 hours prior to renal I/R (N = 11); (5) Sham group: rats were subjected to the same surgical procedures as above, except for renal I/R. Rats were administered 10% (v/v) DMSO (vehicle for GW9662, 1 mL /kg, IP) and saline (vehicle for LPS, 1 mL /kg, IP) at times equivalent to those described above (N = 12); (6) Sham GW9662 group: rats were subjected to the same surgical procedures as above, except for renal I/R. Rats were administered GW9662 (1 mg/kg, IP) and saline (vehicle for LPS, 1 mL /kg, IP) at times equivalent to those described above (N = 7). The time and dose of LPS used were based on those previously shown by our group to provide protection against renal I/R injury in the rat. The time and dose of GW9662 used were chosen according to those previously shown to exert antagonism of PPARγ. 1. Mouse model of immune-mediated bone marrow failure: - Animals: Male C57BL/6 mice (8-10 weeks old, 20-22 g) were purchased and acclimated for 1 week under specific pathogen-free (SPF) conditions (22±2°C, 12-hour light/dark cycle, free access to food and water) [3] - Model establishment: Bone marrow failure was induced by intravenous injection of allogeneic T cells (isolated from BALB/c mouse spleens, 1×10⁷ cells/mouse) via the tail vein. The normal control group received an equal volume of normal saline [3] - Grouping and administration: Mice were randomly divided into 4 groups (n=6 per group): - Normal control: No treatment [3] - BMF model: Intraperitoneal injection of vehicle (DMSO + normal saline, DMSO ≤0.1%) once daily for 14 days [3] - GW9662 low dose: Intraperitoneal injection of 1 mg/kg/day GW9662 (dissolved in vehicle) once daily for 14 days [3] - GW9662 high dose: Intraperitoneal injection of 5 mg/kg/day GW9662 (dissolved in vehicle) once daily for 14 days [3] - Sample collection and detection: On day 15, mice were anesthetized with pentobarbital sodium (40 mg/kg, intraperitoneal injection). Bone marrow was aspirated from the femur to count nucleated cells; peripheral blood was collected via orbital vein to measure hematological parameters (white blood cell count, hemoglobin concentration); bone marrow sections were prepared for immunohistochemical staining to detect CD3⁺ T cell infiltration [3] 2. Mouse model of renal ischemia-reperfusion (IR) injury: - Animals: Male C57BL/6 mice (8-10 weeks old, 20-22 g) were maintained under SPF conditions [4] - Model establishment: Mice were anesthetized with isoflurane (inhalation). A midline abdominal incision was made, and bilateral renal arteries were clamped with microvascular clips for 30 minutes. The clips were removed to initiate reperfusion, and the abdomen was sutured. The sham operation group underwent the same surgical procedure without artery clamping [4] - Grouping and administration: Mice were randomly divided into 3 groups (n=6 per group): - Sham operation: No drug treatment [4] - Renal IR model: Intraperitoneal injection of 0.5% CMC (0.2 mL/10 g body weight) 1 hour before ischemia [4] - IR + GW9662: Intraperitoneal injection of 3 mg/kg GW9662 (dissolved in 0.5% CMC, 0.2 mL/10 g body weight) 1 hour before ischemia [4] - Sample collection and detection: At 24 hours after reperfusion, mice were anesthetized, and blood was collected via the abdominal aorta to measure serum creatinine and BUN. Kidneys were excised: one kidney was fixed in 4% formalin for HE staining and histopathological scoring; the other kidney was stored at -80°C for future molecular analysis [4] . |
| 毒性/毒理 (Toxicokinetics/TK) |
1. In vitro cytotoxicity on normal cells:
- In primary murine renal proximal tubular epithelial cells (mPTCs) and normal human breast epithelial cells (MCF-10A), GW9662 at concentrations up to 20 μM had no significant effect on cell viability (MTT assay: viability >85% compared to the vehicle control), indicating low cytotoxicity to normal cells [2,4] 2. In vivo toxicity in mice: - In the immune-mediated bone marrow failure model (1-5 mg/kg/day GW9662, intraperitoneal injection, 14 days): No mortality was observed. Body weight change was comparable to the normal control group (weight gain: 5.2%-6.8% vs. 7.1% in normal control). Serum alanine transaminase (ALT) and aspartate transaminase (AST) levels were within the normal range (ALT: 32-45 U/L, AST: 85-105 U/L), and no histopathological lesions were found in the liver and kidney [3] - In the renal IR model (3 mg/kg GW9662, single intraperitoneal injection): No abnormal behavior or mortality was observed within 24 hours. Serum ALT/AST and renal function parameters (creatinine/BUN) in the GW9662-treated group were significantly lower than those in the IR model group, with no evidence of additional organ toxicity [4] ; |
| 参考文献 |
|
| 其他信息 |
GW 9662 is a member of benzamides.
Peroxisome proliferator-activated receptor gamma (PPARgamma), a member of the nuclear receptor superfamily, is activated by several compounds, including the thiazolidinediones. In addition to being a therapeutic target for obesity, hypolipidaemia and diabetes, perturbation of PPARgamma signalling is now believed to be a strategy for treatment of several cancers, including breast. Although differential expression of PPARgamma is observed in tumours compared to normal tissues and PPARgamma agonists have been shown to inhibit tumour cell growth and survival, the interdependence of these observations is unclear. This study demonstrated that the potent, irreversible and selective PPARgamma antagonist GW9662 prevented activation of PPARgamma and inhibited growth of human mammary tumour cell lines. Controversially, GW9662 prevented rosiglitazone-mediated PPARgamma activation, but enhanced rather than reversed rosiglitazone-induced growth inhibition. As such, these data support the existence of PPARgamma-independent pathways and question the central belief that PPARgamma ligands mediate their anticancer effects via activation of PPARgamma.[2] Acquired aplastic anemia is an immune-mediated disease, in which T cells target hematopoietic cells; at presentation, the bone marrow is replaced by fat. It was reported that bone marrow adipocytes were negative regulators of hematopoietic microenvironment. To examine the role of adipocytes in bone marrow failure, we investigated peroxisomal proliferator-activated receptor gamma, a key transcription factor in adipogenesis, utilizing an antagonist of this factor called bisphenol-A-diglycidyl-ether. While bisphenol-A-diglycidyl-ether inhibited adipogenesis as expected, it also suppressed T cell infiltration of bone marrow, reduced plasma inflammatory cytokines, decreased expression of multiple inflammasome genes, and ameliorated marrow failure. In vitro, bisphenol-A-diglycidyl-ether suppressed activation and proliferation, and reduced phospholipase C gamma 1 and nuclear factor of activated T-cells 1 expression, as well as inhibiting calcium flux in T cells. The in vivo effect of bisphenol-A-diglycidyl-ether on T cells was confirmed in a second immune-mediated bone marrow failure model, using different strains and non-major histocompatibility antigen mismatched: bisphenol-A-diglycidyl-ether ameliorated marrow failure by inhibition of T cell infiltration of bone marrow. Our data indicate that peroxisomal proliferator-activated receptor gamma antagonists may attenuate murine immune-mediated bone marrow failure, at least in part, by suppression of T cell activation, which might hold implications in the application of peroxisomal proliferator-activated receptor gamma antagonists in immune-mediated pathophysiologies, both in the laboratory and in the clinic. Genetically \"fatless\" mice developed bone marrow failure with accumulation of marrow adipocytes in our model, even in the absence of body fat, suggesting different mechanisms of systematic and marrow adipogenesis and physiologic versus pathophysiologic fat accumulation.[3] Background: We have recently reported that pretreatment of rats with endotoxin (lipopolysaccharide, LPS) and selective agonists of the nuclear receptor peroxisome proliferator-activated receptor-gamma (PPARgamma) protect the kidney against ischemia/reperfusion (I/R) injury. Here we investigate the hypothesis that the renoprotective effects of LPS may be due to an enhanced formation of endogenous ligands of PPARgamma, rather than an up-regulation of PPARgamma expression. Methods: Rats were pretreated with LPS (1 mg/kg, IP, 24 hours prior to ischemia) in the absence (control) or presence of the selective PPARgamma antagonist GW9662 (1 mg/kg, IP, 24 and 12 hours prior to ischemia). Twenty-four hours after injection of LPS, rats were subjected to 60 minutes of bilateral renal ischemia, followed by 6 hours of reperfusion. Serum and urinary indicators of renal injury and dysfunction were measured, specifically serum creatinine, aspartate aminotransferase, and gamma-glutamyl-transferase, creatinine clearance, urine flow, and fractional excretion of sodium. Kidney PPARgamma1 mRNA levels were determined by reverse transcriptase-polymerase chain reaction. Results: Pretreatment with LPS significantly attenuated all markers of renal injury and dysfunction caused by I/R. Most notably, GW9662 abolished the protective effects of LPS. Additionally, I/R caused an up-regulation of kidney PPARgamma1 mRNA levels compared to sham animals, which were unchanged in rats pretreated with LPS. Conclusion: We document here for the first time that endogenous ligands of PPARgamma may contribute to the protection against renal I/R injury afforded by LPS pretreatment in the rat.[4] 1. Background and mechanism of action: - GW9662 is a synthetic, selective, and irreversible antagonist of PPARγ. Its mechanism of irreversible inhibition involves covalent binding to the cysteine residue (Cys285) in the ligand-binding domain of PPARγ, which sterically hinders the binding of PPARγ agonists and disrupts the formation of PPARγ-coactivator complexes, thereby suppressing PPARγ-mediated transcriptional activity [1] - In addition to PPARγ inhibition, GW9662 exhibits PPARγ-independent biological activities, such as inhibiting breast cancer cell proliferation and enhancing the anticancer effect of PPARγ agonists. The underlying mechanism may involve modulation of cell cycle regulatory proteins (e.g., p21, cyclin D1), but this has not been fully elucidated [2] 2. Research utility: - GW9662 is widely used as a research tool to study the physiological and pathological roles of PPARγ in various diseases, including metabolic disorders (diabetes, obesity), cancer (breast cancer), immune-mediated diseases (bone marrow failure), and organ ischemia-reperfusion injury (kidney) [1-4] - It is particularly valuable for distinguishing PPARγ-dependent and PPARγ-independent effects of test compounds, as its irreversible binding ensures sustained inhibition of PPARγ activity in cell and animal models [1] 3. Therapeutic potential: - Preclinical studies suggest that GW9662 has potential therapeutic value in immune-mediated bone marrow failure (by inhibiting T cell overactivation) and renal ischemia-reperfusion injury (by reversing LPS-mediated harmful protection) [3,4] - It may also serve as an adjuvant in breast cancer therapy, as it enhances the antiproliferative effect of PPARγ agonists [2] ; |
| 分子式 |
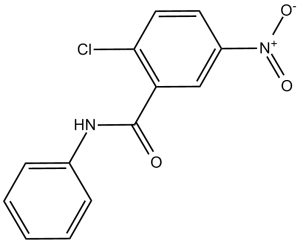
C13H9CLN2O3
|
|---|---|
| 分子量 |
276.67516207695
|
| 精确质量 |
276.03
|
| 元素分析 |
C, 56.43; H, 3.28; Cl, 12.81; N, 10.13; O, 17.35
|
| CAS号 |
22978-25-2
|
| 相关CAS号 |
GW9662-d5;2117730-84-2
|
| PubChem CID |
644213
|
| 外观&性状 |
White to off-white solid powder
|
| 密度 |
1.4±0.1 g/cm3
|
| 沸点 |
360.9±32.0 °C at 760 mmHg
|
| 熔点 |
171-175 °C(lit.)
|
| 闪点 |
172.0±25.1 °C
|
| 蒸汽压 |
0.0±0.8 mmHg at 25°C
|
| 折射率 |
1.676
|
| LogP |
2.76
|
| tPSA |
74.92
|
| 氢键供体(HBD)数目 |
1
|
| 氢键受体(HBA)数目 |
3
|
| 可旋转键数目(RBC) |
2
|
| 重原子数目 |
19
|
| 分子复杂度/Complexity |
339
|
| 定义原子立体中心数目 |
0
|
| SMILES |
ClC1=CC=C(C=C1C(NC1C=CC=CC=1)=O)[N+](=O)[O-]
|
| InChi Key |
DNTSIBUQMRRYIU-UHFFFAOYSA-N
|
| InChi Code |
InChI=1S/C13H9ClN2O3/c14-12-7-6-10(16(18)19)8-11(12)13(17)15-9-4-2-1-3-5-9/h1-8H,(H,15,17)
|
| 化学名 |
2-Chloro-5-nitro- N -phenylbenzamide
|
| 别名 |
GW-9662; GW 9662; 2-Chloro-5-nitro-N-phenylbenzamide; 22978-25-2; 2-Chloro-5-nitrobenzanilide; GW-9662; benzamide, 2-chloro-5-nitro-N-phenyl-; 2-Chloro-5-nitro-N-4-phenylbenzamide; GW9662;
|
| HS Tariff Code |
2934.99.9001
|
| 存储方式 |
Powder -20°C 3 years 4°C 2 years In solvent -80°C 6 months -20°C 1 month |
| 运输条件 |
Room temperature (This product is stable at ambient temperature for a few days during ordinary shipping and time spent in Customs)
|
| 溶解度 (体外实验) |
|
|||
|---|---|---|---|---|
| 溶解度 (体内实验) |
配方 1 中的溶解度: ≥ 2.5 mg/mL (9.04 mM) (饱和度未知) in 10% DMSO + 40% PEG300 + 5% Tween80 + 45% Saline (这些助溶剂从左到右依次添加,逐一添加), 澄清溶液。
例如,若需制备1 mL的工作液,可将100 μL 25.0 mg/mL澄清DMSO储备液加入到400 μL PEG300中,混匀;然后向上述溶液中加入50 μL Tween-80,混匀;加入450 μL生理盐水定容至1 mL。 *生理盐水的制备:将 0.9 g 氯化钠溶解在 100 mL ddH₂O中,得到澄清溶液。 配方 2 中的溶解度: ≥ 2.5 mg/mL (9.04 mM) (饱和度未知) in 10% DMSO + 90% Corn Oil (这些助溶剂从左到右依次添加,逐一添加), 澄清溶液。 例如,若需制备1 mL的工作液,可将 100 μL 25.0 mg/mL 澄清 DMSO 储备液加入到 900 μL 玉米油中并混合均匀。 View More
配方 3 中的溶解度: ≥ 0.5 mg/mL (1.81 mM) (饱和度未知) in 1% DMSO 99% Saline (这些助溶剂从左到右依次添加,逐一添加), 澄清溶液。 配方 4 中的溶解度: 1% DMSO+30% polyethylene glycol+1% Tween 80: 30mg/mL 1、请先配制澄清的储备液(如:用DMSO配置50 或 100 mg/mL母液(储备液)); 2、取适量母液,按从左到右的顺序依次添加助溶剂,澄清后再加入下一助溶剂。以 下列配方为例说明 (注意此配方只用于说明,并不一定代表此产品 的实际溶解配方): 10% DMSO → 40% PEG300 → 5% Tween-80 → 45% ddH2O (或 saline); 假设最终工作液的体积为 1 mL, 浓度为5 mg/mL: 取 100 μL 50 mg/mL 的澄清 DMSO 储备液加到 400 μL PEG300 中,混合均匀/澄清;向上述体系中加入50 μL Tween-80,混合均匀/澄清;然后继续加入450 μL ddH2O (或 saline)定容至 1 mL; 3、溶剂前显示的百分比是指该溶剂在最终溶液/工作液中的体积所占比例; 4、 如产品在配制过程中出现沉淀/析出,可通过加热(≤50℃)或超声的方式助溶; 5、为保证最佳实验结果,工作液请现配现用! 6、如不确定怎么将母液配置成体内动物实验的工作液,请查看说明书或联系我们; 7、 以上所有助溶剂都可在 Invivochem.cn网站购买。 |
| 制备储备液 | 1 mg | 5 mg | 10 mg | |
| 1 mM | 3.6143 mL | 18.0714 mL | 36.1428 mL | |
| 5 mM | 0.7229 mL | 3.6143 mL | 7.2286 mL | |
| 10 mM | 0.3614 mL | 1.8071 mL | 3.6143 mL |
1、根据实验需要选择合适的溶剂配制储备液 (母液):对于大多数产品,InvivoChem推荐用DMSO配置母液 (比如:5、10、20mM或者10、20、50 mg/mL浓度),个别水溶性高的产品可直接溶于水。产品在DMSO 、水或其他溶剂中的具体溶解度详见上”溶解度 (体外)”部分;
2、如果您找不到您想要的溶解度信息,或者很难将产品溶解在溶液中,请联系我们;
3、建议使用下列计算器进行相关计算(摩尔浓度计算器、稀释计算器、分子量计算器、重组计算器等);
4、母液配好之后,将其分装到常规用量,并储存在-20°C或-80°C,尽量减少反复冻融循环。
计算结果:
工作液浓度: mg/mL;
DMSO母液配制方法: mg 药物溶于 μL DMSO溶液(母液浓度 mg/mL)。如该浓度超过该批次药物DMSO溶解度,请首先与我们联系。
体内配方配制方法:取 μL DMSO母液,加入 μL PEG300,混匀澄清后加入μL Tween 80,混匀澄清后加入 μL ddH2O,混匀澄清。
(1) 请确保溶液澄清之后,再加入下一种溶剂 (助溶剂) 。可利用涡旋、超声或水浴加热等方法助溶;
(2) 一定要按顺序加入溶剂 (助溶剂) 。
 |
|---|
 |

Effect of GW9662 on urine flow subsequent to I/R in rats pretreated with lipopolysaccharide.Kidney Int.2005 Aug;68(2):529-36. |