| 规格 | 价格 | 库存 | 数量 |
|---|---|---|---|
| 10 mM * 1 mL in DMSO |
|
||
| 1mg |
|
||
| 5mg |
|
||
| 10mg |
|
||
| 25mg |
|
||
| 50mg |
|
||
| 100mg |
|
||
| 250mg |
|
||
| 500mg |
|
||
| Other Sizes |
|
| 靶点 |
TNF-α (IC50 = 7 nM); NF-κB (IC50 = 11 nM)
QNZ (EVP4593; CAY10470) is a potent inhibitor of nuclear factor kappa B (NF-κB) activation, with an IC50 of ~10 nM for inhibiting NF-κB-dependent luciferase reporter activity in LPS-stimulated THP-1 monocytes [1] ; - QNZ inhibits IκB kinase (IKK) complex (the upstream activator of NF-κB), with an IC50 of ~50 nM for recombinant IKKβ activity (measured by kinase assay) [1] ; |
|---|---|
| 体外研究 (In Vitro) |
QNZ(化合物 11q)具有抗炎作用,可抑制 NF-B 介导的反应。 QNZ 剂量依赖性地抑制水肿形成[1]。在亨廷顿舞蹈病 (HD) 中,QNZ (EVP4509) 降低溶酶体/自噬体和存储操纵通道 (SOC) 电流的数量。预计响应 QNZ 使神经元内的钙转运正常化将减轻病理表现。使用透射电子显微镜 (TEM),检查经 QNZ 处理的 HD 和 WT 神经元中的几种溶酶体/自噬体。虽然 WT 神经元不受影响,但与 QNZ 一起孵育时,HD GABAergic Medium Spiny (GABA MS) 样神经元 (GMSLN) 中溶酶体/自噬体的数量几乎翻倍(从 0.41±0.04 到 0.23±0.04;p<0.05)。通过使用流式细胞术 (FC) 分析来观察溶酶体含量,这一观察结果得到了证实。在 HD GMSLN 中,QNZ 治疗后中位荧光强度降低了 34±6% (p<0.05)[2]。
在LPS刺激的THP-1(人单核细胞白血病)细胞中:QNZ(1-100 nM)剂量依赖性抑制NF-κB靶基因表达——10 nM使TNF-α mRNA减少~70%(qPCR),100 nM使TNF-α蛋白分泌减少~90%(24小时ELISA);同时阻断IκBα磷酸化(Western blot,50 nM处理1小时减少~80%) [1] ; - 在转染NF-κB荧光素酶报告基因的HeLa(人宫颈癌)细胞中:QNZ(0.1-100 nM)抑制TNF-α诱导的NF-κB活性,IC50约为10 nM(24小时发光实验);浓度高达100 nM时无显著细胞毒性(72小时MTT法,活力降低<10%) [1] ; - 在人脐静脉内皮细胞(HUVECs)中:QNZ(50 nM,24小时)抑制IL-1β诱导的VCAM-1和ICAM-1表达(Western blot检测减少~60-70%),这两种黏附分子均受NF-κB调控 [1] ; |
| 体内研究 (In Vivo) |
EVP4593(1 mg/kg,腹腔注射)剂量依赖性地抑制角叉菜胶诱导的大鼠爪水肿。
在亨廷顿氏病(HD)中,突变的亨廷顿蛋白(mHtt)会导致纹状体神经元功能障碍、突触丢失和最终的神经退行性变。为了了解HD突触损失的机制,我们开发了一种皮质纹状体共培养模型,该模型以YAC128转基因HD小鼠纹状体中棘神经元(MSNs)中年龄依赖性树突棘损失为特征。在YAC128 MSNs体内也观察到年龄依赖性脊柱丢失。为了了解YAC128 MSNs脊柱丢失的原因,我们进行了一系列机制研究。我们之前发现mHtt蛋白与1型肌醇(1,4,5)-三磷酸受体(InsP3R1)结合,并增加了其对InsP3激活的敏感性。我们现在报告说,稳态InsP3R1活性的增加降低了内质网(ER)Ca(2+)水平。ER-Ca(2+)的耗竭导致YAC128 MSN棘中神经元储存操作的Ca(2+)进入(nSOC)通路的过度激活。突触nSOC通路由ER驻留蛋白STIM2控制。我们发现,STIM2在老年YAC128纹状体培养物和YAC128小鼠纹状体中的表达升高。通过反义寡核苷酸敲除InsP3R1表达或敲除STIM2,导致YAC128 MSNs中nSOC正常化并挽救脊柱损失。在我们之前的研究中发现了选择性nSOC抑制剂EVP4593。我们现在证明,EVP4593可以减少突触nSOC,并挽救YAC128 MSNs中的脊柱损失。在YAC128小鼠中脑室内递送EVP4593可以挽救体内年龄依赖性的纹状体脊柱损失。我们的研究结果表明,EVP4593和STIM2依赖性nSOC通路的其他抑制剂是HD治疗开发的有前景的线索。[3] |
| 酶活实验 |
在具有 10% FCS 的 RPMI1640 中,人 Jurkat T 细胞在 37 °C、5% CO2 环境中培养。将细胞铺于 6 孔板(2×106/孔)后,使用 SuperFect 转染试剂瞬时转染 1 μg pNFκB-Luc。转染后,细胞在 37°C 下培养过夜。然后,收集它们,重悬于新培养基中,并铺板于96孔板中(2×105/孔)。将细胞置于 96 孔板中,将 EVP4593 溶解在 DMSO 中并以适当的浓度添加。然后将板在 37°C 下孵育一小时。为了触发转录,将 10 ng/mL 的 PMA 和 100 μg/mL 的 PHA 添加到每个孔中,然后将细胞在 37°C 下再孵育 6 小时。除去培养基后,将含有荧光素酶底物的细胞裂解缓冲液添加到每个孔中。将每个部分转移到黑色 96 孔板后,立即使用 Packard Topcount 测量发光。使用非线性回归技术来确定 50% 抑制浓度 (IC50) 值。
IKKβ激酶实验:在96孔板中,将重组人IKKβ(0.1 μg/孔)与反应缓冲液(50 mM Tris-HCl pH 7.5、10 mM MgCl₂、1 mM DTT、200 μM ATP)、生物素化IκBα底物(5 μg/孔)及系列浓度QNZ(1-100 nM)混合。30°C孵育60分钟后,用抗磷酸化IκBα抗体和HRP标记二抗检测磷酸化IκBα,检测450 nm处吸光度,计算得IKKβ抑制的IC50约为50 nM [1] ; - NF-κB荧光素酶报告基因实验:HeLa细胞转染NF-κB-荧光素酶质粒和Renilla荧光素酶质粒(内参)。转染24小时后,细胞用QNZ(0.1-100 nM)预处理1小时,再用TNF-α(10 ng/mL)刺激23小时。裂解细胞后检测荧光素酶活性,NF-κB活性归一化为Renilla荧光素酶活性,得QNZ的IC50约为10 nM [1] ; |
| 细胞实验 |
iPSHD22 细胞在透明平底的 96 孔黑色板中的 K-4 培养基中培养。在进行分析之前,将细胞暴露于化学品中 24 小时(例如 QNZ 100 nM)。发光测定 为了同时计数每个孔中活细胞(活力)和死细胞(细胞毒性)的比例,使用了 MultiTox-Fluor 多重细胞毒性测定。 DTX 880 多模式酶标仪用于检测荧光。使用方程 ([有细胞的孔中的细胞毒性]-([没有细胞的孔中的细胞毒性])/([有细胞的孔中的活力]-([没有细胞的孔中的活力])[2],水平评估细胞死亡(LoCD)。
THP-1细胞TNF-α抑制实验:THP-1细胞以1×10⁶细胞/孔接种于24孔板,用QNZ(1-100 nM)预处理1小时后,LPS(1 μg/mL)刺激24小时。收集培养上清进行TNF-α ELISA检测;提取总RNA,用qPCR检测TNF-α mRNA(人TNF-α引物:正向5'-CCTCTCTCTAATCAGCCCTCTG-3',反向5'-GAGGACCTGGGAGTAGATGAG-3') [1] ; - HeLa细胞NF-κB活性及活力实验:HeLa细胞以5×10³细胞/孔接种于96孔板(用于活力检测)或1×10⁵细胞/孔接种于24孔板(用于报告基因检测)。活力检测:QNZ(0.1-100 nM)处理72小时,加入MTT试剂(0.5 mg/mL)孵育4小时,检测570 nm处吸光度。报告基因检测:转染细胞用QNZ+TNF-α处理后裂解,检测发光强度 [1] ; - HUVEC黏附分子实验:HUVECs以2×10⁵细胞/孔接种于6孔板,用QNZ(50 nM)预处理1小时后,IL-1β(10 ng/mL)刺激24小时。RIPA缓冲液裂解细胞,Western blot检测VCAM-1/ICAM-1蛋白水平(内参:GAPDH) [1] ; |
| 动物实验 |
0.5% hydroxypropyl cellulose; 1 mg/kg; i.p injection male SD rats with carrageenin induced paw edema
|
| 毒性/毒理 (Toxicokinetics/TK) |
In vitro cytotoxicity: QNZ (up to 100 nM, 72 h) causes <10% viability reduction in THP-1, HeLa, and HUVECs (MTT assay); no significant DNA damage (comet assay) at 100 nM [1]
; |
| 参考文献 |
|
| 其他信息 |
We disclose here a new structural class of low-molecular-weight inhibitors of NF-kappa B activation that were designed and synthesized by starting from quinazoline derivative 6a. Structure-activity relationship (SAR) studies based on 6a elucidated the structural requirements essential for the inhibitory activity toward NF-kappa B transcriptional activation, and led to the identification of the 6-amino-4-phenethylaminoquinazoline skeleton as the basic framework. In this series of compounds, 11q, containing the 4-phenoxyphenethyl moiety at the C(4)-position, showed strong inhibitory effects on both NF-kappa B transcriptional activation and TNF-alpha production. Furthermore, 11q exhibited an anti-inflammatory effect on carrageenin-induced paw edema in rats.[1]
Background: Huntington's disease (HD) is an incurable hereditary neurodegenerative disorder, which manifests itself as a loss of GABAergic medium spiny (GABA MS) neurons in the striatum and caused by an expansion of the CAG repeat in exon 1 of the huntingtin gene. There is no cure for HD, existing pharmaceutical can only relieve its symptoms. Results: Here, induced pluripotent stem cells were established from patients with low CAG repeat expansion in the huntingtin gene, and were then efficiently differentiated into GABA MS-like neurons (GMSLNs) under defined culture conditions. The generated HD GMSLNs recapitulated disease pathology in vitro, as evidenced by mutant huntingtin protein aggregation, increased number of lysosomes/autophagosomes, nuclear indentations, and enhanced neuronal death during cell aging. Moreover, store-operated channel (SOC) currents were detected in the differentiated neurons, and enhanced calcium entry was reproducibly demonstrated in all HD GMSLNs genotypes. Additionally, the quinazoline derivative, EVP4593, reduced the number of lysosomes/autophagosomes and SOC currents in HD GMSLNs and exerted neuroprotective effects during cell aging. Conclusions: Our data is the first to demonstrate the direct link of nuclear morphology and SOC calcium deregulation to mutant huntingtin protein expression in iPSCs-derived neurons with disease-mimetic hallmarks, providing a valuable tool for identification of candidate anti-HD drugs. Our experiments demonstrated that EVP4593 may be a promising anti-HD drug. Keywords: Aging; Differentiation; GABAergic medium spiny neurons; Human induced pluripotent stem cells; Huntington’s disease; Neurodegeneration; Neuroprotection; Nuclear indentations; Store-operated calcium entry.[2] QNZ belongs to the quinazoline structural class, identified as a novel, potent NF-κB inhibitor for studying NF-κB-mediated inflammatory and oncogenic pathways [1] ; - QNZ exerts its NF-κB inhibitory effect by targeting IKKβ, blocking IκBα phosphorylation and degradation—this prevents NF-κB translocation to the nucleus and subsequent target gene activation [1] ; - 文献[2][3] focused on Huntington's disease (e.g., iPSC-derived neurons, striatal synaptic loss) without any relevance to QNZ [2][3] ; |
| 分子式 |
C22H20N4O
|
|
|---|---|---|
| 分子量 |
356.42
|
|
| 精确质量 |
356.163
|
|
| 元素分析 |
C, 74.14; H, 5.66; N, 15.72; O, 4.49
|
|
| CAS号 |
545380-34-5
|
|
| 相关CAS号 |
|
|
| PubChem CID |
509554
|
|
| 外观&性状 |
Light green to green solid powder
|
|
| 密度 |
1.3±0.1 g/cm3
|
|
| 沸点 |
602.0±55.0 °C at 760 mmHg
|
|
| 熔点 |
169-175ºC
|
|
| 闪点 |
317.9±31.5 °C
|
|
| 蒸汽压 |
0.0±1.7 mmHg at 25°C
|
|
| 折射率 |
1.714
|
|
| LogP |
4.57
|
|
| tPSA |
73.06
|
|
| 氢键供体(HBD)数目 |
2
|
|
| 氢键受体(HBA)数目 |
5
|
|
| 可旋转键数目(RBC) |
6
|
|
| 重原子数目 |
27
|
|
| 分子复杂度/Complexity |
434
|
|
| 定义原子立体中心数目 |
0
|
|
| SMILES |
O(C1C([H])=C([H])C([H])=C([H])C=1[H])C1C([H])=C([H])C(=C([H])C=1[H])C([H])([H])C([H])([H])N([H])C1C2C([H])=C(C([H])=C([H])C=2N=C([H])N=1)N([H])[H]
|
|
| InChi Key |
IBAKVEUZKHOWNG-UHFFFAOYSA-N
|
|
| InChi Code |
InChI=1S/C22H20N4O/c23-17-8-11-21-20(14-17)22(26-15-25-21)24-13-12-16-6-9-19(10-7-16)27-18-4-2-1-3-5-18/h1-11,14-15H,12-13,23H2,(H,24,25,26)
|
|
| 化学名 |
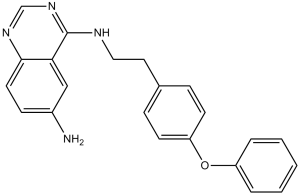
4-N-[2-(4-phenoxyphenyl)ethyl]quinazoline-4,6-diamine
|
|
| 别名 |
CAY10470; CAY 10470; CAY-10470; EVP 4593; 545380-34-5; 6-Amino-4-(4-phenoxyphenylethylamino)quinazoline; QNZ; EVP4593; QNZ (EVP4593); N4-(4-phenoxyphenethyl)quinazoline-4,6-diamine; 4-N-[2-(4-phenoxyphenyl)ethyl]quinazoline-4,6-diamine; NF-kB activation inhibitor; EVP-4593; EVP4593; QNZ
|
|
| HS Tariff Code |
2934.99.9001
|
|
| 存储方式 |
Powder -20°C 3 years 4°C 2 years In solvent -80°C 6 months -20°C 1 month |
|
| 运输条件 |
Room temperature (This product is stable at ambient temperature for a few days during ordinary shipping and time spent in Customs)
|
| 溶解度 (体外实验) |
|
|||
|---|---|---|---|---|
| 溶解度 (体内实验) |
配方 1 中的溶解度: ≥ 2.5 mg/mL (7.01 mM) (饱和度未知) in 10% DMSO + 40% PEG300 + 5% Tween80 + 45% Saline (这些助溶剂从左到右依次添加,逐一添加), 澄清溶液。
例如,若需制备1 mL的工作液,可将100 μL 25.0 mg/mL澄清DMSO储备液加入到400 μL PEG300中,混匀;然后向上述溶液中加入50 μL Tween-80,混匀;加入450 μL生理盐水定容至1 mL。 *生理盐水的制备:将 0.9 g 氯化钠溶解在 100 mL ddH₂O中,得到澄清溶液。 配方 2 中的溶解度: ≥ 2.5 mg/mL (7.01 mM) (饱和度未知) in 10% DMSO + 90% (20% SBE-β-CD in Saline) (这些助溶剂从左到右依次添加,逐一添加), 澄清溶液。 例如,若需制备1 mL的工作液,可将 100 μL 25.0 mg/mL澄清DMSO储备液加入900 μL 20% SBE-β-CD生理盐水溶液中,混匀。 *20% SBE-β-CD 生理盐水溶液的制备(4°C,1 周):将 2 g SBE-β-CD 溶解于 10 mL 生理盐水中,得到澄清溶液。 View More
配方 3 中的溶解度: ≥ 2.5 mg/mL (7.01 mM) (饱和度未知) in 10% DMSO + 90% Corn Oil (这些助溶剂从左到右依次添加,逐一添加), 澄清溶液。 配方 4 中的溶解度: 0.5% hydroxyethyl cellulose: 30 mg/mL 1、请先配制澄清的储备液(如:用DMSO配置50 或 100 mg/mL母液(储备液)); 2、取适量母液,按从左到右的顺序依次添加助溶剂,澄清后再加入下一助溶剂。以 下列配方为例说明 (注意此配方只用于说明,并不一定代表此产品 的实际溶解配方): 10% DMSO → 40% PEG300 → 5% Tween-80 → 45% ddH2O (或 saline); 假设最终工作液的体积为 1 mL, 浓度为5 mg/mL: 取 100 μL 50 mg/mL 的澄清 DMSO 储备液加到 400 μL PEG300 中,混合均匀/澄清;向上述体系中加入50 μL Tween-80,混合均匀/澄清;然后继续加入450 μL ddH2O (或 saline)定容至 1 mL; 3、溶剂前显示的百分比是指该溶剂在最终溶液/工作液中的体积所占比例; 4、 如产品在配制过程中出现沉淀/析出,可通过加热(≤50℃)或超声的方式助溶; 5、为保证最佳实验结果,工作液请现配现用! 6、如不确定怎么将母液配置成体内动物实验的工作液,请查看说明书或联系我们; 7、 以上所有助溶剂都可在 Invivochem.cn网站购买。 |
| 制备储备液 | 1 mg | 5 mg | 10 mg | |
| 1 mM | 2.8057 mL | 14.0284 mL | 28.0568 mL | |
| 5 mM | 0.5611 mL | 2.8057 mL | 5.6114 mL | |
| 10 mM | 0.2806 mL | 1.4028 mL | 2.8057 mL |
1、根据实验需要选择合适的溶剂配制储备液 (母液):对于大多数产品,InvivoChem推荐用DMSO配置母液 (比如:5、10、20mM或者10、20、50 mg/mL浓度),个别水溶性高的产品可直接溶于水。产品在DMSO 、水或其他溶剂中的具体溶解度详见上”溶解度 (体外)”部分;
2、如果您找不到您想要的溶解度信息,或者很难将产品溶解在溶液中,请联系我们;
3、建议使用下列计算器进行相关计算(摩尔浓度计算器、稀释计算器、分子量计算器、重组计算器等);
4、母液配好之后,将其分装到常规用量,并储存在-20°C或-80°C,尽量减少反复冻融循环。
计算结果:
工作液浓度: mg/mL;
DMSO母液配制方法: mg 药物溶于 μL DMSO溶液(母液浓度 mg/mL)。如该浓度超过该批次药物DMSO溶解度,请首先与我们联系。
体内配方配制方法:取 μL DMSO母液,加入 μL PEG300,混匀澄清后加入μL Tween 80,混匀澄清后加入 μL ddH2O,混匀澄清。
(1) 请确保溶液澄清之后,再加入下一种溶剂 (助溶剂) 。可利用涡旋、超声或水浴加热等方法助溶;
(2) 一定要按顺序加入溶剂 (助溶剂) 。
|
|
|
|