| 规格 | 价格 | 库存 | 数量 |
|---|---|---|---|
| 10 mM * 1 mL in DMSO |
|
||
| 1mg |
|
||
| 5mg |
|
||
| 10mg |
|
||
| 25mg |
|
||
| 50mg |
|
||
| 100mg |
|
||
| 250mg |
|
||
| 500mg |
|
||
| 1g | |||
| Other Sizes |
| 靶点 |
- Peroxisome proliferator-activated receptor gamma (PPARγ):
- Human PPARγ: Dissociation constant (Ki) = 1.0 nM (radioligand competition binding assay) [4] - Murine PPARγ: Inhibition of PPARγ-mediated transcriptional activity, half-maximal inhibitory concentration (IC50) = 2.5 nM (luciferase reporter gene assay in COS-7 cells) [4] - RAD51 (a key protein in homologous recombination DNA repair): Inhibits RAD51-mediated DNA damage repair [1] |
|---|---|
| 体外研究 (In Vitro) |
暴露于 4 Gy 辐射的 ME-180 和 SiHa 细胞在用 T0070907 (50 μM) 预处理后表现出 IR 诱导的 DNA DSB 修复受损。在 ME-180 和 SiHa 细胞中,T0070907 (0-50 μM) 显着降低 DNA-PKcs 和 RAD51 蛋白水平 [1]。在 ME180 和 SiHa 细胞中,T0070907 (50 μM) 处理可抑制 DNA 合成,抑制辐射诱导的细胞周期调节蛋白变化,并以时间依赖性方式降低 α- 和 β- 微管蛋白水平 [2]。 T0070907 (10 μM) 表现出脂肪细胞特有的细胞毒性,且不依赖于 PPARγ。 T0070907 会升高未成熟脂肪细胞的氧化应激[3]。 T0070907 (1 μM) 可防止脂肪形成细胞系 3T3-L1 受到诱导脂肪形成的处理。 T0070907 共价改变人 PPAR 2 螺旋 3 的半胱氨酸 313 [4]。
1. PPARγ活性抑制及机制: - 在重组人PPARγ配体结合域(LBD)实验中,T0070907与[³H]-罗格列酮(PPARγ激动剂)竞争结合PPARγ,Ki=1.0 nM。该结合具有可逆性——通过透析去除未结合药物后,PPARγ与[³H]-罗格列酮的结合能力可恢复[4] - 在共转染小鼠PPARγ与PPARγ响应荧光素酶报告质粒的COS-7细胞中,T0070907(0.1-100 nM)剂量依赖性抑制罗格列酮(100 nM)诱导的荧光素酶活性,IC50=2.5 nM;同时可抑制3T3-L1前脂肪细胞中PPARγ依赖的脂肪分化标志物(如aP2、脂联素)表达[4] 2. 靶向RAD51抑制辐射诱导的DNA损伤修复: - 在经电离辐射(IR,2 Gy)+T0070907(1-10 μM)处理的HeLa和MCF-7细胞中,γ-H2AX焦点(DNA双链断裂标志物)数量显著高于单独IR组。10 μM时,γ-H2AX焦点可持续24小时(单独IR组仅持续8小时),提示DNA双链断裂修复延迟[1] - Western blot显示,T0070907(5-10 μM)使IR处理细胞中RAD51蛋白水平降低45%-60%,RAD51焦点形成减少58%(10 μM时);免疫共沉淀证实其可破坏RAD51与BRCA2(RAD51辅助因子)的相互作用[1] 3. 人宫颈癌细胞G2/M期阻滞及辐射增敏: - 在SiHa和HeLa宫颈癌细胞中,T0070907(2.5-10 μM)剂量依赖性诱导G2/M期阻滞。10 μM时,G2/M期细胞比例从对照的15.2%升至SiHa细胞42.8%、HeLa细胞45.1%(流式细胞术)[2] - T0070907(5 μM)与IR(2-6 Gy)联用可增强抗增殖效果:SiHa细胞存活分数从单独IR(4 Gy)的0.62降至联用组0.28,辐射增强比(RER)=1.8;该效应与有丝分裂灾难增加相关(5 μM+4 Gy组较单独IR组增加3.2倍)[2] 4. 非PPARγ依赖的未成熟脂肪细胞毒性: - 3T3-L1前脂肪细胞(未成熟脂肪细胞)经T0070907(1-20 μM)处理48小时后,细胞活力(MTT法)剂量依赖性降低,IC50=8.5 μM;凋亡率从对照的3.2%升至20 μM时35.6%(Annexin V-FITC/PI染色)[3] - 在成熟3T3-L1脂肪细胞中,T0070907浓度高达20 μM时对活力(>90%)或脂肪细胞功能(如脂质蓄积、胰岛素刺激葡萄糖摄取)无显著影响;siRNA敲低PPARγ后,其对前脂肪细胞的毒性未减弱,证实非PPARγ依赖机制[3] 。 |
| 体内研究 (In Vivo) |
脂多糖预处理显着减轻肾功能障碍、肝细胞损伤和循环衰竭的发展以及由严重内毒素血症引起的白介素-1β血浆水平的增加。 T0070907 可以减弱脂多糖预处理带来的所有这些有益效果。
|
| 酶活实验 |
1. PPARγ放射配体竞争结合实验:
- 将重组人PPARγ LBD(2 μg/mL)与[³H]-罗格列酮(0.5 nM)及不同浓度T0070907(0.1-100 nM)在结合缓冲液(20 mM Tris-HCl,pH7.4,1 mM EDTA,10%甘油,1 mM DTT)中混合,4°C孵育12小时达到结合平衡[4] - 通过Sephadex G-50凝胶过滤柱分离游离[³H]-罗格列酮与PPARγ-LBD复合物,液体闪烁计数器检测复合物放射性;采用Cheng-Prusoff方程计算Ki=1.0 nM[4] 2. PPARγ转录活性抑制实验(荧光素酶报告基因实验): - COS-7细胞以5×10⁴个/孔接种于24孔板,含10% FBS的DMEM培养24小时;共转染三种质粒:小鼠PPARγ表达质粒(pCMV-mPPARγ)、PPARγ响应报告质粒(pPPRE-luc,含4个PPAR响应元件)及海肾荧光素酶质粒(pRL-TK,内参)[4] - 转染24小时后,更换为含T0070907(0.1-100 nM)及罗格列酮(100 nM)的新鲜培养基;继续孵育24小时后,被动裂解液裂解细胞,双荧光素酶检测系统测定活性;以相对荧光素酶活性(萤火虫/海肾)计算IC50=2.5 nM[4] 3. RAD51焦点形成实验(免疫荧光): - HeLa细胞以1×10⁴个/盖玻片接种,经IR(2 Gy)+T0070907(10 μM)处理;IR后4小时,4%多聚甲醛固定,0.2% Triton X-100透化,5% BSA封闭[1] - 抗RAD51一抗(4°C过夜)、FITC标记二抗(37°C 1小时)孵育,DAPI染核;荧光显微镜下计数RAD51焦点(每盖玻片5个视野),每细胞焦点数从单独IR组12.8个降至联用组5.4个[1] 。 |
| 细胞实验 |
1. 宫颈癌细胞增殖及细胞周期实验:
- SiHa/HeLa细胞分别以5×10³个/孔(96孔板,增殖实验)或2×10⁵个/孔(6孔板,细胞周期实验)接种,经T0070907(2.5-10 μM)单独处理或与IR(2-6 Gy)联用[2] - 增殖(MTT):处理48小时后,加入20 μL MTT(5 mg/mL)孵育4小时,150 μL DMSO溶解甲臜;570 nm测吸光度,计算存活分数以确定辐射增强比[2] - 细胞周期(流式细胞术):收集细胞,70%乙醇(4°C过夜)固定,碘化丙啶(PI,50 μg/mL)+RNase A(100 μg/mL)染色30分钟;流式细胞术分析DNA含量,定量G2/M期细胞比例[2] 2. 3T3-L1前脂肪细胞活力及凋亡实验: - 3T3-L1前脂肪细胞以4×10³个/孔(96孔板,活力实验)或1×10⁵个/孔(6孔板,凋亡实验)接种,经T0070907(1-20 μM)处理48小时[3] - 活力(MTT):加入MTT试剂,570 nm测吸光度,计算IC50=8.5 μM[3] - 凋亡(Annexin V-FITC/PI):胰酶消化细胞,PBS洗涤后,Annexin V-FITC和PI避光染色15分钟,流式细胞术分析凋亡率[3] 3. DNA损伤修复实验(γ-H2AX焦点检测): - HeLa细胞以1×10⁴个/孔接种于24孔板,经IR(2 Gy)+T0070907(1-10 μM)处理;IR后0、8、16、24小时,固定、透化细胞,FITC标记抗γ-H2AX抗体染色[1] - 荧光显微镜下计数γ-H2AX焦点,24小时时每细胞焦点数:单独IR组1.2个 vs. 10 μM T0070907+IR组8.5个,提示修复延迟[1] 。 |
| 动物实验 |
Dissolved in 10% v/v dimethylsulfoxide [DMSO], 20–25% v/v DMSO, or saline; 1 mg/kg; i.p. injection
Preconditioning is performed by administering a low dose (1 mg/kg) of Escherichia coli LPS (serotype 0.127:B8) intraperitoneally 24 hr before the induction of severe endotoxemia. |
| 毒性/毒理 (Toxicokinetics/TK) |
1. In vitro cytotoxicity (cell type selectivity):
- Selective cytotoxicity against immature adipocytes: T0070907 (IC50 = 8.5 μM) induced apoptosis in 3T3-L1 preadipocytes, but had no effect on mature 3T3-L1 adipocytes (viability >90% at 20 μM) or normal human foreskin fibroblasts (HFFs, viability >85% at 20 μM) [3] - Cytotoxicity in cancer cells: In SiHa/HeLa cervical cancer cells, T0070907 alone (10 μM) inhibited proliferation by 42%-45%, with no significant cytotoxicity in normal cervical epithelial cells (HCerEpiC, viability >80% at 10 μM) [2] 2. Off-target effects: - T0070907 (up to 10 μM) did not affect the activity of other PPAR isoforms (PPARα, PPARδ) or nuclear receptors (e.g., RXRα, ERα) in reporter gene assays, confirming PPARγ selectivity [4] ; |
| 参考文献 |
|
| 其他信息 |
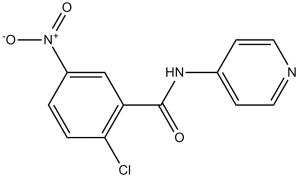
2-chloro-5-nitro-N-pyridin-4-ylbenzamide is a carbonyl compound and an organohalogen compound.
1. Background and mechanism of action: - T0070907 is a synthetic, selective, and reversible antagonist of PPARγ, widely used as a research tool to study PPARγ’s role in metabolism, cancer, and DNA repair [4] - Its biological activities include two major mechanisms: (1) PPARγ-dependent: Inhibits PPARγ transcriptional activity by competing with agonists for ligand binding, suppressing adipocyte differentiation [4]; (2) PPARγ-independent: Targets RAD51 to disrupt homologous recombination, delaying DNA damage repair and enhancing radiation sensitivity; induces G2/M arrest and mitotic catastrophe in cancer cells; and exerts selective cytotoxicity against immature adipocytes [1-3] 2. Research utility: - Used to distinguish PPARγ-dependent vs. independent effects of test compounds (e.g., in adipocyte differentiation or cancer cell proliferation studies) [3,4] - Serves as a tool to investigate the role of RAD51 in DNA repair and develop radiation sensitizers for cancer therapy [1,2] 3. Therapeutic potential: - Preclinical studies suggest potential applications in: (1) Cancer therapy: As a radiation sensitizer for cervical cancer and breast cancer by inhibiting DNA repair [1,2]; (2) Metabolic disorders: Targeting immature adipocytes to regulate adipogenesis without affecting mature adipocyte function [3] ; |
| 分子式 |
C12H8CLN3O3
|
|
|---|---|---|
| 分子量 |
277.66
|
|
| 精确质量 |
277.025
|
|
| CAS号 |
313516-66-4
|
|
| 相关CAS号 |
|
|
| PubChem CID |
2777391
|
|
| 外观&性状 |
White to light yellow solid powder
|
|
| 密度 |
1.5±0.1 g/cm3
|
|
| 沸点 |
381.7±37.0 °C at 760 mmHg
|
|
| 闪点 |
184.6±26.5 °C
|
|
| 蒸汽压 |
0.0±0.9 mmHg at 25°C
|
|
| 折射率 |
1.684
|
|
| LogP |
2.25
|
|
| tPSA |
87.81
|
|
| 氢键供体(HBD)数目 |
1
|
|
| 氢键受体(HBA)数目 |
4
|
|
| 可旋转键数目(RBC) |
2
|
|
| 重原子数目 |
19
|
|
| 分子复杂度/Complexity |
342
|
|
| 定义原子立体中心数目 |
0
|
|
| InChi Key |
FRPJSHKMZHWJBE-UHFFFAOYSA-N
|
|
| InChi Code |
InChI=1S/C12H8ClN3O3/c13-11-2-1-9(16(18)19)7-10(11)12(17)15-8-3-5-14-6-4-8/h1-7H,(H,14,15,17)
|
|
| 化学名 |
2-chloro-5-nitro-N-(pyridin-4-yl)benzamide
|
|
| 别名 |
T-0070907; T 0070907; T0070907;
|
|
| HS Tariff Code |
2934.99.9001
|
|
| 存储方式 |
Powder -20°C 3 years 4°C 2 years In solvent -80°C 6 months -20°C 1 month |
|
| 运输条件 |
Room temperature (This product is stable at ambient temperature for a few days during ordinary shipping and time spent in Customs)
|
| 溶解度 (体外实验) |
|
|||
|---|---|---|---|---|
| 溶解度 (体内实验) |
配方 1 中的溶解度: ≥ 1 mg/mL (3.60 mM) (饱和度未知) in 10% DMSO + 40% PEG300 + 5% Tween80 + 45% Saline (这些助溶剂从左到右依次添加,逐一添加), 澄清溶液。
例如,若需制备1 mL的工作液,可将100 μL 10.0 mg/mL澄清DMSO储备液加入400 μL PEG300中,混匀;然后向上述溶液中加入50 μL Tween-80,混匀;加入450 μL生理盐水定容至1 mL。 *生理盐水的制备:将 0.9 g 氯化钠溶解在 100 mL ddH₂O中,得到澄清溶液。 配方 2 中的溶解度: ≥ 1 mg/mL (3.60 mM) (饱和度未知) in 10% DMSO + 90% (20% SBE-β-CD in Saline) (这些助溶剂从左到右依次添加,逐一添加), 澄清溶液。 例如,若需制备1 mL的工作液,可将 100 μL 10.0 mg/mL澄清DMSO储备液加入900 μL 20% SBE-β-CD生理盐水溶液中,混匀。 *20% SBE-β-CD 生理盐水溶液的制备(4°C,1 周):将 2 g SBE-β-CD 溶解于 10 mL 生理盐水中,得到澄清溶液。 View More
配方 3 中的溶解度: ≥ 1 mg/mL (3.60 mM) (饱和度未知) in 10% DMSO + 90% Corn Oil (这些助溶剂从左到右依次添加,逐一添加), 澄清溶液。 配方 4 中的溶解度: 1% DMSO+30% polyethylene glycol+1% Tween 80: 30mg/mL 1、请先配制澄清的储备液(如:用DMSO配置50 或 100 mg/mL母液(储备液)); 2、取适量母液,按从左到右的顺序依次添加助溶剂,澄清后再加入下一助溶剂。以 下列配方为例说明 (注意此配方只用于说明,并不一定代表此产品 的实际溶解配方): 10% DMSO → 40% PEG300 → 5% Tween-80 → 45% ddH2O (或 saline); 假设最终工作液的体积为 1 mL, 浓度为5 mg/mL: 取 100 μL 50 mg/mL 的澄清 DMSO 储备液加到 400 μL PEG300 中,混合均匀/澄清;向上述体系中加入50 μL Tween-80,混合均匀/澄清;然后继续加入450 μL ddH2O (或 saline)定容至 1 mL; 3、溶剂前显示的百分比是指该溶剂在最终溶液/工作液中的体积所占比例; 4、 如产品在配制过程中出现沉淀/析出,可通过加热(≤50℃)或超声的方式助溶; 5、为保证最佳实验结果,工作液请现配现用! 6、如不确定怎么将母液配置成体内动物实验的工作液,请查看说明书或联系我们; 7、 以上所有助溶剂都可在 Invivochem.cn网站购买。 |
| 制备储备液 | 1 mg | 5 mg | 10 mg | |
| 1 mM | 3.6015 mL | 18.0076 mL | 36.0153 mL | |
| 5 mM | 0.7203 mL | 3.6015 mL | 7.2031 mL | |
| 10 mM | 0.3602 mL | 1.8008 mL | 3.6015 mL |
1、根据实验需要选择合适的溶剂配制储备液 (母液):对于大多数产品,InvivoChem推荐用DMSO配置母液 (比如:5、10、20mM或者10、20、50 mg/mL浓度),个别水溶性高的产品可直接溶于水。产品在DMSO 、水或其他溶剂中的具体溶解度详见上”溶解度 (体外)”部分;
2、如果您找不到您想要的溶解度信息,或者很难将产品溶解在溶液中,请联系我们;
3、建议使用下列计算器进行相关计算(摩尔浓度计算器、稀释计算器、分子量计算器、重组计算器等);
4、母液配好之后,将其分装到常规用量,并储存在-20°C或-80°C,尽量减少反复冻融循环。
计算结果:
工作液浓度: mg/mL;
DMSO母液配制方法: mg 药物溶于 μL DMSO溶液(母液浓度 mg/mL)。如该浓度超过该批次药物DMSO溶解度,请首先与我们联系。
体内配方配制方法:取 μL DMSO母液,加入 μL PEG300,混匀澄清后加入μL Tween 80,混匀澄清后加入 μL ddH2O,混匀澄清。
(1) 请确保溶液澄清之后,再加入下一种溶剂 (助溶剂) 。可利用涡旋、超声或水浴加热等方法助溶;
(2) 一定要按顺序加入溶剂 (助溶剂) 。
|
|---|
|
|