| 规格 | 价格 | 库存 | 数量 |
|---|---|---|---|
| 10 mM * 1 mL in DMSO |
|
||
| 1mg |
|
||
| 5mg |
|
||
| 10mg |
|
||
| 25mg |
|
||
| 50mg |
|
||
| 100mg |
|
||
| 250mg |
|
||
| 500mg |
|
||
| Other Sizes |
|
| 靶点 |
HSP90 (EC50 = 62 nM); GRP94 (EC50 = 65 nM)
Heat Shock Protein 90 (HSP90): 17-DMAG (Alvespimycin) HCl is a selective inhibitor of HSP90, binding to the ATP-binding pocket of the active conformation of HSP90. In purified human recombinant HSP90α ATPase activity assays, its IC50 was 1.2 nM, ~8-fold more potent than 17-AAG (IC50=9.6 nM) [1] - No direct binding to downstream client proteins (e.g., NF-κB family, Akt, α-SMA), but induces their ubiquitin-dependent degradation by inhibiting HSP90 chaperone function [2][3] |
|---|---|
| 体外研究 (In Vitro) |
人癌细胞系 SKBR3 和 SKOV3 过度表达 Hsp90 蛋白 Her2,其增殖可被盐酸阿维斯匹霉素(17-DMAG 盐酸盐;KOS-1022;BMS 826476)抑制。这导致 Her2 下调和 Hsp70 上调。在SKBR3和SKOV3细胞中Hsp90抑制Her2降解的EC50值分别为8±4nM和46±24nM。同样,SKBR3 和 SKOV3 细胞中 Hsp70 诱导的 EC50 值分别为 4±2 nM 和 14±7 nM [1]。与载体对照相比,在 50 nM 至 500 nM 的浓度(对应于药理学可达到的水平)下,17-DMAG 表现出剂量依赖性细胞凋亡(24 小时和 48 小时时间段的平均值 P<0.001)。在治疗 24 至 48 小时的慢性淋巴细胞白血病 (CLL) 细胞中,盐酸阿维斯匹霉素也表现出时间依赖性细胞凋亡(P < 0.001,所有剂量的平均值),就像许多其他药物一样。此外,治疗24小时和48小时后,盐酸Alvespimycin比17-AAG更有效[2]。
HSP90抑制与抗增殖活性: - HSP90 ATP酶抑制:17-DMAG HCl(0.1-10 nM)呈剂量依赖性抑制人重组HSP90α ATP酶活性:1.2 nM时抑制率达50%,10 nM时抑制率达90%(通过[γ-³²P]-ATP水解实验测得) [1] - 水溶性改善:17-DMAG HCl在pH 7.4条件下水溶性>10 mg/mL,较17-AAG(<0.1 mg/mL)提高100倍以上,解决了17-AAG水溶性差的问题 [1] - 癌细胞抗增殖活性:17-DMAG HCl(0.5-50 nM)抑制多种癌细胞活力(MTT法,孵育72 h):IC50值分别为A549肺癌细胞3.5 nM、MCF-7乳腺癌细胞4.2 nM、PC-3前列腺癌细胞5.1 nM。10 nM时,细胞活力较对照组降低75-80% [1] - 客户蛋白降解:10 nM 17-DMAG HCl处理24 h,使HSP90客户蛋白(Akt、Raf-1、HER2)表达降低65-80%(Western blot),而HSP90总表达无显著变化 [1] - 慢性淋巴细胞白血病(CLL)细胞凋亡诱导: - 原代CLL细胞:17-DMAG HCl(5-50 nM)呈剂量依赖性诱导凋亡(Annexin V-FITC/PI双染):20 nM处理48 h,凋亡率从对照组5%升至45%。12例患者来源的CLL细胞均表现出类似敏感性,IC50范围15-25 nM [2] - NF-κB家族蛋白降解:20 nM 17-DMAG HCl处理24 h,使NF-κB p65(70%)、p50(65%)、c-Rel(75%)表达降低(Western blot);核内NF-κB活性(荧光素酶实验)降低80% [2] - 客户蛋白(Akt、Bcl-2)下调:20 nM时Akt表达降低60%,Bcl-2降低55%,同时HSP70(HSP90抑制的标志性蛋白)表达上调3.2倍 [2] - 正常细胞选择性:对正常人B细胞的IC50为120 nM,是CLL细胞的5倍 [2] - 前列腺癌相关成纤维细胞(CAFs)功能抑制: - 收缩性抑制:17-DMAG HCl(10-50 nM)呈剂量依赖性降低CAFs收缩性(胶原凝胶收缩实验):30 nM处理72 h,收缩率从对照组60%降至20%。Western blot显示收缩标志物α-SMA表达降低65% [3] - 运动性抑制:30 nM 17-DMAG HCl使CAFs迁移能力降低70%(Transwell实验),侵袭能力降低60%(Matrigel侵袭实验);运动标志物波形蛋白(vimentin)表达降低55%(Western blot) [3] - 旁分泌效应抑制:经30 nM 17-DMAG HCl处理的CAFs条件培养基(CM),促进前列腺癌细胞(LNCaP)增殖的能力显著降低(活力较未处理CAF-CM组降低40%) [3] |
| 体内研究 (In Vivo) |
在肿瘤形成前一个月,每四天腹腔注射0、5、10和20 mg/kg 17-DMAG或0、50、100和200 mg/kg二棕榈酰二醇。尽管样本异质性,但用 HSP90 抑制剂治疗的小鼠的肿瘤尺寸比用载体对照治疗的小鼠小得多。已证明HSP90抑制剂在胃肠道癌症动物模型中产生肝毒性。然而,100 mg/kg 的二棕榈酰二醇大大减小了肿瘤大小,10 或 20 mg/kg 的 17-DMAG 也有同样的效果 [3]。
SCID小鼠CLL异种移植模型: - 动物与分组:雄性SCID小鼠(6-8周龄,体重20-22 g,每组6只)随机分为3组:溶剂组(5% DMSO/PBS,腹腔注射)、17-DMAG HCl10 mg/kg组(腹腔注射)、17-DMAG HCl20 mg/kg组(腹腔注射) [2] - 肿瘤诱导与处理:将1×10⁷个患者来源原代CLL细胞腹腔注射至小鼠体内,检测到腹水(肿瘤标志物)后,每日给药1次,持续14天 [2] - 疗效结果:20 mg/kg组腹水体积减少80%(1.2±0.2 mL vs 溶剂组6.0±0.5 mL),腹水中CLL细胞计数减少75%(2.5×10⁷ vs 10×10⁷细胞/mL) [2] - 机制验证:腹水CLL细胞中NF-κB p65(0.3倍)和Akt(0.25倍)表达下调(Western blot);TUNEL染色显示凋亡细胞比例达35%,溶剂组仅5% [2] |
| 酶活实验 |
竞争结合测定。[1]
从HeLa细胞(SPP-770)和重组犬Grp94(SPP-766)中分离的天然人Hsp90蛋白(α+β异构体)购自Stressgen Biotechnologies。基于FP的结合测定的程序改编自Chiosis及其同事所描述的程序。42,43 BODIPY-AG溶液在FP测定缓冲液(20mM HEPES−KOH,pH 7.3,1.0mM EDTA,100mM KCl,5.0mM MgCl2,0.01%NP-40,0.1mg/mL新鲜牛γ-球蛋白(BGG),1.0mM新鲜DTT和完全蛋白酶抑制剂)中从DMSO的储备溶液中新鲜制备。通过在384孔微孔板中混合等体积(10μL)的BODIPY-AG溶液和连续稀释的人Hsp90(或Grp94)溶液获得结合曲线,得到10nM的BODIPY-AG、不同浓度的Hsp90和0.05%DMSO。在30°C下孵育3小时后,在EnVision 2100多标签板读取器上测量荧光各向异性(λEx=485 nm,λEm=535 nm)。通过混合每种含有BODIPY-AG和Hsp90(或Grp94)的溶液10μL,以及从DMSO中的储备溶液在FP测定缓冲液中新制备的每种化合物的连续稀释,获得竞争曲线。最终浓度为10 nM BODIPY-AG、40或60 nM Hsp90(或Grp94)、不同浓度的每种化合物(0.10 nM−10μM)和≤0.25%二甲基亚砜。由于化合物(1−3)a在中性pH下易于氧化,因此在氮气氛下,在LabMaster手套箱(M.Braun,Stratham,NH)中与醌类化合物(1–3)b平行进行这些化合物的测定。通常,将Hsp90蛋白溶液和化合物储备溶液作为冷冻液体放入手套箱中,并在FP测定缓冲液中制备结合混合物,该缓冲液通过重复的抽空和氩气冲洗循环脱氧。孵育后,将微孔板从手套箱中取出,并立即测量荧光各向异性。有趣的是,BODIPY-AG与Hsp90的结合导致荧光各向异性(FA)和强度的同时增加,而与Grp94的结合使荧光强度的变化相对较小。为每个结合或竞争曲线收集三份数据点。竞争结合曲线由四参数逻辑函数拟合[1]。 17-AAG与Hsp90(配合物)的分离。[1] 使用旋转柱测定法测定1b在细胞裂解物中从纯化的人Hsp90蛋白或Hsp90复合物的解离速率。[烯丙基氨基-3H]-17-AAG(20 Ci/mmol,HPLC纯度≥97%)购自商业。在真空下干燥200μCi(10nmol)的[3H]-17-AAG在乙醇中,并与30nmole的未标记1b在DMSO中混合,得到1mM[3H]-17AAG的储备溶液,SA为3×106−4×106 cpm/nmol。结合反应在测定缓冲液(20mM HEPES−KOH,pH 7.3,1.0mM EDTA,100mM KCl,5.0mM MgCl2,0.01%NP-40,1.0mM新鲜DTT和完全蛋白酶抑制剂)中含有400 nM Hsp90、4.0μM[3H]-17-AAG和0.38 mg/mL BGG。牛γ-球蛋白仅作为纯化的Hsp90蛋白的载体蛋白。或者,使用来自正常人真皮成纤维细胞(NHDF,5.0mg/mL总蛋白)或乳腺癌症细胞系SKBR3(1.5mg/mL)的细胞裂解物(如Kamal等人20所述制备)代替纯化的Hsp90蛋白。在37°C下孵育≥2小时后,将65μL的结合反应依次通过两个Zeba脱盐旋转柱以去除未结合的配体。在解离反应(650μL)中,用未标记的1b稀释含有结合[3H]-17-AAG的脱盐蛋白质溶液,以在测定缓冲液中得到约40 nM Hsp90、40μM 17-AAG和0.48 mg/mL BGG的最终浓度。类似地,用最终浓度为20μM的1b将脱盐的细胞裂解物稀释10倍。未标记的17-AAG以超过Hsp90≥1000倍的量存在,以确保[3H]-17-AAG的解离实际上是不可逆的。在不同的孵育时间(37°C),取出60μL的解离反应,并依次通过两个Zeba旋转柱。在MicroBeta微板闪烁计数器上分析流通部分。离解动力学用单指数函数a=A0×exp-kt+a∞拟合,得到一阶速率常数k。 1. 试剂制备:配制含10 mM MgCl₂、2 mM DTT、0.1 mg/mL BSA的50 mM Tris-HCl缓冲液(pH 7.5);纯化人重组HSP90α(0.3 μg/孔),制备[γ-³²P]-ATP(1 μCi/μL,终浓度5 μM) [1] 2. 反应体系构建:96孔板中加入80 μL缓冲液、10 μL 17-DMAG HCl(0.01-50 nM)或溶剂(0.1% DMSO)、5 μL HSP90α,37℃孵育15 min使药物与HSP90结合 [1] 3. ATP水解启动与终止:加入5 μL [γ-³²P]-ATP启动反应,37℃孵育45 min;加入100 μL 20%三氯乙酸(TCA)终止反应,冰浴20 min [1] 4. 检测与计算:3500×g离心15 min,取100 μL上清转移至活性炭包被板(吸附未水解ATP);5% TCA洗涤3次,烘干后用液体闪烁计数器测定放射性(³²P-磷酸)。HSP90 ATP酶活性=(处理组放射性/对照组放射性)×100%,通过剂量-反应曲线拟合(GraphPad Prism)计算IC50 [1] |
| 细胞实验 |
活力测定。[1]
人癌症细胞系SKBR3和癌症细胞系SKOV3从美国典型培养物保藏中心获得,并在添加有10%热灭活FBS、50单位/mL链霉素和50单位/mL青霉素的RPMI-1640培养基中在37°C和5%CO2中培养。在进行实验之前,用0.05%胰蛋白酶和0.02%EDTA在不含钙和镁的磷酸盐缓冲盐水中解离细胞。 使用重要线粒体功能染色剂Alamar Blue(Biosource International,Camarillo,CA)进行可行性研究。在存在或不存在化合物的情况下,将细胞在96孔板(200μL)中孵育后,加入20μL Alamar Blue溶液,并将板在37°C下孵育4−6小时。在λEx=544 nm和λEm=590 nm处通过荧光监测Alamar Blue信号的减少。 Her2和Hsp70全细胞免疫检测。[1] 对于全细胞免疫检测,将20000个细胞接种到200μL生长培养基中的96孔微量滴定板中,并在37°C下附着在板上过夜。将补充有化合物或载体(DMSO或75 mM柠檬酸盐缓冲液,75 mM抗坏血酸盐,pH 3.0−3.3)的生长培养基加入孔中,并在37°C下再次孵育平板。在不同的孵育时间后,用70μL含有0.1%吐温20(TBST)的冰冷Tris缓冲盐水洗涤细胞两次,并吸出上清液。然后将冰冷的甲醇(50μL)加入每个孔中,并将平板在4°C下孵育10分钟。用TBST(2×100μL)洗涤除去甲醇。将平板进一步与100μL SuperBlock一起孵育,或在室温下孵育1小时,并在4°C下与一级抗体(抗Her2或抗Hsp70,Santa Cruz Biotechnology,Santa克鲁兹,CA)在SuperBlock中以1:200的稀释度孵育过夜。用TBST(2×100μL)洗涤每个孔,并在室温下与辣根过氧化物酶连接的第二抗体(50μL,在SuperBlock中为1:1000,与Hoechst试剂在1:5000下孵育)一起孵育。用TBST(2×100μL)洗涤除去未结合的抗体后,加入化学发光底物溶液(20μL)。5分钟后,通过在Envision微孔板读取器上以发光模式扫描每个孔0.1s来读取板。使用省略了第一抗体的孔的读数作为背景。然后在荧光模式下读取板(λEx=340nm和λEm=460nm)。相对荧光单位(RFU)值用于归一化相对发光单位(RLU)值,以给出每细胞数的发光强度。将从化合物处理的细胞与载体处理的细胞获得的比率绘制为药物浓度的函数,以产生EC50值。 1. 癌细胞增殖与客户蛋白检测实验 1. 细胞接种:A549/MCF-7/PC-3细胞分别接种于96孔板(5×10³细胞/孔)和6孔板(2×10⁵细胞/孔),37℃、5% CO₂孵育24 h [1] 2. 药物处理:更换培养基为含17-DMAG HCl(0.5-50 nM)或溶剂的新鲜培养基。96孔板孵育72 h(增殖实验),6孔板孵育24 h(蛋白实验) [1] 3. 增殖检测(MTT法):向96孔板每孔加入20 μL MTT(5 mg/mL),孵育4 h;吸弃上清,加入150 μL DMSO溶解甲臜结晶,酶标仪测定570 nm处吸光度。细胞活力=(处理组吸光度/对照组吸光度)×100%,通过剂量-反应曲线推导IC50 [1] 4. 客户蛋白Western blot:6孔板细胞用含蛋白酶抑制剂的RIPA缓冲液裂解,4℃下12,000×g离心15 min;每泳道上样30 μg蛋白至10% SDS-PAGE凝胶,电泳后转移至PVDF膜;4℃下与一抗(抗Akt、抗Raf-1、抗HER2、抗GAPDH)孵育过夜,再与HRP标记二抗孵育1 h;ECL显影,ImageJ定量条带强度 [1] ### 2. CLL细胞凋亡与NF-κB检测实验 1. 细胞制备:通过Ficoll-Paque密度梯度离心从患者外周血中分离原代CLL细胞,用含10% FBS的RPMI-1640培养基重悬至1×10⁶细胞/mL [2] 2. 凋亡检测(Annexin V-FITC/PI双染):24孔板中接种1×10⁶细胞/孔,用17-DMAG HCl(5-50 nM)处理48 h;收集细胞,冷PBS洗涤2次,用1×结合缓冲液重悬;加入5 μL Annexin V-FITC和5 μL PI,室温避光孵育15 min;流式细胞仪分析,计算凋亡率(Annexin V⁺/PI⁻早期凋亡 + Annexin V⁺/PI⁺晚期凋亡) [2] 3. NF-κB Western blot:20 nM 17-DMAG HCl处理细胞24 h,用核/浆提取缓冲液裂解细胞,分离核组分与浆组分;分别进行Western blot,一抗为抗NF-κB p65/p50/c-Rel,ImageJ定量条带强度 [2] ### 3. CAFs收缩与运动性检测实验 1. CAFs分离与培养:通过胶原酶消化从人前列腺癌组织中分离CAFs,用含10% FBS的DMEM培养基培养 [3] 2. 收缩实验(胶原凝胶法):将1×10⁵个CAFs与1.5 mg/mL I型胶原凝胶混合,加入24孔板;孵育24 h至凝胶收缩后,加入17-DMAG HCl(10-50 nM);连续3天测量凝胶面积,收缩率=[(初始面积-最终面积)/初始面积]×100% [3] 3. 迁移实验(Transwell法):上室接种5×10⁴个CAFs,加入含17-DMAG HCl(10-50 nM)的培养基;下室加入含10% FBS的培养基作为趋化因子;孵育24 h后,4%多聚甲醛固定下室膜上细胞,0.1%结晶紫染色,显微镜下计数迁移细胞数 [3] 4. α-SMA免疫荧光:盖玻片接种CAFs,30 nM 17-DMAG HCl处理24 h;4%多聚甲醛固定,0.2% Triton X-100透化,5% BSA封闭;4℃下抗α-SMA一抗(1:200)孵育过夜,Alexa Fluor 488标记二抗(1:500)室温孵育1 h;DAPI染核,共聚焦显微镜观察 [3] |
| 动物实验 |
Dissolved in DMSO; 10 mg/kg; i.p. injection
SCID mice engrafted with TCL1 leukemia cells Young male CB-17/IcrHsd-Prkdc-SCID mice, are used. Recombinant xenografts are made by mixing 1×105 BPH1 cells and 2.5×105 CAF per graft in collagen solution, allowed to gel, covered with medium and cultured overnight. Tumors are allowed to form over eight weeks, and then treated for four weeks with three different doses of dipalmitoyl-radicicol (50, 100 and 200 mg/kg) and 17-DMAG (5, 10 and 20 mg/kg) via intraperitoneal injections of compounds in sesame oil every four days. After 12 weeks in total, the mice are sacrificed, their kidneys resected, grafts cut in half and photographed before processing for histology. Graft dimensions are measured and the resultant tumour volume is calculated using the formula; volume=width×length×depth×π/6. This formula represents a conservative approach to evaluate tumour volumes, as it understates the volume of large, invasive tumours compared with smaller, non-invasive tumours. Resected grafts are fixed in 10% formalin, embedded in paraffin and processed for immunohistochemistry[3]. 1. Animal preparation: Male SCID mice (6-8 weeks old, 20-22 g, n=18) were housed under SPF conditions (12 h light/dark cycle, 22±2℃), free access to food and water. Acclimate for 1 week [2] 2. Tumor induction: Primary CLL cells (1×10⁷ cells/mouse) isolated from patients were resuspended in 0.2 mL PBS, injected intraperitoneally into each mouse. Monitor ascites formation daily via abdominal palpation [2] 3. Grouping and treatment: When ascites volume reached ~0.5 mL, randomize mice into 3 groups (n=6/group): - Vehicle group: Intraperitoneal injection of 5% DMSO/PBS once daily for 14 days. - 17-DMAG HCl 10 mg/kg group: Intraperitoneal injection of 17-DMAG HCl (10 mg/kg, dissolved in 5% DMSO/PBS, sonicated to dissolve) once daily for 14 days. - 17-DMAG HCl 20 mg/kg group: Intraperitoneal injection of 17-DMAG HCl (20 mg/kg, same solvent) once daily for 14 days [2] 4. Sample collection and monitoring: - Ascites monitoring: Measure ascites volume by abdominal aspiration every 3 days (sterile procedure). - CLL cell count: Count CLL cells in ascites using a hemocytometer. - Tissue analysis: Euthanize mice on day 14, collect ascites CLL cells for Western blot (NF-κB, Akt) and TUNEL staining; collect liver and kidney for HE staining (toxicity assessment) [2] |
| 毒性/毒理 (Toxicokinetics/TK) |
In vitro toxicity:
- Normal cell selectivity: 17-DMAG HCl had low toxicity to normal human fibroblasts (MRC-5) with IC50=85 nM, ~20-fold higher than cancer cells (A549: 3.5 nM) [1]; IC50 for normal human B cells was 120 nM, ~5-fold higher than CLL cells [2] - No genotoxicity: Negative in Ames test (10-1000 nM 17-DMAG HCl) [1] - In vivo toxicity: - SCID mice: 17-DMAG HCl (20 mg/kg, i.p., 14 days) caused no significant body weight loss (21.8 ± 1.1 g vs. vehicle 22.2 ± 1.0 g) or organ damage. HE staining of liver and kidney showed no hepatocyte necrosis, renal tubular injury, or inflammation [2] - No hematotoxicity: Serum white blood cell (WBC) count (4.5 ± 0.5 × 10⁹/L vs. vehicle 4.8 ± 0.6 × 10⁹/L) and platelet count (250 ± 20 × 10⁹/L vs. 260 ± 15 × 10⁹/L) were within normal ranges [2] |
| 参考文献 |
|
| 其他信息 |
Alvespimycin Hydrochloride is the hydrochloride salt of alvespimycin, an analogue of the antineoplastic benzoquinone antibiotic geldanamycin. Alvespimycin binds to HSP90, a chaperone protein that aids in the assembly, maturation and folding of proteins. Subsequently, the function of Hsp90 is inhibited, leading to the degradation and depletion of its client proteins such as kinases and transcription factors involved with cell cycle regulation and signal transduction.
17-DMAG (Alvespimycin) HCl is a hydroquinone derivative of 17-AAG (Tanespimycin), designed to improve the poor water solubility of 17-AAG (solubility >10 mg/mL vs. <0.1 mg/mL for 17-AAG) while enhancing HSP90 inhibitory potency (IC50=1.2 nM vs. 9.6 nM for 17-AAG) [1] - Mechanism of action: It binds to the ATP-binding pocket of HSP90, disrupting its chaperone function and inducing ubiquitin-dependent degradation of oncogenic client proteins (e.g., Akt, HER2, NF-κB family) and pro-survival proteins (e.g., Bcl-2), thereby inhibiting cancer cell proliferation and inducing apoptosis [1][2] - Therapeutic potential: - In CLL: It selectively targets CLL cells by degrading NF-κB (a key driver of CLL survival), showing efficacy in patient-derived cells and xenograft models, supporting its potential for relapsed/refractory CLL [2] - In prostate cancer: It modulates the tumor microenvironment by inhibiting CAF contractility and motility, reducing CAF-mediated prostate cancer cell proliferation, representing a novel "stromal targeting" strategy [3] |
| 分子式 |
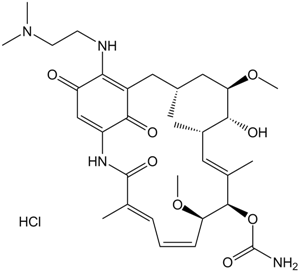
C32H48N4O8.HCL
|
|---|---|
| 分子量 |
653.21
|
| 精确质量 |
652.324
|
| 元素分析 |
C, 58.75; H, 7.40; Cl, 5.42; N, 6.42; O, 22.01
|
| CAS号 |
467214-21-7
|
| 相关CAS号 |
Alvespimycin;467214-20-6
|
| PubChem CID |
9852573
|
| 外观&性状 |
Typically exists as purple to purplish red solids at room temperature
|
| LogP |
3.895
|
| tPSA |
174
|
| 氢键供体(HBD)数目 |
5
|
| 氢键受体(HBA)数目 |
10
|
| 可旋转键数目(RBC) |
8
|
| 重原子数目 |
45
|
| 分子复杂度/Complexity |
1230
|
| 定义原子立体中心数目 |
6
|
| SMILES |
Cl[H].O(C([H])([H])[H])[C@@]1([H])[C@]([H])([C@]([H])(C([H])([H])[H])C([H])=C(C([H])([H])[H])[C@]([H])([C@@]([H])(C([H])=C([H])C([H])=C(C([H])([H])[H])C(N([H])C2=C([H])C(C(=C(C2=O)C([H])([H])[C@@]([H])(C([H])([H])[H])C1([H])[H])N([H])C([H])([H])C([H])([H])N(C([H])([H])[H])C([H])([H])[H])=O)=O)OC([H])([H])[H])OC(N([H])[H])=O)O[H] |c:17,32,t:28|
|
| InChi Key |
BXRBNELYISPBKT-BJGZLATJSA-N
|
| InChi Code |
InChI=1S/C32H47N3O9.ClH/c1-18-14-22-28(38)23(17-24(36)30(22)43-13-12-35(5)6)34-31(39)19(2)10-9-11-25(41-7)29(44-32(33)40)21(4)16-20(3)27(37)26(15-18)42-8;/h9-11,16-18,20,25-27,29,37H,12-15H2,1-8H3,(H2,33,40)(H,34,39);1H/b11-9-,19-10+,21-16+;/t18-,20+,25+,26+,27-,29+;/m1./s1
|
| 化学名 |
(4E,6Z,8S,9S,10E,12S,13R,14S,16R)-19-(2-(dimethylamino)ethoxy)-13-hydroxy-8,14-dimethoxy-4,10,12,16-tetramethyl-3,20,22-trioxo-2-azabicyclo[16.3.1]docosa-1(21),4,6,10,18-pentaen-9-yl carbamate hydrochloride
|
| 别名 |
Alvespimycin; Alvespimycin HCl; Alvespimycin Hydrochloride; NSC 707545; BMS 826476 HCl; KOS 1022; NSC-707545; BMS-826476 HCl; KOS-1022; NSC707545; BMS826476 HCl; KOS1022
|
| HS Tariff Code |
2934.99.9001
|
| 存储方式 |
Powder -20°C 3 years 4°C 2 years In solvent -80°C 6 months -20°C 1 month 注意: 请将本产品存放在密封且受保护的环境中,避免吸湿/受潮。 |
| 运输条件 |
Room temperature (This product is stable at ambient temperature for a few days during ordinary shipping and time spent in Customs)
|
| 溶解度 (体外实验) |
|
|||
|---|---|---|---|---|
| 溶解度 (体内实验) |
配方 1 中的溶解度: ≥ 2.5 mg/mL (3.83 mM) (饱和度未知) in 10% DMSO + 40% PEG300 + 5% Tween80 + 45% Saline (这些助溶剂从左到右依次添加,逐一添加), 澄清溶液。
例如,若需制备1 mL的工作液,可将100 μL 25.0 mg/mL澄清DMSO储备液加入到400 μL PEG300中,混匀;然后向上述溶液中加入50 μL Tween-80,混匀;加入450 μL生理盐水定容至1 mL。 *生理盐水的制备:将 0.9 g 氯化钠溶解在 100 mL ddH₂O中,得到澄清溶液。 配方 2 中的溶解度: ≥ 2.5 mg/mL (3.83 mM) (饱和度未知) in 10% DMSO + 90% (20% SBE-β-CD in Saline) (这些助溶剂从左到右依次添加,逐一添加), 澄清溶液。 例如,若需制备1 mL的工作液,可将 100 μL 25.0 mg/mL澄清DMSO储备液加入900 μL 20% SBE-β-CD生理盐水溶液中,混匀。 *20% SBE-β-CD 生理盐水溶液的制备(4°C,1 周):将 2 g SBE-β-CD 溶解于 10 mL 生理盐水中,得到澄清溶液。 View More
配方 3 中的溶解度: 1% DMSO+30% polyethylene glycol+1% Tween 80: 30 mg/mL 1、请先配制澄清的储备液(如:用DMSO配置50 或 100 mg/mL母液(储备液)); 2、取适量母液,按从左到右的顺序依次添加助溶剂,澄清后再加入下一助溶剂。以 下列配方为例说明 (注意此配方只用于说明,并不一定代表此产品 的实际溶解配方): 10% DMSO → 40% PEG300 → 5% Tween-80 → 45% ddH2O (或 saline); 假设最终工作液的体积为 1 mL, 浓度为5 mg/mL: 取 100 μL 50 mg/mL 的澄清 DMSO 储备液加到 400 μL PEG300 中,混合均匀/澄清;向上述体系中加入50 μL Tween-80,混合均匀/澄清;然后继续加入450 μL ddH2O (或 saline)定容至 1 mL; 3、溶剂前显示的百分比是指该溶剂在最终溶液/工作液中的体积所占比例; 4、 如产品在配制过程中出现沉淀/析出,可通过加热(≤50℃)或超声的方式助溶; 5、为保证最佳实验结果,工作液请现配现用! 6、如不确定怎么将母液配置成体内动物实验的工作液,请查看说明书或联系我们; 7、 以上所有助溶剂都可在 Invivochem.cn网站购买。 |
| 制备储备液 | 1 mg | 5 mg | 10 mg | |
| 1 mM | 1.5309 mL | 7.6545 mL | 15.3090 mL | |
| 5 mM | 0.3062 mL | 1.5309 mL | 3.0618 mL | |
| 10 mM | 0.1531 mL | 0.7655 mL | 1.5309 mL |
1、根据实验需要选择合适的溶剂配制储备液 (母液):对于大多数产品,InvivoChem推荐用DMSO配置母液 (比如:5、10、20mM或者10、20、50 mg/mL浓度),个别水溶性高的产品可直接溶于水。产品在DMSO 、水或其他溶剂中的具体溶解度详见上”溶解度 (体外)”部分;
2、如果您找不到您想要的溶解度信息,或者很难将产品溶解在溶液中,请联系我们;
3、建议使用下列计算器进行相关计算(摩尔浓度计算器、稀释计算器、分子量计算器、重组计算器等);
4、母液配好之后,将其分装到常规用量,并储存在-20°C或-80°C,尽量减少反复冻融循环。
计算结果:
工作液浓度: mg/mL;
DMSO母液配制方法: mg 药物溶于 μL DMSO溶液(母液浓度 mg/mL)。如该浓度超过该批次药物DMSO溶解度,请首先与我们联系。
体内配方配制方法:取 μL DMSO母液,加入 μL PEG300,混匀澄清后加入μL Tween 80,混匀澄清后加入 μL ddH2O,混匀澄清。
(1) 请确保溶液澄清之后,再加入下一种溶剂 (助溶剂) 。可利用涡旋、超声或水浴加热等方法助溶;
(2) 一定要按顺序加入溶剂 (助溶剂) 。
| NCT Number | Recruitment | interventions | Conditions | Sponsor/Collaborators | Start Date | Phases |
| NCT00089271 | Completed | Drug: alvespimycin hydrochloride | Anaplastic Large Cell Lymphoma Angioimmunoblastic T-cell Lymphoma |
National Cancer Institute (NCI) | July 2004 | Phase 1 |
| NCT01126502 | Terminated | Drug: alvespimycin hydrochloride | B-cell Chronic Lymphocytic Leukemia Prolymphocytic Leukemia |
National Cancer Institute (NCI) | May 2010 | Phase 2 |
| NCT00089362 | Completed | Drug: alvespimycin hydrochloride | Male Breast Cancer Recurrent Adenoid Cystic Carcinoma of the Oral Cavity |
National Cancer Institute (NCI) | July 2004 | Phase 1 |
| NCT00088868 | Completed | Drug: alvespimycin hydrochloride | Lymphoma Small Intestine Cancer |
National Institutes of Health Clinical Center (CC) |
June 2004 | Phase 1 |
|
|
|