| 规格 | 价格 | 库存 | 数量 |
|---|---|---|---|
| 10mg |
|
||
| 50mg |
|
||
| 100mg |
|
||
| 250mg |
|
||
| 500mg |
|
||
| 1g |
|
||
| 5g |
|
||
| Other Sizes |
|
| 靶点 |
COX-2; IL-1;βCaspase-3; Caspase-8; Caspase-9
|
|---|---|
| 体外研究 (In Vitro) |
氢溴酸(0-500 μM,24 小时)氧化多巴胺会以浓度依赖性方式降低 Neuro-2a 细胞存活率和 SH-SY5Y 细胞活力 [1]。用氢溴酸(75-150 μM,0-24 小时)氧化多巴胺会刺激 COX-2 的表达。它还促进促炎细胞因子的产生,例如 IL-1β 和 PGE 2 生物合成 [1]。多巴胺(0-150 μM,12 小时)和核转位被氢溴酸氧化 [1]。 p38 的磷酸化是由多巴胺的氢溴酸氧化诱导的(75 μM,0–12 小时)[3]。
|
| 体内研究 (In Vivo) |
黑质多巴胺能神经元的退化是由氢溴酸氧化多巴胺(5μg/2μL,单侧注射到右纹状体)引起的[2]
本研究旨在探讨白藜芦醇对6-羟基多巴胺(6-OHDA)诱导的帕金森病大鼠的神经保护作用。6-OHDA诱导的帕金森病大鼠模型涉及慢性炎症、线粒体功能障碍和氧化应激,黑质多巴胺能神经元的损失是主要损伤。白藜芦醇已被证明具有抗炎作用,因此使用6-OHDA诱导的帕金森病大鼠模型测试了其有益作用。将成年Sprague-Dawley(SD)大鼠单侧向右侧纹状体注射6-OHDA(5微克/2微升),并通过旋转试验、超微组织病理学和分子改变评估纹状体损伤。然后每天给帕金森病大鼠口服白藜芦醇(10、20和40mg/kg),持续10周,以检查其保护作用。轮替试验(大鼠轮替)显示,早在给药两周后,白藜芦醇就显著减弱了6-OHDA损伤的帕金森病大鼠模型中阿扑吗啡诱导的大鼠轮次。超微结构分析表明,白藜芦醇可减轻6-OHDA诱导的大鼠黑质多巴胺能神经元染色质凝聚、线粒体肿胀和空泡化。此外,通过实时RT-PCR检测,白藜芦醇治疗还显著降低了黑质中COX-2和TNF-αmRNA的水平。COX-2蛋白在黑质中的表达也降低,如蛋白质印迹所证明的。这些结果表明,白藜芦醇对6-OHDA诱导的帕金森病大鼠模型具有神经保护作用,这种保护作用与炎症反应的减少有关。[2]. |
| 酶活实验 |
环氧合酶-2(COX-2)主要通过产生激活四种膜受体EP1-EP4的前列腺素E2(PGE2)来触发促炎过程,从而在许多神经疾病中加重神经元变性和功能损伤。然而,哪种EP受体是COX-2/PGE2介导的神经元炎症和变性的罪魁祸首在很大程度上仍不清楚,可能取决于损伤类型和反应成分。在此,我们证明了用神经毒素6-羟基多巴胺(6-OHDA)处理后,COX-2在小鼠Neuro-2a和人SH-SY5Y两种神经元细胞系中被诱导并显示出核移位,导致PGE2的生物合成和促炎细胞因子白细胞介素-1β的上调。抑制COX-2或微粒体前列腺素E合成酶-1抑制了这些细胞中6-OHDA-三重PGE2的产生。用PGE2或EP2选择性激动剂布他前列素而不是EP4激动剂CAY10598处理,增加了两种细胞系中的cAMP反应。PGE2在这些细胞中引发的cAMP产生被我们最近开发的新型选择性EP2拮抗剂TG4-155和TG6-10-1阻断,但没有被EP4选择性拮抗剂GW627368X阻断。6-OHDA驱动的细胞毒性在很大程度上被TG4-155、TG6-10-1或COX-2选择性抑制剂塞来昔布阻断,但没有被GW627368X阻断。我们的结果表明,PGE2受体EP2是6-OHDA处理后Neuro-2a和SH-SY5Y细胞中COX-2活性启动的cAMP信号传导的关键介质,并有助于氧化多巴胺介导的神经毒性[1]。
|
| 细胞实验 |
细胞活力测定[1]
细胞类型: Neuro-2a 细胞和 SH-SY5Y 细胞 测试浓度: 0-500 µM 孵育持续时间:24或48小时 实验结果:以浓度依赖性方式诱导Neuro-2a细胞和SH-SY5Y细胞产生神经毒性对 SY5Y 细胞产生细胞毒性。在 Neuro-2a 细胞中,EC50=111 µM(孵育 24 小时)和 109 µM(孵育 48 小时);在 SH-SY5Y 细胞中,24 小时EC50=118 µM,48 小时EC50=107 µM。 RT-PCR[1] 细胞类型: Neuro-2a 细胞和 SH-SY5Y 细胞 测试浓度: 75 或 150 µM 孵育持续时间:0、6 或 24 小时 实验结果:一次快速、稳健地诱导 COX-2依赖方式。诱导 COX-2 激活,其特征是诱导表达和核转位。培养基中的 PGE2 在 Neuro-2a 细胞 (75 µM) 中显着增加近 5 倍,在 SH-SY5Y 细胞 (150 µM) 中显着增加 3 倍。 Neuro-2a 细胞和 SH-SY5Y 细胞中促炎细胞因子白细胞介素 1β (IL-1β) 显着上调。 细胞凋亡分析 [3] 细胞类型: PC12 细胞 测试浓度: 0、25、50、75 和 150 μM 孵育时间:0、2、4、6、12和20小时 实验结果:诱导PC12细胞凋亡。以时间和浓度依赖性方式增加 PC12 细胞中 caspase-3、-8 和 -9 的活性。这些 caspase 活性在 2-4 小时时增加,并在 12 小时时达到最大值。以时间和浓度依赖性方式减少具有高线粒体膜电位的细胞(JC-1 聚集体)。 蛋白质印迹分析[3] 细胞类型: PC12 细胞 测试浓度: 75 μM 孵育时间:0、3、5、6、8、10和12小时 实验结果:以时间依赖性方式增加p-p38的水平。 |
| 动物实验 |
The present study was undertaken to investigate the neuroprotective effects of resveratrol on 6-hydroxydopamine (6-OHDA)-induced Parkinson's disease in rats. 6-OHDA-induced Parkinson's disease rat model involves chronic inflammation, mitochondrial dysfunction, and oxidative stress, and the loss of the dopaminergic neurons in the substantia nigra is the predominant lesion. Resveratrol has been shown to have anti-inflammatory actions, and thus was tested for its beneficial effects using 6-OHDA-induced Parkinson's disease rat model. Adult Sprague-Dawley (SD) rats were unilaterally injected with 6-OHDA (5 microg/2 microl) into the right striatum, and the striatum damage was assessed by rotational test, ultrahistopathology, and molecular alterations. Resveratrol (10, 20 and 40 mg/kg) was then given orally to Parkinson's disease rats, daily for 10 weeks to examine the protective effects. Rotational test (turns of rats) showed that resveratrol significantly attenuated apomorphine-induced turns of rats in 6-OHDA-injuried Parkinson's disease rat model as early as two weeks of administration. Ultrastructural analysis showed that resveratrol alleviated 6-OHDA-induced chromatin condensation, mitochondrial tumefaction and vacuolization of dopaminergic neurons in rat substantia nigra. Furthermore, resveratrol treatment also significantly decreased the levels of COX-2 and TNF-alpha mRNA in the substantia nigra as detected by real-time RT-PCR. COX-2 protein expression in the substantia nigra was also decreased as evidenced by Western blotting. These results demonstrate that resveratrol exerts a neuroprotective effect on 6-OHDA-induced Parkinson's disease rat model, and this protection is related to the reduced inflammatory reaction.[2].
|
| 参考文献 |
|
| 其他信息 |
A neurotransmitter analogue that depletes noradrenergic stores in nerve endings and induces a reduction of dopamine levels in the brain. Its mechanism of action is related to the production of cytolytic free-radicals.
|
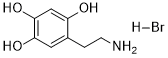
| 分子式 |
C8H12BRNO3
|
|---|---|
| 分子量 |
250.09
|
| 精确质量 |
249
|
| 元素分析 |
C, 38.42; H, 4.84; Br, 31.95; N, 5.60; O, 19.19
|
| CAS号 |
636-00-0
|
| 相关CAS号 |
Oxidopamine hydrochloride;28094-15-7; 1199-18-4; 636-00-0 (HBr)
|
| PubChem CID |
176170
|
| 外观&性状 |
Light brown to gray solid
|
| 沸点 |
406ºC at 760 mmHg
|
| 熔点 |
216-220 °C(lit.)
|
| 闪点 |
199.3ºC
|
| LogP |
1.963
|
| tPSA |
86.71
|
| 氢键供体(HBD)数目 |
5
|
| 氢键受体(HBA)数目 |
4
|
| 可旋转键数目(RBC) |
2
|
| 重原子数目 |
13
|
| 分子复杂度/Complexity |
142
|
| 定义原子立体中心数目 |
0
|
| SMILES |
OC1=CC(CCN)=C(O)C=C1O.[H]Br
|
| InChi Key |
MLACDGUOKDOLGC-UHFFFAOYSA-N
|
| InChi Code |
InChI=1S/C8H11NO3.BrH/c9-2-1-5-3-7(11)8(12)4-6(5)10;/h3-4,10-12H,1-2,9H2;1H
|
| 化学名 |
2,4,5-Trihydroxyphenethylamine hydrobromide
|
| 别名 |
6-Hydroxydopamine hydrobromide; 6-OHDA hydrobromide; 6-OHDA HBr; 6 OHDA HBr; 6OHDA HBr; 6-OHDA Hydrobromide; 6 OHDA Hydrobromide; 6OHDA Hydrobromide; 6-Hydroxydopamine hydrobromide; 636-00-0; Oxidopamine hydrobromide; Oxidopamine (hydrobromide); 6-hydroxydopamine hbr; 6-OHDA; 2,4,5-Trihydroxyphenethylamine hydrobromide; 5-(2-aminoethyl)benzene-1,2,4-triol hydrobromide; 6-Hydroxydopamine Hydrobromide; 6Hydroxydopamine Hydrobromide; 6 Hydroxydopamine Hydrobromide; 6-Hydroxydopamine HBr; 6 Hydroxydopamine HBr
|
| HS Tariff Code |
2934.99.9001
|
| 存储方式 |
Powder -20°C 3 years 4°C 2 years In solvent -80°C 6 months -20°C 1 month 注意: (1). 请将本产品存放在密封且受保护的环境中(例如氮气保护),避免吸湿/受潮。 (2). 该产品在溶液状态不稳定,请现配现用。 |
| 运输条件 |
Room temperature (This product is stable at ambient temperature for a few days during ordinary shipping and time spent in Customs)
|
| 溶解度 (体外实验) |
DMSO : ~50 mg/mL (~199.93 mM)
H2O : ~20 mg/mL (~79.97 mM) |
|---|---|
| 溶解度 (体内实验) |
配方 1 中的溶解度: ≥ 2.5 mg/mL (10.00 mM) (饱和度未知) in 10% DMSO + 40% PEG300 + 5% Tween80 + 45% Saline (这些助溶剂从左到右依次添加,逐一添加), 澄清溶液。
例如,若需制备1 mL的工作液,可将100 μL 25.0 mg/mL澄清DMSO储备液加入到400 μL PEG300中,混匀;然后向上述溶液中加入50 μL Tween-80,混匀;加入450 μL生理盐水定容至1 mL。 *生理盐水的制备:将 0.9 g 氯化钠溶解在 100 mL ddH₂O中,得到澄清溶液。 配方 2 中的溶解度: ≥ 2.08 mg/mL (8.32 mM) (饱和度未知) in 10% DMSO + 90% (20% SBE-β-CD in Saline) (这些助溶剂从左到右依次添加,逐一添加), 澄清溶液。 例如,若需制备1 mL的工作液,可将 100 μL 20.8 mg/mL澄清DMSO储备液加入900 μL 20% SBE-β-CD生理盐水溶液中,混匀。 *20% SBE-β-CD 生理盐水溶液的制备(4°C,1 周):将 2 g SBE-β-CD 溶解于 10 mL 生理盐水中,得到澄清溶液。 View More
配方 3 中的溶解度: 50 mg/mL (199.93 mM) in PBS (这些助溶剂从左到右依次添加,逐一添加), 澄清溶液; 超声助溶. 1、请先配制澄清的储备液(如:用DMSO配置50 或 100 mg/mL母液(储备液)); 2、取适量母液,按从左到右的顺序依次添加助溶剂,澄清后再加入下一助溶剂。以 下列配方为例说明 (注意此配方只用于说明,并不一定代表此产品 的实际溶解配方): 10% DMSO → 40% PEG300 → 5% Tween-80 → 45% ddH2O (或 saline); 假设最终工作液的体积为 1 mL, 浓度为5 mg/mL: 取 100 μL 50 mg/mL 的澄清 DMSO 储备液加到 400 μL PEG300 中,混合均匀/澄清;向上述体系中加入50 μL Tween-80,混合均匀/澄清;然后继续加入450 μL ddH2O (或 saline)定容至 1 mL; 3、溶剂前显示的百分比是指该溶剂在最终溶液/工作液中的体积所占比例; 4、 如产品在配制过程中出现沉淀/析出,可通过加热(≤50℃)或超声的方式助溶; 5、为保证最佳实验结果,工作液请现配现用! 6、如不确定怎么将母液配置成体内动物实验的工作液,请查看说明书或联系我们; 7、 以上所有助溶剂都可在 Invivochem.cn网站购买。 |
| 制备储备液 | 1 mg | 5 mg | 10 mg | |
| 1 mM | 3.9986 mL | 19.9928 mL | 39.9856 mL | |
| 5 mM | 0.7997 mL | 3.9986 mL | 7.9971 mL | |
| 10 mM | 0.3999 mL | 1.9993 mL | 3.9986 mL |
1、根据实验需要选择合适的溶剂配制储备液 (母液):对于大多数产品,InvivoChem推荐用DMSO配置母液 (比如:5、10、20mM或者10、20、50 mg/mL浓度),个别水溶性高的产品可直接溶于水。产品在DMSO 、水或其他溶剂中的具体溶解度详见上”溶解度 (体外)”部分;
2、如果您找不到您想要的溶解度信息,或者很难将产品溶解在溶液中,请联系我们;
3、建议使用下列计算器进行相关计算(摩尔浓度计算器、稀释计算器、分子量计算器、重组计算器等);
4、母液配好之后,将其分装到常规用量,并储存在-20°C或-80°C,尽量减少反复冻融循环。
计算结果:
工作液浓度: mg/mL;
DMSO母液配制方法: mg 药物溶于 μL DMSO溶液(母液浓度 mg/mL)。如该浓度超过该批次药物DMSO溶解度,请首先与我们联系。
体内配方配制方法:取 μL DMSO母液,加入 μL PEG300,混匀澄清后加入μL Tween 80,混匀澄清后加入 μL ddH2O,混匀澄清。
(1) 请确保溶液澄清之后,再加入下一种溶剂 (助溶剂) 。可利用涡旋、超声或水浴加热等方法助溶;
(2) 一定要按顺序加入溶剂 (助溶剂) 。