| 规格 | 价格 | 库存 | 数量 |
|---|---|---|---|
| 5mg |
|
||
| 10mg |
|
||
| 25mg |
|
||
| 50mg |
|
||
| 100mg |
|
||
| 250mg |
|
||
| 500mg |
|
||
| Other Sizes |
| 靶点 |
p97( IC50 = 1.5 μM ); Vps4( IC50 = 11.5 μM )
DBeQ (JRF 12) specifically targets ATPase VCP/p97 (IC50 = 2.1 μM for ATPase activity inhibition) [1] |
||
|---|---|---|---|
| 体外研究 (In Vitro) |
DBeQ 在 HeLa 细胞中阻断 UbG76V-GFP、ODD-Luc 和 Luc-ODC 降解,IC50 分别为 2.6 μM、56 μM 和 45 μM。 DBeQ 对 N-乙基马来酰亚胺敏感因子 (NSF) 和 26S 蛋白酶体的效力至少低 50 倍。 DBeQ 相对于 ATP 竞争性抑制 p97,Ki 为 3.2 μM,表明它与 D2 结构域的活性位点结合。 DBeQ (10 μM) 有效阻止 HEK293 细胞中 TCRα-GFP 的降解。 DBeQ 在 3 小时内以浓度依赖性方式诱导 CHOP,但不会增加 HEK293 细胞中的 p21 水平。 DBeQ (15 μM) 会诱导 Hela 细胞中 LC3-II 在细胞核以及膜富集部分和胞浆部分中大量积累。 DBeQ 通过阻断 LC3-II 的自噬降解而不是诱导 HeLa 细胞自噬发挥作用。 DBeQ (10 μM) 快速促进 HeLa 细胞中“刽子手”caspases-3 和 -7 的激活。 DBeQ 比外在 caspase-8 途径更多地激活内在 caspase-9 凋亡途径,而 STS 激活这两种途径的程度相似。 DBeQ 对多发性骨髓瘤 (RPMI8226) 细胞的活性是正常人胎肺成纤维细胞 (MRC5) 的五倍,其中 HeLa 和 Hek293 细胞表现出中等敏感性。 DBeQ 在稳定 HeLa 细胞中 p97 依赖性与独立 UPS 报告基因底物方面表现出 20 倍的选择性。 DBeQ 会损害 ERAD 和自噬途径内底物的降解。 DBeQ (12 μM) 在 HeLa 细胞中以剂量依赖性方式抑制细胞内中和。 DBeQ (10 μM) 在衣壳命运实验中完全抑制病毒和抗体的降解,但无法阻止 IgG Fc 的降解。 DBeQ (9 μM) 可降低中和的初始梯度,作为抗体浓度的函数。 DBeQ 降低 MTOR 靶点的基础磷酸化和营养刺激的磷酸化,类似于雷帕霉素在 U20S 细胞中的作用。激酶测定:将测定缓冲液 [20 μL 2.5× 浓度,其中 1× = 50 mM Tris (pH 7.4)、20 mM MgCl2、1 mM EDTA 和 0.5 mM 三(2-羧乙基)膦 (TCEP)] 分配到96 孔板的每个孔。将纯化的 p97(25 μL,50 μM)稀释在 975 μL 1× 检测缓冲液中,并在每个孔中分配 10 μL。然后将 DBeQ (10 μL) 或 5% DMSO (10 μL) 添加到每个孔中,并将板在室温下孵育 10 分钟。 ATPase 检测方法如下:向每个孔中添加 10 μL 500 μM ATP (pH 7.5),在室温下孵育 60 分钟,然后添加 50 μL Kinase Glo Plus 试剂,最后在室温下孵育 10 分钟。黑暗中的温度。在Analyst AD 上读取发光。 DBeQ 在一系列浓度(0、0.048、0.24、1.2、6 和 30 μM)下进行三次重复测定。细胞测定:将细胞(MRC-5、Hek293、HeLa 和 RPMI8226 细胞)接种到 384 孔实心白色板(5,000 个细胞/孔)上。用荧光素酶 siRNA 或 p97 siRNA (10 nM) 转染细胞 48 小时,或用 DBeQ 处理指定的时间。将 Caspase-3/7 Glo、caspase-6 Glo、caspase-8 Glo 或 caspase-9 Glo 添加到每个孔中,并通过以 500 rpm 摇动 1 分钟进行混合。室温孵育1小时后测定发光信号。使用 CellTiter-Glo 试剂测定细胞活力。为了确定细胞活力的 IC50,将细胞用 7 个浓度的 MG132 或 DBeQ(从 33 μM 开始进行三倍系列稀释)处理 48 小时。 IC50 值是通过拟合标准化为 DMSO 处理细胞的发光信号百分比来计算的。
在重组人VCP/p97 ATP酶实验中,DBeQ (JRF 12) 抑制ATP水解的IC50为2.1 μM,是一种可逆性抑制剂。在浓度高达20 μM时,它对其他ATP酶(如Hsp70、Hsp90、蛋白酶体ATP酶)无显著抑制作用 [1] - 在一组人癌细胞系(HeLa、U2OS、HCT116、A549、MDA-MB-231)中,DBeQ (JRF 12) 表现出抗增殖活性,IC50值范围为0.5-5 μM。处理72小时后,2 μM浓度使不同细胞系的细胞活力降低45-65% [1] - 在HeLa细胞中,DBeQ (JRF 12)(2 μM)处理24小时后,多聚泛素化蛋白积累(较对照组增加3.1倍),内质网应激标志物(CHOP和BIP蛋白水平分别增加2.8倍和2.3倍),表明VCP/p97依赖的蛋白降解通路被破坏 [1] - 在U2OS细胞中,DBeQ (JRF 12)(1.5 μM)处理18小时后抑制自噬流,表现为LC3-II积累(较对照组增加2.5倍)和p62/SQSTM1水平升高2.1倍 [3] - 在HCT116结肠癌细胞中,DBeQ (JRF 12)(3 μM)处理48小时后诱导凋亡,膜联蛋白V阳性细胞比例从对照组的4%升至32%,胱天蛋白酶-3/7活性提高2.6倍 [1] |
||
| 酶活实验 |
将检测缓冲液放入 96 孔板的每个孔中。它含有 20 μL 2.5× 浓度,其中 1× = 50 mM Tris (pH 7.4)、20 mM MgCl22、1 mM EDTA 和 0.5 mM 三(2-羧乙基)膦 (TCEP) )。将 10 μL 纯化的 p97(25 μL,50 μM)用 975 μL 1× Assay Buffer 稀释后添加到每个孔中。向每个孔中添加 10 μL DBeQ 或 5% DMSO 后,将板在室温下孵育 10 分钟。 ATPase 测定需要向每个孔中加入 10 μL 500 μM ATP (pH 7.5),使其在室温下静置 60 分钟,然后添加 50 μL 激酶 Glo Plus 试剂。最后,将其在黑暗中于室温下静置 10 分钟。分析师 AD 读取光度。一式三份,以以下浓度测定 DBeQ:0、0.048、0.24、1.2、6 和 30 μM。
纯化重组人VCP/p97蛋白,与 DBeQ (JRF 12)(0.1 μM-20 μM)和ATP(2 mM)在实验缓冲液中于37°C孵育90分钟。使用比色法定量无机磷酸盐(Pi)的释放量,从ATP水解抑制的剂量-效应曲线计算IC50值 [1] - 选择性评估实验中,将重组Hsp70、Hsp90及蛋白酶体ATP酶与各自底物和 DBeQ (JRF 12)(0.1 μM-20 μM)在最适反应条件下孵育。测量ATP酶活性并确定IC50值,以评估交叉反应性 [1] |
||
| 细胞实验 |
使用实心白色 384 孔板进行细胞接种,每孔 5,000 个细胞。对细胞应用指定的 DBeQ 处理持续时间或 48 小时的荧光素酶或 p97 siRNA (10 nM) 转染。使用 500 rpm 振荡一分钟来混合 caspase-3/7 Glo、caspase-6 Glo、caspase-8 Glo 或 caspase-9 Glo。在室温下孵育一小时后,测量光度信号。通过使用 CellTiter-Glo 试剂,评估细胞活力。在 48 小时的持续时间内,将细胞置于七种浓度的 MG132 或 DBeQ(从 33 μM 开始的三倍连续稀释)中,以确定细胞的半衰期。计算 IC50 值的方法是计算经 DMSO 处理的细胞标准化的发光信号百分比。
抗增殖实验:将癌细胞系(HeLa、U2OS、HCT116、A549、MDA-MB-231)以4×10³个/孔接种到96孔板中,培养24小时。加入浓度为0.1 μM-20 μM的 DBeQ (JRF 12),孵育72小时。MTT法评估细胞活力,推导IC50值 [1] - 蛋白降解和内质网应激实验:用 DBeQ (JRF 12)(2 μM)处理HeLa细胞24小时。裂解细胞后,通过特异性抗体Western blot分析多聚泛素化蛋白、CHOP和BIP水平 [1] - 自噬实验:用 DBeQ (JRF 12)(1.5 μM)处理U2OS细胞18小时。Western blot检测LC3-II和p62/SQSTM1水平,通过比较有无氯喹存在时LC3-II的积累情况确认自噬流 [3] - 凋亡实验:将HCT116细胞以2.5×10⁵个/孔接种到6孔板中,用 DBeQ (JRF 12)(3 μM)处理48小时。膜联蛋白V-FITC/PI染色后流式细胞术分析凋亡细胞,荧光素酶试剂盒检测胱天蛋白酶-3/7活性 [1] |
||
| 动物实验 |
|
||
| 毒性/毒理 (Toxicokinetics/TK) |
In vitro, DBeQ (JRF 12) showed reduced toxicity to normal human fibroblasts (IC50 > 20 μM), indicating a therapeutic window between cancer cells and normal cells [1]
- At concentrations up to 5 μM, DBeQ (JRF 12) did not cause significant necrosis in cancer cells, as confirmed by PI exclusion assay [1] |
||
| 参考文献 | |||
| 其他信息 |
DBeQ (JRF 12) is a potent, selective, reversible inhibitor of VCP/p97 ATPase, a key regulator of protein homeostasis involved in ER-associated degradation (ERAD), autophagy, and ubiquitin-proteasome system (UPS) [1]
- Its mechanism of action involves binding to the ATPase domain of VCP/p97, inhibiting ATP hydrolysis, and blocking downstream protein processing, leading to accumulation of misfolded proteins, ER stress, and cancer cell apoptosis [1] - DBeQ (JRF 12) serves as a tool compound for studying VCP/p97 function and validating VCP/p97 as a therapeutic target for cancer [1][3] - The compound does not covalently modify VCP/p97, distinguishing it from covalent VCP/p97 inhibitors [1] |
| 分子式 |
C22H20N4
|
|
|---|---|---|
| 分子量 |
340.42
|
|
| 精确质量 |
340.168
|
|
| 元素分析 |
C, 77.62; H, 5.92; N, 16.46
|
|
| CAS号 |
177355-84-9
|
|
| 相关CAS号 |
|
|
| PubChem CID |
676352
|
|
| 外观&性状 |
White to off-white solid powder
|
|
| 密度 |
1.3±0.1 g/cm3
|
|
| 沸点 |
573.1±52.0 °C at 760 mmHg
|
|
| 熔点 |
149 °C
|
|
| 闪点 |
300.4±30.7 °C
|
|
| 蒸汽压 |
0.0±1.6 mmHg at 25°C
|
|
| 折射率 |
1.735
|
|
| LogP |
4.34
|
|
| tPSA |
56.3
|
|
| 氢键供体(HBD)数目 |
2
|
|
| 氢键受体(HBA)数目 |
4
|
|
| 可旋转键数目(RBC) |
6
|
|
| 重原子数目 |
26
|
|
| 分子复杂度/Complexity |
403
|
|
| 定义原子立体中心数目 |
0
|
|
| SMILES |
N([H])(C([H])([H])C1C([H])=C([H])C([H])=C([H])C=1[H])C1C2=C([H])C([H])=C([H])C([H])=C2N=C(N=1)N([H])C([H])([H])C1C([H])=C([H])C([H])=C([H])C=1[H]
|
|
| InChi Key |
QAIMUUJJAJBPCL-UHFFFAOYSA-N
|
|
| InChi Code |
InChI=1S/C22H20N4/c1-3-9-17(10-4-1)15-23-21-19-13-7-8-14-20(19)25-22(26-21)24-16-18-11-5-2-6-12-18/h1-14H,15-16H2,(H2,23,24,25,26)
|
|
| 化学名 |
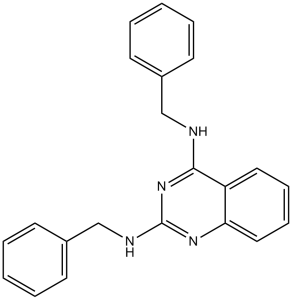
2-N,4-N-dibenzylquinazoline-2,4-diamine
|
|
| 别名 |
DBeQ; DBEQ; JRF12; JRF-12; JRF 12.
|
|
| HS Tariff Code |
2934.99.9001
|
|
| 存储方式 |
Powder -20°C 3 years 4°C 2 years In solvent -80°C 6 months -20°C 1 month |
|
| 运输条件 |
Room temperature (This product is stable at ambient temperature for a few days during ordinary shipping and time spent in Customs)
|
| 溶解度 (体外实验) |
DMSO : 35.71~68 mg/mL ( 104.9~199.8 mM )
Ethanol : ~5 mg/mL |
|---|---|
| 溶解度 (体内实验) |
配方 1 中的溶解度: ≥ 2.5 mg/mL (7.34 mM) (饱和度未知) in 10% DMSO + 40% PEG300 + 5% Tween80 + 45% Saline (这些助溶剂从左到右依次添加,逐一添加), 澄清溶液。
例如,若需制备1 mL的工作液,可将100 μL 25.0 mg/mL澄清DMSO储备液加入到400 μL PEG300中,混匀;然后向上述溶液中加入50 μL Tween-80,混匀;加入450 μL生理盐水定容至1 mL。 *生理盐水的制备:将 0.9 g 氯化钠溶解在 100 mL ddH₂O中,得到澄清溶液。 配方 2 中的溶解度: ≥ 2.5 mg/mL (7.34 mM) (饱和度未知) in 10% DMSO + 90% Corn Oil (这些助溶剂从左到右依次添加,逐一添加), 澄清溶液。 例如,若需制备1 mL的工作液,可将 100 μL 25.0 mg/mL 澄清 DMSO 储备液加入到 900 μL 玉米油中并混合均匀。 请根据您的实验动物和给药方式选择适当的溶解配方/方案: 1、请先配制澄清的储备液(如:用DMSO配置50 或 100 mg/mL母液(储备液)); 2、取适量母液,按从左到右的顺序依次添加助溶剂,澄清后再加入下一助溶剂。以 下列配方为例说明 (注意此配方只用于说明,并不一定代表此产品 的实际溶解配方): 10% DMSO → 40% PEG300 → 5% Tween-80 → 45% ddH2O (或 saline); 假设最终工作液的体积为 1 mL, 浓度为5 mg/mL: 取 100 μL 50 mg/mL 的澄清 DMSO 储备液加到 400 μL PEG300 中,混合均匀/澄清;向上述体系中加入50 μL Tween-80,混合均匀/澄清;然后继续加入450 μL ddH2O (或 saline)定容至 1 mL; 3、溶剂前显示的百分比是指该溶剂在最终溶液/工作液中的体积所占比例; 4、 如产品在配制过程中出现沉淀/析出,可通过加热(≤50℃)或超声的方式助溶; 5、为保证最佳实验结果,工作液请现配现用! 6、如不确定怎么将母液配置成体内动物实验的工作液,请查看说明书或联系我们; 7、 以上所有助溶剂都可在 Invivochem.cn网站购买。 |
| 制备储备液 | 1 mg | 5 mg | 10 mg | |
| 1 mM | 2.9375 mL | 14.6877 mL | 29.3755 mL | |
| 5 mM | 0.5875 mL | 2.9375 mL | 5.8751 mL | |
| 10 mM | 0.2938 mL | 1.4688 mL | 2.9375 mL |
1、根据实验需要选择合适的溶剂配制储备液 (母液):对于大多数产品,InvivoChem推荐用DMSO配置母液 (比如:5、10、20mM或者10、20、50 mg/mL浓度),个别水溶性高的产品可直接溶于水。产品在DMSO 、水或其他溶剂中的具体溶解度详见上”溶解度 (体外)”部分;
2、如果您找不到您想要的溶解度信息,或者很难将产品溶解在溶液中,请联系我们;
3、建议使用下列计算器进行相关计算(摩尔浓度计算器、稀释计算器、分子量计算器、重组计算器等);
4、母液配好之后,将其分装到常规用量,并储存在-20°C或-80°C,尽量减少反复冻融循环。
计算结果:
工作液浓度: mg/mL;
DMSO母液配制方法: mg 药物溶于 μL DMSO溶液(母液浓度 mg/mL)。如该浓度超过该批次药物DMSO溶解度,请首先与我们联系。
体内配方配制方法:取 μL DMSO母液,加入 μL PEG300,混匀澄清后加入μL Tween 80,混匀澄清后加入 μL ddH2O,混匀澄清。
(1) 请确保溶液澄清之后,再加入下一种溶剂 (助溶剂) 。可利用涡旋、超声或水浴加热等方法助溶;
(2) 一定要按顺序加入溶剂 (助溶剂) 。
|
|
|
|
|
|