| 规格 | 价格 | 库存 | 数量 |
|---|---|---|---|
| 10 mM * 1 mL in DMSO |
|
||
| 1mg |
|
||
| 5mg |
|
||
| 10mg |
|
||
| 25mg |
|
||
| 50mg |
|
||
| 100mg |
|
||
| 250mg |
|
||
| 500mg |
|
||
| Other Sizes |
|
| 靶点 |
USP4(EC50= 3.93 μM);USP8(EC50= 4.9 μM);USP7(EC50= 6.86 μM);USP2(EC50= 7.2 μM);USP5(EC50= 8.61 μM)
|
||
|---|---|---|---|
| 体外研究 (In Vitro) |
体外活性:PR-619是一种细胞渗透性吡啶胺类广谱DUB抑制剂,已知靶点包括ATXN3、BAP1、JOSD2、OTUD5、UCH-L1、UCH-L3、UCH-L5/UCH37、USP1、2、4 、5、7、8、9X、10、14、15、16、19、20、22、24、28、47、48、VCIP135、YOD1,以及 deISGylase PLpro、deNEDDylase DEN1 和 deSUMOlyase SENP6。 PR-619 显示以剂量和时间依赖性方式(20 至 150 μM,0.5 至 20 小时)增加 HEK293T 细胞中总体蛋白质多泛素化。 PR619 处理导致 K 48 和 K63 连接的多聚泛素链上调。 PR-619 诱导 HCT116 细胞死亡,EC50 值为 6.3 μM。激酶测定:将重组酶置于 20 mM Tris-HCl(pH 8.0)、2 mM CaCl2 和 2 mM β-巯基乙醇(DUB 测定缓冲液)中,与单剂量或剂量范围的 PR-619 或 P22077 在 96 孔中预孵育 30 分钟添加 Ub-PLA2 和 NBD C6-HPC 之前的板。在室温下使用荧光板读数器监测测定线性范围内荧光产物的释放。载体 (2%(v/v) DMSO) 和 10 mM N-乙基马来酰亚胺作为对照。当观察到 ≥60% 的抑制时,使用 S 形剂量反应方程确定 EC50 值。细胞测定:72小时后,将在磷酸盐缓冲盐水中制备的0.2mg/mL刃天青添加到每个孔中,并将细胞再孵育3-6小时。使用荧光计上的 Ex=535 nm 和 Em=590 nm 滤光片测量刃天青还原产物的荧光。 EC50 值在 Prism 中计算。
PR-619 是一种细胞可透过性广谱去泛素化酶(DBUs)抑制剂。PR-619 在不直接影响蛋白酶体活性的情况下,诱导细胞中多泛素化蛋白质的积聚。 |
||
| 体内研究 (In Vivo) |
PR-619(10 mg/kg/天)在顺铂未耐受和顺铂耐药的 UC 异种移植裸鼠中增强了顺铂的抗肿瘤作用[2]。
PR-619增强了顺铂对裸鼠顺铂钠和顺铂耐药UC异种移植物的抗肿瘤作用[2] 研究人员使用异种移植物小鼠模型评估了顺铂、PR-619治疗或顺铂和PR-619联合治疗的体内抗肿瘤作用。T24和BFTC-905UC细胞与Matrigel混合,皮下注射到裸鼠的侧翼。正如我们在“方法”一节中所述,根据不同的治疗方法,将小鼠分为四组:DMSO(对照组,n=5)、顺铂(n=5),PR-619(10mg/kg/天,n=5。与单药(顺铂或PR-619)治疗相比,顺铂和PR-619的联合治疗对T24和BFTC-905的异种移植物肿瘤显示出最显著的抗肿瘤作用(图6A,B)。除了提高化疗疗效的药物联合治疗外,一种规避顺铂耐药性的新型药物为这一临床未解决的问题提供了其他解决方案。我们进一步研究了PR-619对顺铂耐药UC(T24/R)的体外和体内抗肿瘤作用。PR-619在处理24小时后以剂量依赖的方式诱导细胞毒性和凋亡。使用异种移植物小鼠模型显示的体内数据显示,PR-619(10mg/kg/天)在28天的治疗期间抑制了肿瘤生长。 |
||
| 酶活实验 |
将重组酶置于 20 mM Tris-HCl、pH 8.0、2 mM CaCl2 和 2 mM β-巯基乙醇(DUB 检测缓冲液)中,与单剂量或剂量范围的PR-619或 P22077 在 96 孔板中预孵育 30 分钟,然后再进行实验。添加 Ub-PLA2 和 NBD C6-HPC。在室温下使用荧光板读数器监测测定线性范围内荧光产物的释放。载体 (2%(v/v) DMSO) 和 10 mM N-乙基马来酰亚胺作为对照。当观察到 ≥60% 的抑制时,使用 S 形剂量反应方程确定 EC50 值。
KCa3.1质膜降解速率的测定[3] 测定了内吞膜KCa3.1的降解速率。简而言之,极化MDCK、Caco-2或FRT细胞中的KCa3.1使用BirA进行特异性生物素化,并用非共轭链霉抗生物素蛋白标记,然后将细胞在37°C下孵育不同时间,如图所示。在某些实验中,在37°C孵育步骤之前,将溶酶体蛋白酶抑制剂亮肽(100μM)和蛋白胨(1μg/ml;Leu/Pep)、蛋白酶体抑制剂乳胱氨酸(10μM)或通用去泛素酶(DUB)抑制剂PR-619(50μM)添加到顶膜和BL膜中。然后裂解细胞,通过SDS-PAGE分离等量的总蛋白,然后通过IB分离链霉抗生物素蛋白。使用ImageJ软件通过密度测定对条带进行定量。将获得的各个时间点的带强度相对于时间0(T=0)的强度进行归一化,并进行报告。还检测了印迹中的α-微管蛋白和β-肌动蛋白作为蛋白质负载对照。 |
||
| 细胞实验 |
PR-619和顺铂的联合作用[2]
使用CalcuSyn软件确定PR-619和顺铂的联合作用。以1:2的比例用PR-619和顺铂治疗评估联合效果。如前所述,对中值效应和组合指数(CI)进行了分析。CI值小于1、等于1和大于1分别被定义为协同、相加和拮抗。 细胞凋亡检测[2] 根据制造商的方案,使用Muse®膜联蛋白V和死细胞检测试剂盒进行凋亡检测。然后,使用Muse®细胞分析仪并配备Muse分析软件(版本1.6.0.0)对染色的凋亡细胞进行检查和定量。 流式细胞术细胞周期分析[2] 接种细胞直至达到40%融合。然后用DMSO(对照)或PR-169处理细胞24小时。将细胞置于Muse®细胞周期分析试剂盒中,使用Muse®Cell Analyzer进行细胞周期分析,并配备Muse analysis软件。 72小时后,将0.2 mg/mL在磷酸盐缓冲盐水中制备的刃天青加入每个孔中,并将细胞再孵育3-6小时。使用荧光计上的Ex=535 nm和Em=590 nm滤光片测量刃天青还原产物的荧光。EC50值用Prism计算。 |
||
| 动物实验 |
|
||
| 参考文献 | |||
| 其他信息 |
PR-619 has been used for:
1) As a component of lysis buffer and as a deubiquitinase inhibitor for processing proteins derived from SILAC labeled Jurkat cells. 2) As a deubiquitinase inhibitor for studying its effect on adeno-associated virus (AAV) transduction. 3) Radioimmunoprecipitation assay buffer (RIPA) for ubiquitination detection. Converting lead compounds into drug candidates is a crucial step in drug development, requiring early assessment of potency, selectivity, and off-target effects. We have utilized activity-based chemical proteomics to determine the potency and selectivity of deubiquitylating enzyme (DUB) inhibitors in cell culture models. Importantly, we characterized the small molecule PR-619 as a broad-range DUB inhibitor, and P22077 as a USP7 inhibitor with potential for further development as a chemotherapeutic agent in cancer therapy. A striking accumulation of polyubiquitylated proteins was observed after both selective and general inhibition of cellular DUB activity without direct impairment of proteasomal proteolysis. The repertoire of ubiquitylated substrates was analyzed by tandem mass spectrometry, identifying distinct subsets for general or specific inhibition of DUBs. This enabled identification of previously unknown functional links between USP7 and enzymes involved in DNA repair.[1] After chemotherapy for the treatment of metastatic bladder urothelial carcinoma (UC), most patients inevitably encounter drug resistance and resultant treatment failure. Deubiquitinating enzymes (DUBs) remove ubiquitin from target proteins and play a critical role in maintaining protein homeostasis. This study investigated the antitumor effect of PR-619, a DUBs inhibitor, in combination with cisplatin, for bladder UC treatment. Our results showed that PR-619 effectively induced dose- and time-dependent cytotoxicity, apoptosis, and ER-stress related apoptosis in human UC (T24 and BFTC-905) cells. Additionally, co-treatment of PR-619 with cisplatin potentiated cisplatin-induced cytotoxicity in UC cells and was accompanied by the concurrent suppression of Bcl-2. We also proved that Bcl-2 overexpression is related to the chemo-resistant status in patients with metastatic UC by immunohistochemistry (IHC) staining. In a xenograft mice model, we confirmed that PR-619 enhanced the antitumor effect of cisplatin on cisplatin-naïve and cisplatin-resistant UCs. Our results demonstrated that PR-619 effectively enhanced the cisplatin-induced antitumor effect via concurrent suppression of the Bcl-2 level. These findings provide promising insight for developing a therapeutic strategy for UC treatment.[2] The intermediate conductance, Ca2+-activated K+ channel (KCa3.1) targets to the basolateral (BL) membrane in polarized epithelia where it plays a key role in transepithelial ion transport. However, there are no studies defining the anterograde and retrograde trafficking of KCa3.1 in polarized epithelia. Herein, we utilize Biotin Ligase Acceptor Peptide (BLAP)-tagged KCa3.1 to address these trafficking steps in polarized epithelia, using MDCK, Caco-2 and FRT cells. We demonstrate that KCa3.1 is exclusively targeted to the BL membrane in these cells when grown on filter supports. Following endocytosis, KCa3.1 degradation is prevented by inhibition of lysosomal/proteosomal pathways. Further, the ubiquitylation of KCa3.1 is increased following endocytosis from the BL membrane and PR-619, a deubiquitylase inhibitor, prevents degradation, indicating KCa3.1 is targeted for degradation by ubiquitylation. We demonstrate that KCa3.1 is targeted to the BL membrane in polarized LLC-PK1 cells which lack the μ1B subunit of the AP-1 complex, indicating BL targeting of KCa3.1 is independent of μ1B. As Rabs 1, 2, 6 and 8 play roles in ER/Golgi exit and trafficking of proteins to the BL membrane, we evaluated the role of these Rabs in the trafficking of KCa3.1. In the presence of dominant negative Rab1 or Rab8, KCa3.1 cell surface expression was significantly reduced, whereas Rabs 2 and 6 had no effect. We also co-immunoprecipitated KCa3.1 with both Rab1 and Rab8. These results suggest these Rabs are necessary for the anterograde trafficking of KCa3.1. Finally, we determined whether KCa3.1 traffics directly to the BL membrane or through recycling endosomes in MDCK cells. For these studies, we used either recycling endosome ablation or dominant negative RME-1 constructs and determined that KCa3.1 is trafficked directly to the BL membrane rather than via recycling endosomes. These results are the first to describe the anterograde and retrograde trafficking of KCa3.1 in polarized epithelia cells.[3] |
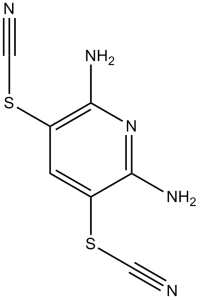
| 分子式 |
C7H5N5S2
|
|
|---|---|---|
| 分子量 |
223.28
|
|
| 精确质量 |
222.998
|
|
| 元素分析 |
C, 37.66; H, 2.26; N, 31.37; S, 28.72
|
|
| CAS号 |
2645-32-1
|
|
| 相关CAS号 |
|
|
| PubChem CID |
2817763
|
|
| 外观&性状 |
Dark mustard yellow fluffy powder
|
|
| 密度 |
1.6±0.1 g/cm3
|
|
| 沸点 |
406.0±45.0 °C at 760 mmHg
|
|
| 熔点 |
210℃
|
|
| 闪点 |
199.3±28.7 °C
|
|
| 蒸汽压 |
0.0±0.9 mmHg at 25°C
|
|
| 折射率 |
1.764
|
|
| LogP |
2.05
|
|
| tPSA |
163.84
|
|
| 氢键供体(HBD)数目 |
2
|
|
| 氢键受体(HBA)数目 |
7
|
|
| 可旋转键数目(RBC) |
2
|
|
| 重原子数目 |
14
|
|
| 分子复杂度/Complexity |
261
|
|
| 定义原子立体中心数目 |
0
|
|
| SMILES |
S(C#N)C1C(N([H])[H])=NC(=C(C=1[H])SC#N)N([H])[H]
|
|
| InChi Key |
ZXOBLNBVNROVLC-UHFFFAOYSA-N
|
|
| InChi Code |
InChI=1S/C7H5N5S2/c8-2-13-4-1-5(14-3-9)7(11)12-6(4)10/h1H,(H4,10,11,12)
|
|
| 化学名 |
(2,6-diamino-5-thiocyanatopyridin-3-yl) thiocyanate
|
|
| 别名 |
|
|
| HS Tariff Code |
2934.99.9001
|
|
| 存储方式 |
Powder -20°C 3 years 4°C 2 years In solvent -80°C 6 months -20°C 1 month |
|
| 运输条件 |
Room temperature (This product is stable at ambient temperature for a few days during ordinary shipping and time spent in Customs)
|
| 溶解度 (体外实验) |
DMSO : 3~21 mg/mL ( 13.43~94.05 mM)
|
|---|---|
| 溶解度 (体内实验) |
配方 1 中的溶解度: 2.5 mg/mL (11.20 mM) in 10% DMSO + 40% PEG300 +5% Tween-80 + 45% Saline (这些助溶剂从左到右依次添加,逐一添加), 悬浮液;超声助溶。
例如,若需制备1 mL的工作液,可将100 μL 25.0 mg/mL澄清DMSO储备液加入到400 μL PEG300中,混匀;然后向上述溶液中加入50 μL Tween-80+,混匀;加入450 μL生理盐水定容至1 mL。 *生理盐水的制备:将 0.9 g 氯化钠溶解在 100 mL ddH₂O中,得到澄清溶液。 请根据您的实验动物和给药方式选择适当的溶解配方/方案: 1、请先配制澄清的储备液(如:用DMSO配置50 或 100 mg/mL母液(储备液)); 2、取适量母液,按从左到右的顺序依次添加助溶剂,澄清后再加入下一助溶剂。以 下列配方为例说明 (注意此配方只用于说明,并不一定代表此产品 的实际溶解配方): 10% DMSO → 40% PEG300 → 5% Tween-80 → 45% ddH2O (或 saline); 假设最终工作液的体积为 1 mL, 浓度为5 mg/mL: 取 100 μL 50 mg/mL 的澄清 DMSO 储备液加到 400 μL PEG300 中,混合均匀/澄清;向上述体系中加入50 μL Tween-80,混合均匀/澄清;然后继续加入450 μL ddH2O (或 saline)定容至 1 mL; 3、溶剂前显示的百分比是指该溶剂在最终溶液/工作液中的体积所占比例; 4、 如产品在配制过程中出现沉淀/析出,可通过加热(≤50℃)或超声的方式助溶; 5、为保证最佳实验结果,工作液请现配现用! 6、如不确定怎么将母液配置成体内动物实验的工作液,请查看说明书或联系我们; 7、 以上所有助溶剂都可在 Invivochem.cn网站购买。 |
| 制备储备液 | 1 mg | 5 mg | 10 mg | |
| 1 mM | 4.4787 mL | 22.3934 mL | 44.7868 mL | |
| 5 mM | 0.8957 mL | 4.4787 mL | 8.9574 mL | |
| 10 mM | 0.4479 mL | 2.2393 mL | 4.4787 mL |
1、根据实验需要选择合适的溶剂配制储备液 (母液):对于大多数产品,InvivoChem推荐用DMSO配置母液 (比如:5、10、20mM或者10、20、50 mg/mL浓度),个别水溶性高的产品可直接溶于水。产品在DMSO 、水或其他溶剂中的具体溶解度详见上”溶解度 (体外)”部分;
2、如果您找不到您想要的溶解度信息,或者很难将产品溶解在溶液中,请联系我们;
3、建议使用下列计算器进行相关计算(摩尔浓度计算器、稀释计算器、分子量计算器、重组计算器等);
4、母液配好之后,将其分装到常规用量,并储存在-20°C或-80°C,尽量减少反复冻融循环。
计算结果:
工作液浓度: mg/mL;
DMSO母液配制方法: mg 药物溶于 μL DMSO溶液(母液浓度 mg/mL)。如该浓度超过该批次药物DMSO溶解度,请首先与我们联系。
体内配方配制方法:取 μL DMSO母液,加入 μL PEG300,混匀澄清后加入μL Tween 80,混匀澄清后加入 μL ddH2O,混匀澄清。
(1) 请确保溶液澄清之后,再加入下一种溶剂 (助溶剂) 。可利用涡旋、超声或水浴加热等方法助溶;
(2) 一定要按顺序加入溶剂 (助溶剂) 。
|
|
|
|