| 规格 | 价格 | ||
|---|---|---|---|
| 500mg | |||
| 1g | |||
| Other Sizes |
| 靶点 |
caspase-2/3
|
|---|---|
| 体外研究 (In Vitro) |
几种半胱天冬酶与亨廷顿病(HD)的发病机制有关;然而,现有的半胱天冬酶抑制剂缺乏选择性来研究与HD相关的神经元细胞死亡中单个半胱天冬酶的特异性参与。为了探索caspase-2的潜在作用,我们在P(2)残基处合理修饰了强效但非选择性的典型AAc-VDVAD-CHO caspase-2抑制剂1,试图降低其对caspase-3的活性。借助caspase-2和-3活性位点的结构信息和分子模型,我们选择了一个3-(S)-取代的l-脯氨酸和另外四个支架变体作为P(2)元件,因为它们具有与caspase- 3s(2)口袋残基发生立体碰撞的预测能力。然后通过固相合成将这些元素合成为五肽醛33a-v。脯氨酸基化合物33h含有一个庞大的3-(S)取代基,与参比抑制剂1相比,在生化和细胞分析中显示出有利的特性,对caspase-2的选择性提高了20至60倍,而对caspase-3的效力降低了约200倍。该原型化合物的进一步优化可能会发现有价值的药理学工具,用于研究caspase-2介导的细胞死亡,特别是与HD相关的细胞死亡。[1]
人类caspase-3底物特异性的分子基础已经通过肽类似物抑制剂和P2, P3和P5位置变化的底物进行了研究。caspase-3配合物与底物类似物的晶体结构在1.7 A至2.3 A的分辨率下测定。caspase-3与类似物相互作用的差异与Ac-DEVD-Cho 、ac - vdvad - cho 和Ac-DMQD-Cho的Ki值分别为1.3 nM、6.5 nM和12.4 nM,相应肽底物的相对kcat/Km值分别为100%、37%和17%一致。结合肽类似物显示主链原子与保守的P1 Asp和P4 Asp之间的相互作用非常相似,而P2和P3之间的相互作用则不同。P2位于疏水的S2槽中,这与极性P2 Gln对Ac-DMQD-Cho的抑制较弱一致。在Ac-DEVD-Cho中,S3是一个表面亲水位点,与P3 - Glu具有良好的极性相互作用。Ac-DMQD-Cho和AAc-VDVAD-CHO的疏水性P3残基在极性S3位点不是最优的,这与它们较弱的抑制作用是一致的。发现了caspase-3的疏水S5位点,其中Phe250和Phe252侧链与P5 Val AAc-VDVAD-CHO相互作用,并通过构象变化包围底物结合位点。与Ac-DVAD-pNA相比,对caspase-3底物Ac-VDVAD-pNA和Ac-LDVAD-pNA的水解效率更高,证实了疏水性P5残基的动力学重要性。与Ac-DVAD-pNA相比,caspase-7对P5 Val或Leu底物的水解效率较低。Caspase-3和caspase-2具有相似的疏水S5位点,而caspase 1、7、8和9没有结构上等效的疏水残基;这些半胱天冬酶对底物P5位置的选择性可能不同。P5的独特选择性将有助于确定与每种caspase相关的特定底物和信号通路。[2] |
| 酶活实验 |
测定了caspase-3与三种底物类似抑制剂Ac-DEVD-Cho、Ac-DMQD-Cho和AAc-VDVAD-CHO配合物的晶体结构。表1总结了晶体学统计数据。晶体结构精细到分辨率为1.7 ~ 2.3 Å, r因子为18.4 ~ 21.0。caspase-3/DMQD和caspase-3/VDVAD的结构尚未被报道,而我们的caspase-3/DEVD的结构以1.7 Å的分辨率明显高于2.5 Å。
|
| 参考文献 |
|
| 其他信息 |
In order to improve our knowledge of the molecular basis for substrate specificity, the crystal structures were determined of complexes of recombinant human caspase-3 with the peptide analogs Ac-DEVD-Cho, Ac-DMQD-Cho and Ac-VDVAD-Cho. The complex with Ac-DEVD-Cho was obtained at the significantly higher resolution of 1.70 Å compared to 2.5 Å for the previously reported structure.13 These complexes explore the structural basis of specificity for positions P2 and P3 in the peptide substrates, and examine the effect of adding the P5 residue. The observed caspase-3 interactions with inhibitors were analyzed together with kinetic data for peptide substrates and inhibitors of similar sequences. These new structures with peptide analog inhibitors will help in the design of new caspase-3 inhibitors as potential therapeutic agents for neurodegenerative diseases.[2]
Further substantiating these findings is the efficacy of broad-spectrum peptide-based caspase inhibitors in preventing HTT cleavage and reducing toxicity in vitro7(b), 10 and in HD animal models.11 However, the lack of selective caspase inhibitors has hampered further progress in understanding the specific involvement of individual caspases in mHTT-induced apoptosis or mHTT cleavage; consequently, we set out to develop these selective inhibitors. Selective Csp-1,12 Csp-312(a), 13 and Csp-713a inhibitors have been disclosed; however, for Csp-2 and Csp-6, the two leading caspase targets for HD, there are no reports to our knowledge of selective inhibitors. In order to be able to rapidly test our inhibitor design strategy, we decided to focus our effort initially on the development of Csp-2 inhibitors with reduced activity for Csp-3. We report here the successful application of structure-based design to the development of potent inhibitors of Csp-2 with improved selectivity. We discuss the rationale for targeting the S2 pocket and choosing proline-based templates as the P2 element. Synthesis of these key P2 scaffolds and their incorporation into pentapeptide aldehydes via solid-phase chemistry are presented along with a detailed analysis of the biochemical and cellular selectivity of these new inhibitors.[1] |
| 分子式 |
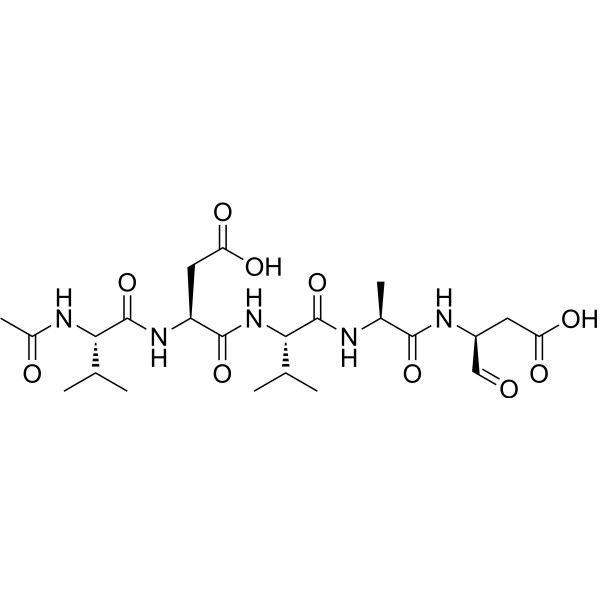
C23H37N5O10
|
|---|---|
| 分子量 |
543.57
|
| 精确质量 |
543.254
|
| CAS号 |
194022-51-0
|
| PubChem CID |
9850347
|
| 序列 |
Ac-Val-Asp-Val-Ala-Asp-al; Ac-Val-Asp-Val-Ala-Asp-CHO; N-acetyl-L-valyl-L-alpha-aspartyl-L-valyl-L-alanyl-L-aspart-1-al
|
| 短序列 |
Ac-VDVAD-CHO; VDVAD
|
| 外观&性状 |
Typically exists as solid at room temperature
|
| 密度 |
1.3±0.1 g/cm3
|
| 沸点 |
996.6±65.0 °C at 760 mmHg
|
| 闪点 |
556.5±34.3 °C
|
| 蒸汽压 |
0.0±0.6 mmHg at 25°C
|
| 折射率 |
1.520
|
| LogP |
0.42
|
| tPSA |
237.17
|
| 氢键供体(HBD)数目 |
7
|
| 氢键受体(HBA)数目 |
10
|
| 可旋转键数目(RBC) |
16
|
| 重原子数目 |
38
|
| 分子复杂度/Complexity |
920
|
| 定义原子立体中心数目 |
5
|
| SMILES |
CC([C@H](NC(C)=O)C(N[C@H](C(N[C@H](C(N[C@H](C(N[C@H](C=O)CC(O)=O)=O)C)=O)C(C)C)=O)CC(O)=O)=O)C
|
| InChi Key |
OOGHGBCRVSBUHH-GOYXDOSHSA-N
|
| InChi Code |
InChI=1S/C23H37N5O10/c1-10(2)18(25-13(6)30)23(38)27-15(8-17(33)34)21(36)28-19(11(3)4)22(37)24-12(5)20(35)26-14(9-29)7-16(31)32/h9-12,14-15,18-19H,7-8H2,1-6H3,(H,24,37)(H,25,30)(H,26,35)(H,27,38)(H,28,36)(H,31,32)(H,33,34)/t12-,14-,15-,18-,19-/m0/s1
|
| 化学名 |
(3S)-3-[[(2S)-2-acetamido-3-methylbutanoyl]amino]-4-[[(2S)-1-[[(2S)-1-[[(2S)-1-carboxy-3-oxopropan-2-yl]amino]-1-oxopropan-2-yl]amino]-3-methyl-1-oxobutan-2-yl]amino]-4-oxobutanoic acid
|
| 别名 |
Ac-VDVAD-CHO; 194022-51-0; Ac-Val-Asp-Val-Ala-Asp-aldehyde (pseudo acid); (3S)-3-[[(2S)-2-acetamido-3-methylbutanoyl]amino]-4-[[(2S)-1-[[(2S)-1-[[(2S)-1-carboxy-3-oxopropan-2-yl]amino]-1-oxopropan-2-yl]amino]-3-methyl-1-oxobutan-2-yl]amino]-4-oxobutanoic acid; Ac-VDVAD-CHO (trifluoroacetate salt); MFCD01862574; SCHEMBL20257125; DTXSID80431757;
|
| HS Tariff Code |
2934.99.9001
|
| 存储方式 |
Powder -20°C 3 years 4°C 2 years In solvent -80°C 6 months -20°C 1 month |
| 运输条件 |
Room temperature (This product is stable at ambient temperature for a few days during ordinary shipping and time spent in Customs)
|
| 溶解度 (体外实验) |
May dissolve in DMSO (in most cases), if not, try other solvents such as H2O, Ethanol, or DMF with a minute amount of products to avoid loss of samples
|
|---|---|
| 溶解度 (体内实验) |
注意: 如下所列的是一些常用的体内动物实验溶解配方,主要用于溶解难溶或不溶于水的产品(水溶度<1 mg/mL)。 建议您先取少量样品进行尝试,如该配方可行,再根据实验需求增加样品量。
注射用配方
注射用配方1: DMSO : Tween 80: Saline = 10 : 5 : 85 (如: 100 μL DMSO → 50 μL Tween 80 → 850 μL Saline)(IP/IV/IM/SC等) *生理盐水/Saline的制备:将0.9g氯化钠/NaCl溶解在100 mL ddH ₂ O中,得到澄清溶液。 注射用配方 2: DMSO : PEG300 :Tween 80 : Saline = 10 : 40 : 5 : 45 (如: 100 μL DMSO → 400 μL PEG300 → 50 μL Tween 80 → 450 μL Saline) 注射用配方 3: DMSO : Corn oil = 10 : 90 (如: 100 μL DMSO → 900 μL Corn oil) 示例: 以注射用配方 3 (DMSO : Corn oil = 10 : 90) 为例说明, 如果要配制 1 mL 2.5 mg/mL的工作液, 您可以取 100 μL 25 mg/mL 澄清的 DMSO 储备液,加到 900 μL Corn oil/玉米油中, 混合均匀。 View More
注射用配方 4: DMSO : 20% SBE-β-CD in Saline = 10 : 90 [如:100 μL DMSO → 900 μL (20% SBE-β-CD in Saline)] 口服配方
口服配方 1: 悬浮于0.5% CMC Na (羧甲基纤维素钠) 口服配方 2: 悬浮于0.5% Carboxymethyl cellulose (羧甲基纤维素) 示例: 以口服配方 1 (悬浮于 0.5% CMC Na)为例说明, 如果要配制 100 mL 2.5 mg/mL 的工作液, 您可以先取0.5g CMC Na并将其溶解于100mL ddH2O中,得到0.5%CMC-Na澄清溶液;然后将250 mg待测化合物加到100 mL前述 0.5%CMC Na溶液中,得到悬浮液。 View More
口服配方 3: 溶解于 PEG400 (聚乙二醇400) 请根据您的实验动物和给药方式选择适当的溶解配方/方案: 1、请先配制澄清的储备液(如:用DMSO配置50 或 100 mg/mL母液(储备液)); 2、取适量母液,按从左到右的顺序依次添加助溶剂,澄清后再加入下一助溶剂。以 下列配方为例说明 (注意此配方只用于说明,并不一定代表此产品 的实际溶解配方): 10% DMSO → 40% PEG300 → 5% Tween-80 → 45% ddH2O (或 saline); 假设最终工作液的体积为 1 mL, 浓度为5 mg/mL: 取 100 μL 50 mg/mL 的澄清 DMSO 储备液加到 400 μL PEG300 中,混合均匀/澄清;向上述体系中加入50 μL Tween-80,混合均匀/澄清;然后继续加入450 μL ddH2O (或 saline)定容至 1 mL; 3、溶剂前显示的百分比是指该溶剂在最终溶液/工作液中的体积所占比例; 4、 如产品在配制过程中出现沉淀/析出,可通过加热(≤50℃)或超声的方式助溶; 5、为保证最佳实验结果,工作液请现配现用! 6、如不确定怎么将母液配置成体内动物实验的工作液,请查看说明书或联系我们; 7、 以上所有助溶剂都可在 Invivochem.cn网站购买。 |
| 制备储备液 | 1 mg | 5 mg | 10 mg | |
| 1 mM | 1.8397 mL | 9.1984 mL | 18.3969 mL | |
| 5 mM | 0.3679 mL | 1.8397 mL | 3.6794 mL | |
| 10 mM | 0.1840 mL | 0.9198 mL | 1.8397 mL |
1、根据实验需要选择合适的溶剂配制储备液 (母液):对于大多数产品,InvivoChem推荐用DMSO配置母液 (比如:5、10、20mM或者10、20、50 mg/mL浓度),个别水溶性高的产品可直接溶于水。产品在DMSO 、水或其他溶剂中的具体溶解度详见上”溶解度 (体外)”部分;
2、如果您找不到您想要的溶解度信息,或者很难将产品溶解在溶液中,请联系我们;
3、建议使用下列计算器进行相关计算(摩尔浓度计算器、稀释计算器、分子量计算器、重组计算器等);
4、母液配好之后,将其分装到常规用量,并储存在-20°C或-80°C,尽量减少反复冻融循环。
计算结果:
工作液浓度: mg/mL;
DMSO母液配制方法: mg 药物溶于 μL DMSO溶液(母液浓度 mg/mL)。如该浓度超过该批次药物DMSO溶解度,请首先与我们联系。
体内配方配制方法:取 μL DMSO母液,加入 μL PEG300,混匀澄清后加入μL Tween 80,混匀澄清后加入 μL ddH2O,混匀澄清。
(1) 请确保溶液澄清之后,再加入下一种溶剂 (助溶剂) 。可利用涡旋、超声或水浴加热等方法助溶;
(2) 一定要按顺序加入溶剂 (助溶剂) 。