| 规格 | 价格 | 库存 | 数量 |
|---|---|---|---|
| 1mg |
|
||
| 5mg | |||
| 10mg | |||
| Other Sizes |
| 靶点 |
HSP90; Hsp90/HIF1α
|
|---|---|
| 体外研究 (In Vitro) |
体外活性:HIF-1(缺氧诱导因子1)是对细胞环境氧的变化做出反应的转录因子。 Chetomin通过破坏 HIF-1 与其转录共激活因子 p300 的相互作用来选择性抑制 HIF-1 活性。 Chetomin 抑制 HIF-1 可有效减少缺氧依赖性转录,并使体外缺氧 HT 1080 人纤维肉瘤细胞放射增敏。 Chetomin 减弱恶性胶质瘤细胞系 U251MG(DMF10:1.35 和 1.18)和 U343MG(DMF10:1.78 和 1.48)的缺氧诱导的放射抗性。使用 Chetomin 靶向 HIF-1 可消除缺氧诱导因子 1α 的分化抑制作用。激酶测定:细胞测定:在RT-PCR和克隆存活实验中,在缺氧处理前四小时将chetomin以150nM的浓度添加到完全补充的培养基中。然后将 HT 1080 细胞转移至低氧工作站(0.1% O2,12 小时)或充分湿润的培养箱(12 小时),无需更换培养基。因此,在放射治疗之前,用 Chetomin (150 nM) 将 HT1080 细胞处理 16 小时。
Chetomin是Hsp90/HIF1α活性的抑制剂[1] Chetomin是在C. globosum的甲醇提取物中发现的,并且先前已被证明可以抑制HIF1α与其他关键蛋白部分的结合。因此,我们在NSCLC细胞系H1299和H460中评估了其阻断Hsp90/HIF1α途径活性的能力。在接下来的实验中,由于IC50水平的差异,单层实验使用了微摩尔水平的chetodomin,而球形培养的NSCLC细胞系则使用了纳摩尔水平的chetodomin(补充表1和2)。 Chetomin通过诱导细胞凋亡对NSCLC CSCs发挥抑制作用[1] 我们对靶向CSCs作为克服肿瘤复发的策略特别感兴趣;因此,我们接下来测试了chetomin是否可以靶向CSCs,首先在粘附的单层培养物上测试chetomin。Chetomin暴露24小时,剂量依赖性地降低了H1299单层培养中干细胞生物标志物SRY(性别决定区Y)-box 2 (Sox2)、同源盒蛋白Nanog和八聚体结合转录因子4 (Oct4)的表达(图2A)。此外,chetomin预处理单层H460和H1299细胞24小时,降低了它们的成球能力和每个球的细胞数(图2B)。 Chetomin通过诱导细胞凋亡对NSCLC非cscs发挥抑制作用[1] 大多数肿瘤细胞是非csc,因此清除它们是癌症治疗的一个重要方面。因此,我们接下来评估了舍妥明对NSCLC非csc的影响。激活KRAS和灭活TP53突变是NSCLC肺癌细胞和csc的常见特征。因此,我们比较了chetomin对不朽的人支气管上皮(hBE)细胞的作用,以对抗以下几种hBE细胞:(i) KRASG12V突变(KRASG12V-hBE), (ii)通过短干扰RNA (siRNA)缺乏TP53 (siTP53-hBE),或(iii)突变KRASG12V和TP53缺陷(KRAS;G12V siTP53-hBE)(补充图2)。Chetomin暴露3天没有显著抑制hBE细胞的增殖,但对KRASG12V-hBE、siTP53-hBE和KRAS;G12V siTP53-hBE细胞的增殖有不利影响(图3A;补充表2)和不同的NSCLC细胞系和两个紫杉醇耐药亚系(H460/R和H226B/R;图3 b;补充表2)。对非小细胞肺癌的ic50在微摩尔范围内,比cheetomin对球形成的抑制作用在纳摩尔范围内弱近百倍。因此,虽然chetomin对非CSCs有一定的疗效,但对CSCs更有效。 Chetomin阻断Hsp90与HIF1α n端的结合[1] 我们探索了chetomin抑制Hsp90/HIF1α结合的分子细节。我们证实,在暴露24小时的单层NSCLC培养物中,Chetomin不影响Hsp90或Hsp70蛋白水平(图5A)。由于chetomin不影响Hsp90蛋白水平,我们下一步研究它是否直接抑制Hsp90和HIF1α之间的相互作用。Hsp90蛋白与HIF1α的碱性helix-loop-helix-PER-ARNT-SIM (bHLH-PAS)结构域结合,该结构域位于HIF1α的n端。因此,在Hsp90存在下,Chetomin被滴定为HIF1α的全长(“FL”)、N端结构域(“N”)和C端结构域(“C”)变体。chetomin的加入抑制了Hsp90与“FL”和“N”变体的相互作用,但没有抑制“C”变体的相互作用(图5B),这表明chetomin特异性地抑制了Hsp90-HIF1α在HIF1α N端的结合相互作用。 我们用短发夹RNA (shRNA)介导的Hsp90敲低(Hsp90-shRNA-H1299)和加杂对照(scr-shRNA-H1299)构建稳定的H1299细胞系,以确定Chetomin的抗癌特性是否与其抑制Hsp90与HIF1α的结合有关。正如预期的那样,暴露于chetomin两周降低了scr-shRNA-H1299细胞的集落和球体形成能力(图5C, D)。然而,在Hsp90-shRNA-H1299培养中,chetomin暴露对这些特征没有任何明显的影响(图5C, D)。此外,chetomin不影响Hsp90- shrna - h1299培养物中Hsp90底物Akt的水平(图5E)。另一方面,过表达Hsp90的H1299培养物重建了Hsp90底物MEK1/2和Src的水平(图5F)。这些结果表明,chetomin的抗癌特性依赖于Hsp90的存在。 |
| 体内研究 (In Vivo) |
在体内异种移植模型中,Chetomin与毛喉素联合使用可显着抑制恶性神经胶质瘤的生长。 Che-M(负载 Chetomin 的胶束)可显着抑制斑马鱼的胚胎血管生成、肿瘤诱导的血管生成和肿瘤生长。在小鼠模型中,Che-M 可抑制皮下 CT26 肿瘤模型中的肿瘤生长并延长其生存期。
Chetomin抑制NSCLC小鼠模型的肺肿瘤发生[1] 为了证实我们在体外的发现,我们接下来在几种小鼠模型中测试了舍妥明。在自发性肺肿瘤发生的KrasLA1小鼠模型中,与对照药相比,给予25次切妥明8周显著降低了病变数量(图4A)。肺组织显微检查显示,与给药组相比,给药组的病变数量、大小和总负荷显著降低(图4B)。肺切片的荧光免疫组化(IHC)显示,与给药组相比,化疗蛋白组的Cl-Cas3、HIF1α、CD34和Oct4表达失调(图4C、D)。Chetomin暴露并未对KrasLA1小鼠的体重产生任何可观察到的变化(Supplementary图4a)。 我们在体内测试的第二个模型Chetomin是H1299侧腹异种移植模型。当异种移植物达到50至150 mm3的大小时,小鼠被随机分配到切妥明(50或100 mg/kg, p.o.)或载药组三周。在两种剂量下,chetomin都能显著降低异种移植肿瘤的大小(图4E)和质量(图4F)。肺切片的荧光免疫组化显示,与给药组相比,舍托明组的Cl-Cas3强度更高(凋亡更多),HIF1α和CD34强度更低(血管生成更少)(图4G)。Chetomin暴露对H1299异种移植小鼠的体重没有任何可观察到的变化(补充图4b)。 由于CSCs具有自我更新的能力,因此在接种到小鼠体内时可以增殖肿瘤;因此,我们还测试了Chetomin对CSCs肿瘤增殖的影响。首先,建立H1299侧翼异种移植物,小鼠接受如上所述的切托明或载药。切除肿瘤,分离肿瘤,并将连续稀释的细胞植入NOD/SCID受体动物。在体外观察(图2E),与暴露于载体细胞的受体相比,接种了chetomin暴露细胞的受体表现出明显较低的肿瘤发生(图4H)。 最后,我们比较了Chetomin在体内对H460/R侧腹异种移植模型和H460/R侧腹异种移植模型的影响,以测试Chetomin是否对化疗耐药的H460/R异种移植有不同的影响。当异种移植物达到50至150 mm3的大小时,小鼠被随机分配到切妥明(50或100 mg/kg, p.o.)或载药组三周。在两种剂量下,H460/R异种移植物肿瘤的大小(图4I)和质量(图4J)与H460异种移植物没有显著差异。此外,肺切片的荧光免疫组化显示,chetomin处理的H460/R异种移植物与chetomin处理的H460异种移植物在Cl-Cas3(细胞凋亡)或HIF1α和CD34(血管生成)方面没有显著差异(图4K)。Chetomin暴露对H460异种移植小鼠和H460/R异种移植小鼠的体重没有任何可观察到的变化(补充图4C, D)。 |
| 细胞实验 |
在 RT-PCR 和克隆存活实验中,在缺氧处理前四小时,将Chetomin以 150 nM 的浓度添加到完全补充的培养基中。之后,在不改变培养基的情况下,将 HT 1080 细胞转移至充分湿润的培养箱(12 小时)或低氧工作站(0.1% O2)。因此,在接受放射治疗之前,HT1080 细胞用 Chetomin (150 nM) 处理 16 小时。
通过MTT法量化细胞增殖[1] 将每孔5×10³个细胞接种于96孔培养板中,给予24小时贴壁时间。随后在细胞培养基中加入指定浓度的甲醇提取物、Chetomin或对照溶剂,培养三天(37°C,5% CO₂)。此阶段向培养基添加MTT至终浓度500μg/ml,将培养板放回37°C培养箱2至4小时。存活细胞产生的甲臜溶解于DMSO中,在570nm波长处定量比色信号。所有实验结果均相对于对照值并以百分比表示。 通过成球实验评估肿瘤干细胞样特性[1] 细胞在超低吸附96孔培养板中使用维持成球特性的培养基培养。培养基成分为添加B-27™补充剂、生长因子(bFGF、EGF)和抗生素的DMEM-F12。将成球细胞与指定浓度的Chetomin或对照溶剂在培养箱(37°C,5% CO₂)中孵育两周或直至球体直径超过150µm³。 通过贴壁依赖性实验评估集落形成能力[1] 将每孔300个细胞接种于6孔培养板,加入含/不含caspase-3抑制剂的指定浓度Chetomin或对照溶剂,培养两周(37°C,5% CO₂)。每周补充新鲜培养基1-2次。培养结束后用100%甲醇固定集落,0.002%结晶紫水溶液染色,经去离子水多次漂洗。通过ImageJ软件对集落进行可视化计数。 通过非贴壁依赖性(软琼脂)实验评估集落形成能力[1] 将细胞悬浮于无菌1%琼脂中(终浓度0.4%),加入预铺1%琼脂的24孔培养板。在凝固琼脂上层覆盖含指定浓度Chetomin或对照溶剂(含/不含caspase-3抑制剂)的培养基,培养两周(37°C,5% CO₂)。每周补充新鲜培养基1-2次。培养结束时用MTT溶液染色存活集落,通过ImageJ软件进行可视化定量。 通过细胞周期分析评估细胞凋亡[1] 细胞与不同浓度Chetomin或对照溶剂培养24小时。收集悬浮与贴壁细胞,用PBS清洗后以100%甲醇固定。使用含RNase A(均为50μg/ml)的PI染色30分钟(室温)。通过BD FACSCalibur®流式细胞仪检测,使用对照样本设门并测量荧光强度。采用BD CellQuest™软件分析细胞周期进程。 内皮细胞管形成定量分析[1] 条件培养基(CM)制备:H1299细胞与Chetomin或对照溶剂培养24小时后,在低氧(1% O₂)或常氧(21% O₂)环境下继续培养4小时。更换为无血清新鲜培养基再培养24小时,收集所得CM用于后续实验。 管形成实验:参照文献方法18进行评估。简言之,将HUVECs接种于CellBIND® 96孔板贴壁后,分别用常规培养基或来自Chetomin/对照溶剂处理的H1299细胞的常氧/低氧CM处理。观察HUVECs形态变化并进行评分。 NSCLC培养物蛋白与mRNA含量分析[1] 细胞与指定浓度Chetomin或对照溶剂培养24小时。蛋白分析采用Western blot(方法见补充信息)。mRNA分析使用RNA提取试剂盒纯化总RNA,按文献方法19进行RT-PCR(引物序列见补充表3)。扩增DNA经1.5%琼脂糖凝胶电泳分离,通过Gel Doc™ EZ系统成像。 Pull-down、免疫共沉淀(IP)及竞争性ATP结合实验[1] Chetomin或对照溶剂处理后的Hsp90 pull-down、IP实验及纯化操作均参照文献方法进行。 Hsp90与Chetomin荧光滴定的相互作用[1] 荧光滴定实验是为了评估Hsp90和chetomin之间的相互作用,并确定chetomin与Hsp90可能的结合位置,如补充信息中所述。 |
| 动物实验 |
Chetomin was loaded in micelles; 1 mg/mL(for zebrafish); 2 mg/kg(for mouse); s.c.
Transgenic fish Tg(flk1:EGFP); Mouse model(BALB/c mice) Tumor-propagation from dissociated tumor xenografts [1] Following the 8-week regimen of Chetomin or vehicle, mice were sacrificed, tumors excised, and dissociated using a Tumor Dissociation Kit. Viable individual cancer tells were counted with trypan blue and 500 to 50,000 cells were implanted in NOD/SCID animals by subcutaneous injection in their right flank. Mice were monitored, and tumor burden assessed. |
| 毒性/毒理 (Toxicokinetics/TK) |
rat LD50 oral 75 mg/kg CRC Handbook of Antibiotic Compounds, Vols.1- , Berdy, J., Boca Raton, FL, CRC Press, 1980, 4(1)(174), 1980
|
| 参考文献 | |
| 其他信息 |
Chetomin has been reported in Chaetomium cochliodes, Chaetomium elatum, and other organisms with data available.
Non-small cell lung cancer (NSCLC) remains recalcitrant to effective treatment due to tumor relapse and acquired resistance. Cancer stem cells (CSCs) are believed to be one mechanism for relapse and resistance and are consequently considered promising drug targets. We report that chetomin, an active component of Chaetomium globosum, blocks heat shock protein 90/hypoxia-inducible factor 1 alpha (Hsp90/HIF1α) pathway activity. Chetomin also attenuated sphere-forming, a stem cell-like characteristic, of NSCLC CSCs (at ~ nM range) and the proliferation of non-CSCs NSCLC cultures and chemoresistant sublines (at ~ μM range). At these concentrations, chetomin exerted a marginal influence on noncancerous cells originating from several organs. Chetomin markedly decreased in vivo tumor formation in a spontaneous KrasLA1 lung cancer model, flank xenograft models, and a tumor propagation flank implanted model at doses that did not produce an observable toxicity to the animals. Chetomin blocked Hsp90/HIF1α pathway activity via inhibiting the Hsp90-HIF1α binding interaction without affecting Hsp90 or Hsp70 protein levels. This study advocates chetomin as a Hsp90/HIF1α pathway inhibitor and a potent, nontoxic NSCLC CSC-targeting molecule. [1] Herein, we report that Chetomin, an indole heteropentacyclic compound isolated from C. globosum, functions as an Hsp90/HIF1α pathway inhibitor that decreases the viability and elicits apoptosis of NSCLC CSCs spheres and non-CSCs monolayer cultures in vitro within nanomolar and micromolar range, respectively. Moreover, we found that chetomin inhibits tumorigenesis in a spontaneous KrasLA1 lung cancer model, a H1299 flank xenograft model, and a tumor propagation flank implanted model. Notably, chetomin does not significantly affect Hsp90 or Hsp70 expression in vitro, is only marginally toxic to non-cancerous cell lines in vitro, and produces no discernible toxicity to mice in vivo. These properties make chetomin particularly attractive as a potential anti-cancer drug in NSCLC patients. On a molecular level, Chetomin has been shown to target the CH1 domain of the transcriptional co-activator p300, thereby blocking the p300-HIF-1α interaction, which attenuates HIF-1α’s hypoxia-inducible transcription. As we found that chetomin blocks Hsp90’s binding to HIF1α, these findings suggest that chetomin indirectly produces this effect through p300. On a cellular level, chetomin inhibits human triple-negative breast cancer cell proliferation via apoptosis induction and displays anti-myelomatous activity without toxicity to normal hematopoietic cells This evidence supports our contention that chetomin displays potent anti-cancer properties with a favorable safety profile. In conclusion, our study advocates chetomin as a Hsp90/HIF1α pathway inhibitor and a potent, nontoxic NSCLC CSC-targeting molecule. |
| 分子式 |
C31H30N6O6S4
|
|
|---|---|---|
| 分子量 |
710.87
|
|
| 精确质量 |
712.126
|
|
| 元素分析 |
C, 52.38; H, 4.25; N, 11.82; O, 13.50; S, 18.04
|
|
| CAS号 |
1403-36-7
|
|
| 相关CAS号 |
|
|
| PubChem CID |
10417379
|
|
| 外观&性状 |
White to light yellow solid powder
|
|
| 密度 |
1.8±0.1 g/cm3
|
|
| 熔点 |
710.9ºC
|
|
| 折射率 |
1.869
|
|
| LogP |
3.85
|
|
| tPSA |
238.17
|
|
| 氢键供体(HBD)数目 |
3
|
|
| 氢键受体(HBA)数目 |
11
|
|
| 可旋转键数目(RBC) |
5
|
|
| 重原子数目 |
47
|
|
| 分子复杂度/Complexity |
1460
|
|
| 定义原子立体中心数目 |
6
|
|
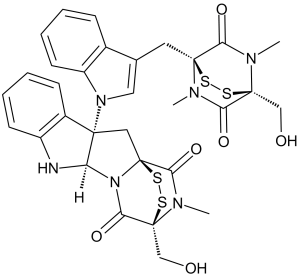
| SMILES |
CN1C(=O)[C@@]2(CO)N(C)C(=O)[C@]1(CC3=CN(C4=CC=CC=C34)[C@]56C[C@]78C(=O)N(C)[C@](CO)(C(=O)N7[C@H]5NC9=CC=CC=C96)SS8)SS2
|
|
| InChi Key |
ZRZWBWPDBOVIGQ-YWZWRZHGSA-N
|
|
| InChi Code |
InChI=1S/C31H30N6O6S4/c1-33-25(42)30(15-38)34(2)23(40)28(33,44-46-30)12-17-13-36(21-11-7-4-8-18(17)21)27-14-29-24(41)35(3)31(16-39,47-45-29)26(43)37(29)22(27)32-20-10-6-5-9-19(20)27/h4-11,13,22,32,38-39H,12,14-16H2,1-3H3/t22-,27+,28+,29+,30+,31+/m1/s1
|
|
| 化学名 |
(1S,3S,11R,14S)-14-(hydroxymethyl)-3-[3-[[(1S,4S)-4-(hydroxymethyl)-5,7-dimethyl-6,8-dioxo-2,3-dithia-5,7-diazabicyclo[2.2.2]octan-1-yl]methyl]indol-1-yl]-18-methyl-15,16-dithia-10,12,18-triazapentacyclo[12.2.2.01,12.03,11.04,9]octadeca-4,6,8-triene-13,17-dione
|
|
| 别名 |
|
|
| HS Tariff Code |
2934.99.9001
|
|
| 存储方式 |
Powder -20°C 3 years 4°C 2 years In solvent -80°C 6 months -20°C 1 month |
|
| 运输条件 |
Room temperature (This product is stable at ambient temperature for a few days during ordinary shipping and time spent in Customs)
|
| 溶解度 (体外实验) |
|
|||
|---|---|---|---|---|
| 溶解度 (体内实验) |
注意: 如下所列的是一些常用的体内动物实验溶解配方,主要用于溶解难溶或不溶于水的产品(水溶度<1 mg/mL)。 建议您先取少量样品进行尝试,如该配方可行,再根据实验需求增加样品量。
注射用配方
注射用配方1: DMSO : Tween 80: Saline = 10 : 5 : 85 (如: 100 μL DMSO → 50 μL Tween 80 → 850 μL Saline)(IP/IV/IM/SC等) *生理盐水/Saline的制备:将0.9g氯化钠/NaCl溶解在100 mL ddH ₂ O中,得到澄清溶液。 注射用配方 2: DMSO : PEG300 :Tween 80 : Saline = 10 : 40 : 5 : 45 (如: 100 μL DMSO → 400 μL PEG300 → 50 μL Tween 80 → 450 μL Saline) 注射用配方 3: DMSO : Corn oil = 10 : 90 (如: 100 μL DMSO → 900 μL Corn oil) 示例: 以注射用配方 3 (DMSO : Corn oil = 10 : 90) 为例说明, 如果要配制 1 mL 2.5 mg/mL的工作液, 您可以取 100 μL 25 mg/mL 澄清的 DMSO 储备液,加到 900 μL Corn oil/玉米油中, 混合均匀。 View More
注射用配方 4: DMSO : 20% SBE-β-CD in Saline = 10 : 90 [如:100 μL DMSO → 900 μL (20% SBE-β-CD in Saline)] 口服配方
口服配方 1: 悬浮于0.5% CMC Na (羧甲基纤维素钠) 口服配方 2: 悬浮于0.5% Carboxymethyl cellulose (羧甲基纤维素) 示例: 以口服配方 1 (悬浮于 0.5% CMC Na)为例说明, 如果要配制 100 mL 2.5 mg/mL 的工作液, 您可以先取0.5g CMC Na并将其溶解于100mL ddH2O中,得到0.5%CMC-Na澄清溶液;然后将250 mg待测化合物加到100 mL前述 0.5%CMC Na溶液中,得到悬浮液。 View More
口服配方 3: 溶解于 PEG400 (聚乙二醇400) 请根据您的实验动物和给药方式选择适当的溶解配方/方案: 1、请先配制澄清的储备液(如:用DMSO配置50 或 100 mg/mL母液(储备液)); 2、取适量母液,按从左到右的顺序依次添加助溶剂,澄清后再加入下一助溶剂。以 下列配方为例说明 (注意此配方只用于说明,并不一定代表此产品 的实际溶解配方): 10% DMSO → 40% PEG300 → 5% Tween-80 → 45% ddH2O (或 saline); 假设最终工作液的体积为 1 mL, 浓度为5 mg/mL: 取 100 μL 50 mg/mL 的澄清 DMSO 储备液加到 400 μL PEG300 中,混合均匀/澄清;向上述体系中加入50 μL Tween-80,混合均匀/澄清;然后继续加入450 μL ddH2O (或 saline)定容至 1 mL; 3、溶剂前显示的百分比是指该溶剂在最终溶液/工作液中的体积所占比例; 4、 如产品在配制过程中出现沉淀/析出,可通过加热(≤50℃)或超声的方式助溶; 5、为保证最佳实验结果,工作液请现配现用! 6、如不确定怎么将母液配置成体内动物实验的工作液,请查看说明书或联系我们; 7、 以上所有助溶剂都可在 Invivochem.cn网站购买。 |
| 制备储备液 | 1 mg | 5 mg | 10 mg | |
| 1 mM | 1.4067 mL | 7.0336 mL | 14.0673 mL | |
| 5 mM | 0.2813 mL | 1.4067 mL | 2.8135 mL | |
| 10 mM | 0.1407 mL | 0.7034 mL | 1.4067 mL |
1、根据实验需要选择合适的溶剂配制储备液 (母液):对于大多数产品,InvivoChem推荐用DMSO配置母液 (比如:5、10、20mM或者10、20、50 mg/mL浓度),个别水溶性高的产品可直接溶于水。产品在DMSO 、水或其他溶剂中的具体溶解度详见上”溶解度 (体外)”部分;
2、如果您找不到您想要的溶解度信息,或者很难将产品溶解在溶液中,请联系我们;
3、建议使用下列计算器进行相关计算(摩尔浓度计算器、稀释计算器、分子量计算器、重组计算器等);
4、母液配好之后,将其分装到常规用量,并储存在-20°C或-80°C,尽量减少反复冻融循环。
计算结果:
工作液浓度: mg/mL;
DMSO母液配制方法: mg 药物溶于 μL DMSO溶液(母液浓度 mg/mL)。如该浓度超过该批次药物DMSO溶解度,请首先与我们联系。
体内配方配制方法:取 μL DMSO母液,加入 μL PEG300,混匀澄清后加入μL Tween 80,混匀澄清后加入 μL ddH2O,混匀澄清。
(1) 请确保溶液澄清之后,再加入下一种溶剂 (助溶剂) 。可利用涡旋、超声或水浴加热等方法助溶;
(2) 一定要按顺序加入溶剂 (助溶剂) 。
|
|
|