| 规格 | 价格 | 库存 | 数量 |
|---|---|---|---|
| 5mg |
|
||
| 10mg |
|
||
| 25mg |
|
||
| 50mg |
|
||
| 100mg |
|
||
| 250mg |
|
||
| Other Sizes |
|
| 靶点 |
TLR7/9
|
|---|---|
| 体外研究 (In Vitro) |
口服药物E6446可有效抑制TLR7和TLR9。 E6446 抑制 LPS 内毒素对 HEK:TLR4 细胞的刺激或 R848 对 HEK:TLR7 细胞的刺激的效率明显较低。然而,它能有效抑制 HEK:TLR9 细胞的 DNA 刺激,IC50 值为 10 nM。当 TLR3 配体聚肌苷-胞嘧啶产生 IL-6 时,E6446 无效,但当 CpG2216 诱导 IL-6 时,E6446 无效。 E6446 抑制 TLR7 的能力是配体依赖性的。虽然短分子咪唑喹啉配体 R-848 产生的 IL-6 被 E6446 抑制得相当差,但它被 RNA 抑制得很厉害。在体外,E6446 抑制 TLR9-DNA 相互作用,IC50 为 1 至 10 µM [1]。 E6446 (0.01-0.03 μM) 特异性抑制 CpG ODN 2006 激活 TLR9,而 2-8 μM 咪唑喹啉化合物 R848 则阻断 TLR7/8 激活。在分别用寡核苷酸 2006 刺激的 HEK-TLR9 细胞和用寡核苷酸 2216 刺激的人 PBMC 中,E6446 在 30 μM 时将 TLR4 活化降低 50%,IC50 分别为 0.01 μM 和 0.23 μM [2]。
E6446对核酸敏感TLR的靶向抑制。[2] 为了测试E6446对TLR激活的影响,我们在浓度增加的E6446存在下,用NF-κB启动子下的TLR4/MD2、TLR7或TLR9以及ELAM-1–萤光素酶报告基因稳定转染HEK293细胞,并分别使用相应的配体(LPS、R848或CpG ODN 2006)。ELAM-1-萤光素酶活性的测量表明,E6446在0.01-0.03μM的范围内特异性抑制CpG ODN 2006对TLR9的激活。需要高100倍浓度(2-8μM)的E6446来抑制咪唑并喹啉化合物R848激活的TLR7/8。需要用更高浓度(30μM)的E6446孵育细胞,以减少50%的TLR4激活(图2A)。用E6446处理人外周血单核细胞(PBMCs)也降低了TLR9(CpG ODN 2402)和TLR8[单链RNA(ssRNA)]激动剂对IL-6的产生,分别在0.05和0.5的范围内。大约需要5μM来抑制50%的R848反应,R848也会激活小鼠TLR7和人类TLR8(图2A,下图)。氯喹是一种广泛使用的抗疟疾药物,具有免疫调节特性,特别是通过干扰内体TLR功能,已被用于治疗自身免疫性疾病。因此,我们比较了E6446和羟氯喹的效果。当在用oligo 2006刺激的HEK-TLR9细胞中进行测试时,E6446的效力是羟氯喹的八倍(羟氯喹在几次实验中的平均IC50为0.01μM对0.08μM)。同样,在用寡聚2216刺激的人外周血单个核细胞中,E6446的IC50为0.23μM,而羟氯喹的IC50为1.2μM。 E6446抑制脂肪生成分化和肝脂肪生成[3] 为了评估前5种候选化合物的药理作用,本研究选择了两种经典的细胞模型(脂肪生成分化和肝脂肪变性模型),它们模拟了脂肪肝形成的最关键过程(图2A-B)。如图2C-E所示,所有五种候选化合物均显著抑制了OP细胞中TG的积累,减少了脂滴的数量,并显著下调了脂肪细胞分化标志物基因Pparg、Fasn、Fabp4和C/ebpα。此外,在肝脂肪变性模型中,只有E6446而不是四种候选化合物抑制了TG含量的积累、脂滴的形成以及C/ebpα、Fasn和Fabp4的表达(图2F-H)。此外,所有化合物均不影响SCD2表达,E6446对SCD1活性的抑制作用最强(图S1A-C;S12A-B)。这些结果表明,E6446是选择性化合物中最有效的脂肪生成分化和肝脂肪生成抑制剂。 E6446靶向SCD1以抑制脂肪生成分化和肝脂肪生成[3] 先前的研究发现,E6446可以抑制TLR7和TLR9信号传导。然而,TLR7和TLR9主要在脑和淋巴组织中表达,在肝脏和脂肪组织中几乎不表达。我们的结果与这些发现一致,在OP9和AML12细胞中未检测到TLR7和TLR9(图S2)。为了研究E6446在脂肪生成分化和肝脂肪生成过程中是否靶向SCD1,SCD1在OP9和AML12细胞中过表达并被敲除。转染效率如图S3所示。当SCD1在OP9细胞中过表达时,E6446对脂肪生成分化的抑制作用,包括SCD1蛋白表达、TG含量和脂肪细胞分化标志物基因表达被逆转(图3A-D)。此外,E6446还促进了OP9细胞中UCP1的表达(图S4)。同样,与E6446治疗组相比,SCD1过表达联合E6446治疗显著增加了AML12细胞中SCD1蛋白表达、脂滴、TG含量和脂肪生成基因表达(图3E-H)。同时,单独敲除SCD1显著抑制了脂肪生成分化和肝脏脂肪生成,E6446治疗没有增强单独沉默SCD1引起的表型(图S5)。总的来说,这些结果表明E6446靶向SCD1以抑制脂肪生成分化和肝脏脂肪生成。 E6446在预防脂肪生成分化和肝脂肪生成方面比A939572更有效[3] 许多研究表明,A939572是一种强效的SCD1抑制剂,许多临床前研究将A939582用作对照(硬脂酰辅酶a去饱和酶1是透明细胞肾细胞癌的新型分子治疗靶点。通过硬脂酰辅酶a去饱和酶-1产生的单不饱和脂肪酸是脂肪酸酰胺水解酶的内源性抑制剂。硬脂酰辅酶C去饱和酶活性的丧失通过增加Xbp-1剪接导致游离胆固醇合成)。E6446与A939572治疗NAFLD的疗效和安全性尚不清楚。为了解决这个问题,我们试图通过一些简单的经典实验来揭示它们之间的优缺点。LDH和CCK-8检测表明,E6446显著抑制了游离脂肪酸诱导的肝细胞脂肪毒性,而A939572没有(图4A-D)。此外,E6446和A939572表现出优异的SCD1效力,IC50值在微摩尔范围内(E6446 IC50 = 0.98 μM;A939572 IC50 = 2.8 μM).接下来,我们研究了E6446在脂肪生成分化和肝脂肪生成方面是否比A939572更有效。如图4E-G所示,我们发现E6446治疗在降低成脂分化标志物基因Pparg、Fasn、Fabp4和C/ebpα的表达以及脂滴方面明显优于A939572治疗。此外,与A939572治疗相比,E6446干预显著抑制了TG含量的积累、Fasn、Fabp4和C/ebpα的表达以及脂滴的形成(图4H-J)。使用SPR测定法测定E6446和A939572与SCD1的动力学/亲和力。结果表明,E6446的KD值为4.61μM,而A939572的KD值是11.65μM,表明E6446和SCD1之间具有很强的相互作用能力(图4K)。这些结果表明,E6446在治疗NAFLD方面比A939572更安全、更有效。 转录组学分析表明ATF3是一个潜在的下游靶点[3] 为了鉴定可能参与E6446介导的脂肪分化和脂肪生成抑制的候选分子,我们在E6446治疗后在脂肪分化和肝脂肪变性模型中进行了RNA-seq。该分析在OP9细胞中鉴定出506个上调和167个下调基因,在AML12细胞中鉴定到238个上调和167B个下调基因(图5A-B)。在两个上调的基因组中,有31个基因重叠(图5C)。随后,对共上调的基因进行GO分析,结果表明该基因集在脂肪生成基因中显著富集(图5D)。脂肪生成相关基因中排名前三的基因是Id3、Ccn2和ATF3。为了验证RNA-seq结果,我们进行了RT-PCR,发现Id3、Ccn2和ATF3在脂肪分化和肝脂肪变性过程中显著增加(图5E-F)。然而,当SCD1过表达时,AML12细胞中ATF3 mRNA水平显著降低,而Id3和Ccn2水平不受影响(图5G)。此外,在这三个基因中,SCD1转染后OP9细胞的ATF3 mRNA水平下降最为明显(图5H)。因此,这些结果表明,ATF3可能是E6446介导的SCD1抑制在脂肪生成分化和肝脂肪生成中的潜在下游靶点。 E6446通过SCD1-ATF3信号传导抑制脂肪分化和肝脂肪生成[3] 上述结果表明,SCD1-ATF3信号传导可能代表E6446治疗的关键下游信号通路。因此,我们研究了ATF3沉默是否阻断了E6446对脂肪生成分化和肝脂肪生成的抑制作用。我们的结果表明,ATF3敲除显著阻止了E6446诱导的对脂肪生成分化的抑制作用,包括TG积累、脂肪细胞分化标志物基因表达和脂滴形成(图6A-C)。同样,ATF3沉默也阻断了E6446治疗诱导的肝脂肪生成抑制(图6D-F)。这些观察结果表明,E6446通过SCD1-ATF3信号传导抑制脂肪生成分化和肝脂肪生成。 |
| 体内研究 (In Vivo) |
E6446(20 mg/kg,口服)几乎完全减少 CpG1668 引起的 IL-6 的产生,并以剂量依赖性方式抑制小鼠体内 ANA(抗核抗体)的产生,剂量为 20 和 60 mg/kg [1 ]。在小鼠中,E6446(20、60 mg/kg,口服)剂量依赖性地抑制 TLR9 信号传导。 E6446(60、120 mg/kg,口服)抑制 TLR7 和 TLR9 的激活,降低急性疟疾期间的 TLR 反应性,并保护啮齿动物疟疾中 LPS 诱导的感染性休克和 TLR 高反应性 [2]。
E6446预防啮齿动物疟疾中TLR的高反应性和LPS诱导的感染性休克。[2] 由于E6446能够阻断核酸对TLR的激活,我们决定评估E6446对疟疾发病机制的影响。我们首先评估了E6446治疗沙氏疟原虫感染的疗效。虽然通常不会致命,但我们之前已经证明,这种小鼠模型会引起TLR反应的促炎启动,使小鼠对低剂量LPS极为敏感(19)。在急性疟疾期间,用60 mg·kg−1·d−1的E6446治疗降低了TLR反应性(图3A)。此外,当以更高的浓度(120 mg·kg−1·d−1)给药时,E6446没有毒性,可以保护感染的小鼠免受LPS诱导的休克(图3B)。值得注意的是,与赋形剂治疗的小鼠(存活率<10%)相比,用120 mg·kg−1·d−1 E6446治疗的小鼠对LPS诱导的休克表现出更高的抵抗力(86%的存活率),而TLR9-/-小鼠的存活率为38%(19)。根据我们的体外实验(图2),可以想象,在体内,120 mg·kg−1·d−1的E6446能够抑制TLR7和TLR9的激活。如果是这样的话,这些结果表明,TLR9、TLR7和TLR8(在人类中)可能与启动和增强TLR的反应性、全身炎症反应和疟疾的发病机制有关。重要的是,在120mg/kg的剂量下,体内达到的最高血清药物浓度约为1μM,比阻断LPS体外激活TLR4所需的E6446浓度低30至50倍。此外,用E6446(120 mg·kg−1·d−1)治疗并不能防止非感染小鼠在用致死剂量的LPS(500μg)攻击后死亡,这增强了E6446对核酸感应TLR的特异性作用,但对LPS激活的TLR4没有(图2A)。 E6446预防小鼠ECM。[2] 接下来,我们测试了通过核酸传感TLR阻断细胞信号传导是否对PbA诱导的ECM有任何影响。C57BL/6小鼠在感染1×105 PbA感染的红细胞(iRBCs)后第1天至第12天,口服120 mg·kg−1·d−1的E6446或赋形剂。正如该疟疾模型所预期的那样(29),大多数用载体治疗的小鼠在感染后第6-12天死于PbA介导的ECM(图4A,上图)。尽管未观察到寄生虫血症的变化(图4A,下图),但E6446治疗对提高PbA感染后的存活率有明显效果。 为了解决E6446对已确诊疾病的显著疗效,我们测试了用这种化合物治疗是否可以在症状发作前预防PbA-ECM的发展。从感染后第3、5或7天至第12天,用PbA感染小鼠并用120mg/kg的E6446治疗。尽管E6446在预防ECM方面的功效降低,但用这种化合物治疗的小鼠的存活率比赋形剂治疗的小鼠好(图4B)。E6446在感染后6天脑综合征发作时给药时未能保护小鼠。 接下来,我们评估了E6446治疗对PbA感染期间细胞因子谱的影响。用E6446治疗的小鼠产生的促炎细胞因子水平显著降低(图4C,上图)。此外,E6446疗法也减少了PbA介导的TLR反应启动(图4C,下图)。核酸感应TLR(如TLR9、TLR7)在树突状细胞(DC)上高度表达,并被证明可被在疟疾发病机制中起相关作用的疟原虫产物激活(18,30,31)。因此,我们试图使用流式细胞术(FACS)进行细胞内细胞因子染色,以确定E6446对髓系CD11c+MHCII+DCs产生的细胞因子的影响。我们发现,与未感染的小鼠相比,感染PbA的小鼠在感染后第6天TNF-α的产生显著增加。用E6446处理的PbA感染小鼠的细胞中TNF-α的产生被消除(图4D)。 为了证实内体TLRs参与ECM发病机制,我们用PbA感染了“三缺陷”(3d)小鼠。3d小鼠在UNC93B1基因中有一个突变,对TLR3、TLR7或TLR9激动剂没有反应(32)。重要的是,我们在3d小鼠中的结果与用E6446治疗的小鼠中获得的结果相似。这些小鼠表现出促炎细胞因子的产生受损,对PbA诱导的ECM更具抵抗力,尽管表现出类似的寄生虫血症(图S1)。因此,这些结果进一步支持了E6446疗法通过阻断核酸感应TLR的激活来保护PbA诱导的ECM的假设。 E6446疗法可以减轻ECM的症状。[2] 伴有严重衰弱的脑癫痫发作是PbA-ECM的强烈指标。因此,我们在急性PbA感染期间对每只小鼠进行了神经学检查。我们表明,用E6446治疗的小鼠获得了更好的临床结果;与赋形剂处理的小鼠相比,症状减轻(图5A)。促炎细胞因子,如TNF-α和IL-1β,已被证明会影响血脑屏障(BBB)的通透性,导致有助于ECM的单核细胞泄漏和浸润(33)。由于E6446对小鼠细胞(图2B)和疟疾感染(图3B和4C)中细胞因子产生的抑制作用,我们接下来测试了E6446在PbA感染期间对BBB完整性的影响。我们评估了终末期ECM小鼠静脉注射1%伊文思蓝后的脑血管渗漏。用载体处理的小鼠显示出明显的血管渗漏,如大脑的蓝色染色所示,而E6446处理的小鼠则没有这种渗漏(图5B)。在脑组织切片中研究了血管渗漏的形态学相关性。与宏观观察一致,用载体治疗的感染小鼠的脑血管显示出典型的微血管损伤,并伴有iRBCs的隔离,包括存在血凝素、内皮上的单核细胞粘附和实质出血,这在E6446治疗的小鼠中发生率要低得多。一般来说,用E6446治疗的PbA感染小鼠的脑血管内炎症灶数量明显减少(图5C)。 E6446改善HFD诱导的NAFLD[3] 接下来,我们研究了E6446对HFD诱导的NAFLD的体内影响。C57BL/6J小鼠喂食HFD 12周,每周三次用E6446或赋形剂灌胃。HFD喂养18周导致体重、肝脏重量和WAT重量高于正常对照饮食(NCD)组,而E6446显著降低了肝脏重量、WAT重量和脂肪/体重比(图7A-D)。如葡萄糖耐量试验(GTT)所示,HFD小鼠也表现出更严重的胰岛素抵抗。E6446显著改善了葡萄糖耐量(图7E)。与NCD组相比,喂食HFD的小鼠肝脏和血清TC、TG、LDL、ALT和AST显著增加,而E6446治疗显著降低了这些生化指标(图7F-G)。H&E和油红O染色显示,HFD喂养的小鼠比NCD小鼠有更多的脂滴,而E6446治疗显著减少了脂滴积聚(图7H)。这些发现表明,E6446对HFD诱导的肝脂肪变性表现出强大的疗效。 |
| 酶活实验 |
表面等离子体共振(SPR)分析[3]
SPR实验使用Biacore X100进行。使用HBS-EP缓冲液作为工作缓冲液,将SCD1重组蛋白稀释至终浓度为20μg/mL。将NHS和EDC(1:1,v/v)的混合物注入仪器以激活CM5传感器。然后,注射20μg/mL的SCD1重组蛋白,通过氨基偶联将其固定在CM5芯片上。随后,注射1M乙醇胺盐酸盐(pH 8.5)7分钟以阻断和活化芯片表面。然后使用HBS-EP缓冲液注射E6446(100、50、25、12.5、6.25、3.125μmol/L)和A939572。根据分析软件的拟合数据,以时间为横坐标,响应值为纵坐标,计算了E6446和SCD1的结合动力学。 小分子配体对TLR9和TLR7信号传导的抑制[1] 使用表达克隆的人TLR9和NF-κB:萤光素酶报告基因的HEK293细胞(HEK:TLR9细胞)筛选一个化合物库,寻找可以抑制刺激DNA诱导NF-κB的小分子(CpG2006)。AT791和E6446(图1A)有效地抑制了HEK:TLR9细胞的DNA刺激,IC50值分别为40和10 nM,但在抑制HEK:TLR4细胞的LPS内毒素刺激(表1)或HEK:TLR7细胞的R848刺激方面效果明显较差。 |
| 细胞实验 |
体外检测。[2]
检测E6446对寡核苷酸1668、R848或ssRNA刺激下新鲜分离的人外周血单个核细胞或BALB/c小鼠脾脏IL-6产生的抑制作用。在加入刺激物之前,将该化合物加入解离的细胞中[完全RPMI/10%(体积/体积)中每孔5×105]。刺激细胞72小时,取出上清液进行IL-6的ELISA分析。 细胞因子分析。[2] 在C57BL/6小鼠腹腔感染105株经E6446处理或未经E6446治疗的p.chabaudi或p.berghei iRBC的血清或培养脾细胞上清液中评估细胞因子。每个实验重复两到三次。每只动物都单独进行了分析。在实验感染过程中,脾脏被无菌地取出,并通过尼龙网浸渍。红细胞裂解后,脾细胞以每毫升2.5×106个细胞的密度重新悬浮在RPMI、10%(体积/体积)FCS和1%庆大霉素中。随后,在Con a、高纯度LPS或CpG ODN的存在下,将脾细胞在48孔板中培养48小时,最终体积为1毫升。使用市售ELISA试剂盒进行细胞因子的测量。使用CBA炎症试剂盒对感染P.chabaudi的小鼠的血清细胞因子进行定量。 细胞因子的细胞内染色。[2] 在用105个PbA-iRBCs感染后第6天,采集用或不用E6446治疗的小鼠脾脏,并根据制造商的说明使用CD11c微珠分离CD11c+脾脏DCs。细胞(5×105)用2.4G2单克隆抗体进行Fc阻断,并用氟偶联的抗CD11c、Cy5偶联的抗小鼠MHCII和藻红蛋白(PE)偶联的抗鼠CD40、CD86和CD80单克隆抗体标记。使用非相关IgG单克隆抗体作为染色特异性的对照。对于细胞因子的细胞内分析,用BD Cytofix/Cytoperm固定和渗透细胞,并使用PE偶联的抗小鼠单克隆抗体 对细胞内TNF-α、IL-12 p40/p70水平进行染色。使用Flowjo软件分析数据。 细胞培养[3] 在37°C和5%CO2条件下,将小鼠OP9细胞培养在添加了5%胎牛血清(FBS)和1%青霉素-链霉素的MEM中。在37°C和5%CO2条件下,将小鼠AML12细胞在添加了5%胎牛血清(FBS)和1%青霉素-链霉素的Dulbecco改良Eagle培养基(DMEM)/营养混合物F-12中培养。除非另有说明,否则每3天更换一次培养基。为了诱导脂肪生成分化,在含有5%FBS的DMEM中用1μM罗格列酮刺激100%融合的OP9前脂肪细胞15天。当OP9细胞生长到90%融合时,1μM罗格列酮在含有5%FBS的DMEM中诱导脂肪分化15天,含或不含10μME6446。为了建立肝脂肪变性模型,用指定浓度的棕榈酸(PA;0.125 mM)和油酸(OA;0.25 mM)刺激小鼠AML12细胞48小时,可加或不加10μM的E6446。 乳酸脱氢酶(LDH)测定[3] 将AML12或OP9细胞接种到96孔板中,用0、10、2、0.4、0.08μM的E6446或A939572与棕榈酸(PA;0.125 mM)和油酸(OA;0.25 mM)处理48小时。使用商业试剂盒 测量AML12细胞中的LDH水平。 CCK8测定[3] 将AML12或OP9细胞接种到96孔板中,用0、10、2、0.4、0.08μME6446或A939572与棕榈酸(PA;0.125 mM)和油酸(OA;0.25 mM)处理48小时。接下来,加入10μL CCK8溶液,在37°C下与5%CO2孵育2小时。使用酶标仪测量450 nm处的吸光度。 |
| 动物实验 |
Drug and Treatment. [2]
The compound E6446-02 was dissolved in water, and its concentrations were adjusted so that the final dose in body weight (mg/kg) was given in 0.1 mL. Mice treated with vehicle (water) were used as a control group. The animals were treated through oral gavage once daily at the dose stated for several days postinfection. The drug was administered 24 h before infection. Experimental animals [3] Male C57BL/6J mice (8 weeks old, weighing 21 ± 2 g) were housed at room temperature, 12-h light–dark cycle, with free access to food and water. The mice were divided into 3 experimental groups: normal control diet group (NCD; chow diet, 10% of calories derived from fat), high-fat diet (HFD, 60% of calories derived from fat) + Vehicle group, and HFD + E6446 group. After 12 weeks, mice were three times in a week oral gavage with Vehicle or 20 mg/kg E6446 for 6 weeks. The body weight was measured weekly during oral gavage experimental phases. Mice were sacrificed through isoflurane inhalation, and then blood, adipose, and liver samples were collected for further analysis. |
| 参考文献 |
|
| 其他信息 |
The discovery that circulating nucleic acid-containing complexes in the serum of autoimmune lupus patients can stimulate B cells and plasmacytoid dendritic cells via Toll-like receptors 7 and 9 suggested that agents that block these receptors might be useful therapeutics. We identified two compounds, AT791 {3-[4-(6-(3-(dimethylamino)propoxy)benzo[d]oxazol-2-yl)phenoxy]-N,N-dimethylpropan-1-amine} and E6446 {6-[3-(pyrrolidin-1-yl)propoxy)-2-(4-(3-(pyrrolidin-1-yl)propoxy)phenyl]benzo[d]oxazole}, that inhibit Toll-like receptor (TLR)7 and 9 signaling in a variety of human and mouse cell types and inhibit DNA-TLR9 interaction in vitro. When administered to mice, these compounds suppress responses to challenge doses of cytidine-phosphate-guanidine (CpG)-containing DNA, which stimulates TLR9. When given chronically in spontaneous mouse lupus models, E6446 slowed development of circulating antinuclear antibodies and had a modest effect on anti-double-stranded DNA titers but showed no observable impact on proteinuria or mortality. We discovered that the ability of AT791 and E6446 to inhibit TLR7 and 9 signaling depends on two properties: weak interaction with nucleic acids and high accumulation in the intracellular acidic compartments where TLR7 and 9 reside. Binding of the compounds to DNA prevents DNA-TLR9 interaction in vitro and modulates signaling in vivo. Our data also confirm an earlier report that this same mechanism may explain inhibition of TLR7 and 9 signaling by hydroxychloroquine (Plaquenil; Sanofi-Aventis, Bridgewater, NJ), a drug commonly prescribed to treat lupus. Thus, very different structural classes of molecules can inhibit endosomal TLRs by essentially identical mechanisms of action, suggesting a general mechanism for targeting this group of TLRs. [1]
Excessive release of proinflammatory cytokines by innate immune cells is an important component of the pathogenic basis of malaria. Proinflammatory cytokines are a direct output of Toll-like receptor (TLR) activation during microbial infection. Thus, interference with TLR function is likely to render a better clinical outcome by preventing their aberrant activation and the excessive release of inflammatory mediators. Herein, we describe the protective effect and mechanism of action of E6446, a synthetic antagonist of nucleic acid-sensing TLRs, on experimental cerebral malaria (ECM) induced by Plasmodium berghei ANKA. We show that in vitro, low doses of E6446 specifically inhibited the activation of human and mouse TLR9. Tenfold higher concentrations of this compound also inhibited the human TLR8 response to single-stranded RNA. In vivo, therapy with E6446 diminished the activation of TLR9 and prevented the exacerbated cytokine response observed during acute Plasmodium infection. Furthermore, severe signs of ECM, such as limb paralysis, brain vascular leak, and death, were all prevented by oral treatment with E6446. Hence, we provide evidence that supports the involvement of nucleic acid-sensing TLRs in malaria pathogenesis and that interference with the activation of these receptors is a promising strategy to prevent deleterious inflammatory responses that mediate pathogenesis and severity of malaria. [2] Due to the complexity and incomplete understanding of the crosstalk between liver and adipose tissue, especially the processes of hepatic lipogenesis and adipogenic differentiation, there are currently no effective drugs for the treatment of nonalcoholic fatty liver disease (NAFLD). Stearoyl-coenzyme A desaturase 1 (SCD1), which is abundantly expressed in liver and adipose tissue, may mediate the cross-talk between liver and adipose tissue. Thus, it is essential to develop specific SCD1 inhibitors that target the liver-adipose axis. Herein, we identified a novel SCD1 inhibitor, E6446, through a high-throughput virtual screen. E6646 significantly inhibited adipogenic differentiation and hepatic lipogenesis via SCD1-ATF3 signaling. The SPR results showed that E6446 had a strong interaction ability with SCD1 (KD:4.61 μM). Additionally, E6646 significantly decreased hepatic steatosis, hepatic lipid droplet accumulation and insulin resistance in high-fat diet (HFD)-fed mice. Taken together, our findings not only suggest that E6446 can serve as a new, safe and highly effective anti-NAFLD agent for future clinical use but also provide a molecular basis for the future development of SCD1 inhibitors that inhibit both adipogenic differentiation and hepatic lipogenesis. [3] |
| 分子式 |
C27H35N3O3
|
|---|---|
| 分子量 |
449.595
|
| 精确质量 |
449.268
|
| 元素分析 |
C, 72.13; H, 7.85; N, 9.35; O, 10.68
|
| CAS号 |
1219925-73-1
|
| 相关CAS号 |
E6446 dihydrochloride;1345675-25-3
|
| PubChem CID |
45102599
|
| 外观&性状 |
Solid powder
|
| LogP |
5.1
|
| tPSA |
50.97
|
| 氢键供体(HBD)数目 |
0
|
| 氢键受体(HBA)数目 |
6
|
| 可旋转键数目(RBC) |
11
|
| 重原子数目 |
33
|
| 分子复杂度/Complexity |
559
|
| 定义原子立体中心数目 |
0
|
| SMILES |
O(C1=CC=C2C(=C1)OC(C1C=CC(=CC=1)OCCCN1CCCC1)=N2)CCCN1CCCC1
|
| InChi Key |
YMYJXFUPMPMETB-UHFFFAOYSA-N
|
| InChi Code |
InChI=1S/C27H35N3O3/c1-2-14-29(13-1)17-5-19-31-23-9-7-22(8-10-23)27-28-25-12-11-24(21-26(25)33-27)32-20-6-18-30-15-3-4-16-30/h7-12,21H,1-6,13-20H2
|
| 化学名 |
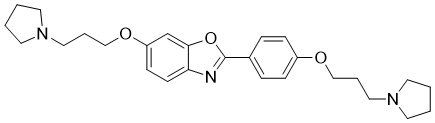
6-(3-pyrrolidin-1-ylpropoxy)-2-[4-(3-pyrrolidin-1-ylpropoxy)phenyl]-1,3-benzoxazole
|
| 别名 |
E-6446; E 6446; 1219925-73-1; 6-(3-(pyrrolidin-1-yl)propoxy)-2-(4-(3-(pyrrolidin-1-yl)propoxy)phenyl)benzo[d]oxazole; CHEMBL4065452; 6-(3-pyrrolidin-1-ylpropoxy)-2-[4-(3-pyrrolidin-1-ylpropoxy)phenyl]-1,3-benzoxazole; SCHEMBL12396763; E6446
|
| HS Tariff Code |
2934.99.9001
|
| 存储方式 |
Powder -20°C 3 years 4°C 2 years In solvent -80°C 6 months -20°C 1 month |
| 运输条件 |
Room temperature (This product is stable at ambient temperature for a few days during ordinary shipping and time spent in Customs)
|
| 溶解度 (体外实验) |
May dissolve in DMSO (in most cases), if not, try other solvents such as H2O, Ethanol, or DMF with a minute amount of products to avoid loss of samples
|
|---|---|
| 溶解度 (体内实验) |
注意: 如下所列的是一些常用的体内动物实验溶解配方,主要用于溶解难溶或不溶于水的产品(水溶度<1 mg/mL)。 建议您先取少量样品进行尝试,如该配方可行,再根据实验需求增加样品量。
注射用配方
注射用配方1: DMSO : Tween 80: Saline = 10 : 5 : 85 (如: 100 μL DMSO → 50 μL Tween 80 → 850 μL Saline)(IP/IV/IM/SC等) *生理盐水/Saline的制备:将0.9g氯化钠/NaCl溶解在100 mL ddH ₂ O中,得到澄清溶液。 注射用配方 2: DMSO : PEG300 :Tween 80 : Saline = 10 : 40 : 5 : 45 (如: 100 μL DMSO → 400 μL PEG300 → 50 μL Tween 80 → 450 μL Saline) 注射用配方 3: DMSO : Corn oil = 10 : 90 (如: 100 μL DMSO → 900 μL Corn oil) 示例: 以注射用配方 3 (DMSO : Corn oil = 10 : 90) 为例说明, 如果要配制 1 mL 2.5 mg/mL的工作液, 您可以取 100 μL 25 mg/mL 澄清的 DMSO 储备液,加到 900 μL Corn oil/玉米油中, 混合均匀。 View More
注射用配方 4: DMSO : 20% SBE-β-CD in Saline = 10 : 90 [如:100 μL DMSO → 900 μL (20% SBE-β-CD in Saline)] 口服配方
口服配方 1: 悬浮于0.5% CMC Na (羧甲基纤维素钠) 口服配方 2: 悬浮于0.5% Carboxymethyl cellulose (羧甲基纤维素) 示例: 以口服配方 1 (悬浮于 0.5% CMC Na)为例说明, 如果要配制 100 mL 2.5 mg/mL 的工作液, 您可以先取0.5g CMC Na并将其溶解于100mL ddH2O中,得到0.5%CMC-Na澄清溶液;然后将250 mg待测化合物加到100 mL前述 0.5%CMC Na溶液中,得到悬浮液。 View More
口服配方 3: 溶解于 PEG400 (聚乙二醇400) 请根据您的实验动物和给药方式选择适当的溶解配方/方案: 1、请先配制澄清的储备液(如:用DMSO配置50 或 100 mg/mL母液(储备液)); 2、取适量母液,按从左到右的顺序依次添加助溶剂,澄清后再加入下一助溶剂。以 下列配方为例说明 (注意此配方只用于说明,并不一定代表此产品 的实际溶解配方): 10% DMSO → 40% PEG300 → 5% Tween-80 → 45% ddH2O (或 saline); 假设最终工作液的体积为 1 mL, 浓度为5 mg/mL: 取 100 μL 50 mg/mL 的澄清 DMSO 储备液加到 400 μL PEG300 中,混合均匀/澄清;向上述体系中加入50 μL Tween-80,混合均匀/澄清;然后继续加入450 μL ddH2O (或 saline)定容至 1 mL; 3、溶剂前显示的百分比是指该溶剂在最终溶液/工作液中的体积所占比例; 4、 如产品在配制过程中出现沉淀/析出,可通过加热(≤50℃)或超声的方式助溶; 5、为保证最佳实验结果,工作液请现配现用! 6、如不确定怎么将母液配置成体内动物实验的工作液,请查看说明书或联系我们; 7、 以上所有助溶剂都可在 Invivochem.cn网站购买。 |
| 制备储备液 | 1 mg | 5 mg | 10 mg | |
| 1 mM | 2.2242 mL | 11.1210 mL | 22.2420 mL | |
| 5 mM | 0.4448 mL | 2.2242 mL | 4.4484 mL | |
| 10 mM | 0.2224 mL | 1.1121 mL | 2.2242 mL |
1、根据实验需要选择合适的溶剂配制储备液 (母液):对于大多数产品,InvivoChem推荐用DMSO配置母液 (比如:5、10、20mM或者10、20、50 mg/mL浓度),个别水溶性高的产品可直接溶于水。产品在DMSO 、水或其他溶剂中的具体溶解度详见上”溶解度 (体外)”部分;
2、如果您找不到您想要的溶解度信息,或者很难将产品溶解在溶液中,请联系我们;
3、建议使用下列计算器进行相关计算(摩尔浓度计算器、稀释计算器、分子量计算器、重组计算器等);
4、母液配好之后,将其分装到常规用量,并储存在-20°C或-80°C,尽量减少反复冻融循环。
计算结果:
工作液浓度: mg/mL;
DMSO母液配制方法: mg 药物溶于 μL DMSO溶液(母液浓度 mg/mL)。如该浓度超过该批次药物DMSO溶解度,请首先与我们联系。
体内配方配制方法:取 μL DMSO母液,加入 μL PEG300,混匀澄清后加入μL Tween 80,混匀澄清后加入 μL ddH2O,混匀澄清。
(1) 请确保溶液澄清之后,再加入下一种溶剂 (助溶剂) 。可利用涡旋、超声或水浴加热等方法助溶;
(2) 一定要按顺序加入溶剂 (助溶剂) 。