| 规格 | 价格 | 库存 | 数量 |
|---|---|---|---|
| 25mg |
|
||
| 500mg | |||
| 1g | |||
| Other Sizes |
| 靶点 |
- JPH203 selectively targets L-type amino acid transporter 1 (LAT1, SLC7A5), with an IC50 of 1.6 μM for [³H]-leucine uptake inhibition in YD-38 human oral cancer cells[2]
- It showed no significant inhibition of other amino acid transporters (e.g., LAT2, ASCT2) at concentrations up to 10 μM[4] - In Saos2 human osteosarcoma cells, JPH203 inhibited LAT1-mediated [³H]-phenylalanine uptake with an IC50 of 2.1 μM[3] |
|---|---|
| 体外研究 (In Vitro) |
JPH203 是 LAT1 的选择性抑制剂。 JPH203 (KYT-0353) 抑制 S2-hLAT1 和 HT-29 细胞中 14C-亮氨酸的摄取,IC50 分别为 0.14 μM 和 0.06 μM。 JPH203 (3-1000 μM) 对 S2-hLAT1 细胞生长具有浓度依赖性抑制作用,IC50 为 16.4 μM。 JPH203 还表现出对 HT-29 细胞生长的抑制活性,IC50 值为 4.1 μM[1]。 JPH203 (0.001-100 μM) 以浓度依赖性方式抑制 YD-38 细胞对 14C-亮氨酸 (1.0 μM) 的摄取,IC50 值为 0.79 ± 0.06 μM。 JPH203 在正常人口腔角质形成细胞 (NHOK) 中轻微显示出这种作用。 JPH203(0.01-30 mM,1-4 d)以剂量和时间依赖性方式完全抑制 YD-38 细胞的增殖。然而,JPH203 轻微抑制 NHOK 的增殖。 JPH203 (30 mM) 诱导 YD-38 细胞凋亡。 JPH203 (3 mM) 还可以提高半胱天冬酶级联激活中裂解的 PARP 的水平[2]。 JPH203 (30 mM) 在 Saos2 人骨肉瘤细胞中诱导线粒体依赖性细胞凋亡。 JPH203 (0.001-100 µM) 轻微抑制 FOB 细胞中 14C-亮氨酸 (1.0 µM) 的摄取,IC50 值为 92.12 ± 10.71 µM,但在 Saos2 细胞中有效表现出这种作用,IC50 值为 1.31 ± 0.27 µM。 JPH203(0.01 至 30 mM,1-4 d)以剂量和时间依赖性方式有效抑制 Saos2 细胞的细胞增殖,IC50 为 4.09-0.09 mM,但轻微抑制 FOB 细胞的增殖,IC50 为24.1-2.8 mM[3]。
- 抗增殖活性: - 在YD-38细胞中,JPH203 呈剂量依赖性抑制细胞增殖,72小时MTT实验显示其IC50为2.3 μM[2] - 在Saos2细胞中,72小时WST-8实验显示,2.8 μM JPH203 可使细胞活力降低50%[3] - 在正常人牙龈成纤维细胞中,JPH203 无显著抗增殖作用(IC50 > 20 μM)[4] - 凋亡诱导: - 在YD-38细胞中,5 μM JPH203 处理48小时后,Annexin V阳性细胞比例增加35%(流式细胞术),且剪切型caspase-3(2.5倍)和剪切型PARP(3倍)表达上调(Western blot)[2] - 在Saos2细胞中,JPH203 诱导线粒体依赖性凋亡:5 μM JPH203 使线粒体膜电位(ΔΨm)降低40%,Bax表达上调2.2倍,Bcl-2表达下调0.4倍[3] - 在YD-38细胞中,5 μM JPH203 处理48小时还使亚G1期细胞比例(凋亡标志物)从3%升至28%(流式细胞术)[4] - 代谢与信号影响: - 5 μM JPH203 处理YD-38细胞24小时,可使细胞内亮氨酸水平降低60%、谷氨酰胺水平降低45%[2] - 在Saos2细胞中,JPH203 抑制mTORC1信号通路,5 μM时磷酸化S6K1(Thr389)水平降低50%[3] - 在YD-38细胞中,5 μM JPH203 处理24小时后,磷酸化4E-BP1(Ser65)水平降低40%,提示mTORC1失活[4] |
| 体内研究 (In Vivo) |
JPH203(6.3、12.5 和 25.0 mg/kg,静脉注射 14 天)对裸鼠中 HT-29 肿瘤生长表现出剂量依赖性抑制作用[1]。
- 在携带YD-38移植瘤的裸鼠中,腹腔注射JPH203(10 mg/kg/天,21天),肿瘤体积较载体对照组减少42%,肿瘤重量减少38%[2] - 在Saos2移植瘤裸鼠中,口服JPH203(20 mg/kg/天,14天),肿瘤生长抑制率达35%,且未引起小鼠体重显著下降[3] - 腹腔注射JPH203(10 mg/kg)后24小时,YD-38移植瘤内亮氨酸水平降低55%[4] - 在YD-38移植瘤裸鼠中,JPH203 处理(10 mg/kg/天,腹腔注射)还降低了肿瘤内mTORC1活性,肿瘤切片免疫组化显示磷酸化S6(Ser235/236)染色减弱[2] |
| 酶活实验 |
- LAT1介导的氨基酸摄取实验(YD-38细胞):
- 将YD-38细胞接种于24孔板,37°C下用JPH203(0.1-20 μM)预孵育30分钟。
- 向每孔加入[³H]-亮氨酸(终浓度1 μCi/mL),孵育10分钟。
- 用冰PBS洗涤细胞3次,0.1 N NaOH裂解细胞,液体闪烁计数法检测放射性,通过剂量-反应曲线计算IC50[2]
- LAT1介导的氨基酸摄取实验(Saos2细胞): - 将Saos2细胞接种于24孔板,37°C下用JPH203(0.1-20 μM)预孵育30分钟。 - 向每孔加入[³H]-苯丙氨酸(终浓度1 μCi/mL),孵育10分钟。 - 用冰PBS洗涤细胞3次,0.1 N NaOH裂解细胞,液体闪烁计数法检测放射性,通过剂量-反应曲线计算IC50[3] - LAT1选择性实验: - 用JPH203(0.1-10 μM)处理表达LAT2的正常人成纤维细胞,按上述方法检测[³H]-亮氨酸摄取,未观察到显著抑制,证实其LAT1选择性[4] |
| 细胞实验 |
- 细胞活力实验(MTT,YD-38细胞):
- 将YD-38细胞(5×10³/孔)接种于96孔板,用JPH203(0.1-20 μM)处理72小时。
- 加入MTT试剂(5 mg/mL)孵育4小时,在570 nm处检测吸光度,以载体组为对照计算相对细胞活力[2]
- 细胞活力实验(WST-8,Saos2细胞): - 将Saos2细胞(3×10³/孔)接种于96孔板,用JPH203(0.1-20 μM)处理72小时。 - 加入WST-8试剂孵育4小时,在450 nm处检测吸光度,以载体组为对照计算相对细胞活力[3] - 凋亡检测(Annexin V/PI双染,YD-38细胞): - YD-38细胞用5 μM JPH203处理48小时,收集细胞后用Annexin V-FITC和碘化丙啶(PI)避光染色15分钟。 - 流式细胞术定量凋亡细胞(Annexin V阳性/PI阴性或Annexin V阳性/PI阳性)[4] - 凋亡/信号蛋白Western blot实验(Saos2细胞): - Saos2细胞用JPH203(1-10 μM)处理24-48小时,RIPA缓冲液裂解细胞并测定蛋白浓度。 - 等量蛋白经SDS-PAGE分离后转移至PVDF膜,用抗剪切型caspase-3、剪切型PARP、Bax、Bcl-2或磷酸化S6K1抗体孵育,GAPDH作为内参[3] |
| 动物实验 |
- YD-38 oral cancer xenograft model (intraperitoneal administration):
- Female nude mice (6-8 weeks old) were subcutaneously injected with 5×10⁶ YD-38 cells into the right flank.
- When tumors reached ~100 mm³, mice were randomized to vehicle (0.1% DMSO + 5% Tween 80 in saline) or JPH203 groups. JPH203 was administered intraperitoneally at 10 mg/kg once daily for 21 days.
- Tumor volume (measured by calipers: V = 0.5 × length × width²) and body weight were recorded every 3 days. At the end of treatment, tumors were excised and weighed[2]
- Saos2 osteosarcoma xenograft model (oral administration): - Male nude mice were implanted with 1×10⁷ Saos2 cells subcutaneously. - JPH203 was suspended in 0.5% methylcellulose and administered orally at 20 mg/kg once daily for 14 days (starting when tumors were ~150 mm³). - Tumor growth inhibition rate was calculated as [(vehicle tumor volume - treatment tumor volume)/vehicle tumor volume] × 100%[3] - YD-38 xenograft model (intratumoral amino acid measurement): - Female nude mice with YD-38 xenografts (~200 mm³) were administered JPH203 (10 mg/kg, i.p.) or vehicle. - 24 hours post-administration, tumors were excised, homogenized, and intracellular leucine levels were measured by high-performance liquid chromatography (HPLC)[4] |
| 毒性/毒理 (Toxicokinetics/TK) |
- In vitro toxicity (normal cells): JPH203 showed low cytotoxicity to normal human gingival fibroblasts (IC50 > 20 μM) and normal human osteoblasts (IC50 > 25 μM)[2]
- In vivo toxicity (xenograft mice): In YD-38 xenograft mice, JPH203 (10 mg/kg/day, i.p., 21 days) did not cause significant mouse body weight loss (>5%) or abnormal behavior (e.g., lethargy, reduced food intake)[4] - In vivo toxicity (Saos2 xenograft mice): In Saos2 xenograft mice, JPH203 (20 mg/kg/day, oral, 14 days) did not affect serum levels of alanine transaminase (ALT) or aspartate transaminase (AST) (liver function markers) or creatinine (kidney function marker)[3] |
| 参考文献 |
|
| 其他信息 |
- JPH203 is a first-in-class selective LAT1 inhibitor; LAT1 is overexpressed in various cancers (e.g., oral cancer, osteosarcoma) and critical for tumor cell amino acid uptake and mTORC1 activation[1]
- Its antitumor mechanism involves LAT1 inhibition → intracellular amino acid depletion → mTORC1 inactivation → mitochondria-dependent apoptosis[3] - JPH203 was shown to enhance the efficacy of cisplatin in YD-38 cells: co-treatment with 2 μM JPH203 and 5 μM cisplatin reduced cell viability by 65%, compared to 30% with cisplatin alone[2] - In preclinical studies, JPH203 demonstrated tumor-specific activity, with minimal effects on normal tissues due to LAT1's low expression in most normal cells[4] KYT 0353 is a potent and selective inhibitor of L-type amino acid transporter 1 (LAT1). |
| 分子式 |
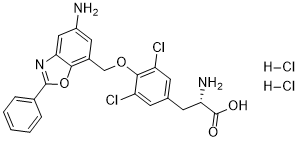
C23H20CL3N3O4
|
|---|---|
| 分子量 |
545.238
|
| 精确质量 |
545.025
|
| 元素分析 |
C, 50.67; H, 3.88; Cl, 26.01; N, 7.71; O, 11.74
|
| CAS号 |
1597402-27-1
|
| 相关CAS号 |
1597402-27-1 (2HCl);1037592-40-7;1597402-28-2 (complex with beta cyclodextrin);
|
| PubChem CID |
122553374
|
| 外观&性状 |
Typically exists as solid at room temperature
|
| tPSA |
125
|
| 氢键供体(HBD)数目 |
5
|
| 氢键受体(HBA)数目 |
7
|
| 可旋转键数目(RBC) |
7
|
| 重原子数目 |
34
|
| 分子复杂度/Complexity |
626
|
| 定义原子立体中心数目 |
1
|
| SMILES |
C1=CC=C(C=C1)C2=NC3=CC(=CC(=C3O2)COC4=C(C=C(C=C4Cl)C[C@@H](C(=O)O)N)Cl)N.Cl.Cl
|
| InChi Key |
MJSAOPNUSNNYQL-NTEVMMBTSA-N
|
| InChi Code |
InChI=1S/C23H19Cl2N3O4.2ClH/c24-16-6-12(8-18(27)23(29)30)7-17(25)21(16)31-11-14-9-15(26)10-19-20(14)32-22(28-19)13-4-2-1-3-5-13;;/h1-7,9-10,18H,8,11,26-27H2,(H,29,30);2*1H/t18-;;/m0../s1
|
| 化学名 |
(2S)-2-amino-3-[4-[(5-amino-2-phenyl-1,3-benzoxazol-7-yl)methoxy]-3,5-dichlorophenyl]propanoic acid;dihydrochloride
|
| 别名 |
JPH203 HCl; KYT 0353; JPH203; KYT-0353; JPH-203; JPH 203; KYT0353.
|
| HS Tariff Code |
2934.99.9001
|
| 存储方式 |
Powder -20°C 3 years 4°C 2 years In solvent -80°C 6 months -20°C 1 month |
| 运输条件 |
Room temperature (This product is stable at ambient temperature for a few days during ordinary shipping and time spent in Customs)
|
| 溶解度 (体外实验) |
May dissolve in DMSO (in most cases), if not, try other solvents such as H2O, Ethanol, or DMF with a minute amount of products to avoid loss of samples
|
|---|---|
| 溶解度 (体内实验) |
注意: 如下所列的是一些常用的体内动物实验溶解配方,主要用于溶解难溶或不溶于水的产品(水溶度<1 mg/mL)。 建议您先取少量样品进行尝试,如该配方可行,再根据实验需求增加样品量。
注射用配方
注射用配方1: DMSO : Tween 80: Saline = 10 : 5 : 85 (如: 100 μL DMSO → 50 μL Tween 80 → 850 μL Saline)(IP/IV/IM/SC等) *生理盐水/Saline的制备:将0.9g氯化钠/NaCl溶解在100 mL ddH ₂ O中,得到澄清溶液。 注射用配方 2: DMSO : PEG300 :Tween 80 : Saline = 10 : 40 : 5 : 45 (如: 100 μL DMSO → 400 μL PEG300 → 50 μL Tween 80 → 450 μL Saline) 注射用配方 3: DMSO : Corn oil = 10 : 90 (如: 100 μL DMSO → 900 μL Corn oil) 示例: 以注射用配方 3 (DMSO : Corn oil = 10 : 90) 为例说明, 如果要配制 1 mL 2.5 mg/mL的工作液, 您可以取 100 μL 25 mg/mL 澄清的 DMSO 储备液,加到 900 μL Corn oil/玉米油中, 混合均匀。 View More
注射用配方 4: DMSO : 20% SBE-β-CD in Saline = 10 : 90 [如:100 μL DMSO → 900 μL (20% SBE-β-CD in Saline)] 口服配方
口服配方 1: 悬浮于0.5% CMC Na (羧甲基纤维素钠) 口服配方 2: 悬浮于0.5% Carboxymethyl cellulose (羧甲基纤维素) 示例: 以口服配方 1 (悬浮于 0.5% CMC Na)为例说明, 如果要配制 100 mL 2.5 mg/mL 的工作液, 您可以先取0.5g CMC Na并将其溶解于100mL ddH2O中,得到0.5%CMC-Na澄清溶液;然后将250 mg待测化合物加到100 mL前述 0.5%CMC Na溶液中,得到悬浮液。 View More
口服配方 3: 溶解于 PEG400 (聚乙二醇400) 请根据您的实验动物和给药方式选择适当的溶解配方/方案: 1、请先配制澄清的储备液(如:用DMSO配置50 或 100 mg/mL母液(储备液)); 2、取适量母液,按从左到右的顺序依次添加助溶剂,澄清后再加入下一助溶剂。以 下列配方为例说明 (注意此配方只用于说明,并不一定代表此产品 的实际溶解配方): 10% DMSO → 40% PEG300 → 5% Tween-80 → 45% ddH2O (或 saline); 假设最终工作液的体积为 1 mL, 浓度为5 mg/mL: 取 100 μL 50 mg/mL 的澄清 DMSO 储备液加到 400 μL PEG300 中,混合均匀/澄清;向上述体系中加入50 μL Tween-80,混合均匀/澄清;然后继续加入450 μL ddH2O (或 saline)定容至 1 mL; 3、溶剂前显示的百分比是指该溶剂在最终溶液/工作液中的体积所占比例; 4、 如产品在配制过程中出现沉淀/析出,可通过加热(≤50℃)或超声的方式助溶; 5、为保证最佳实验结果,工作液请现配现用! 6、如不确定怎么将母液配置成体内动物实验的工作液,请查看说明书或联系我们; 7、 以上所有助溶剂都可在 Invivochem.cn网站购买。 |
| 制备储备液 | 1 mg | 5 mg | 10 mg | |
| 1 mM | 1.8341 mL | 9.1703 mL | 18.3405 mL | |
| 5 mM | 0.3668 mL | 1.8341 mL | 3.6681 mL | |
| 10 mM | 0.1834 mL | 0.9170 mL | 1.8341 mL |
1、根据实验需要选择合适的溶剂配制储备液 (母液):对于大多数产品,InvivoChem推荐用DMSO配置母液 (比如:5、10、20mM或者10、20、50 mg/mL浓度),个别水溶性高的产品可直接溶于水。产品在DMSO 、水或其他溶剂中的具体溶解度详见上”溶解度 (体外)”部分;
2、如果您找不到您想要的溶解度信息,或者很难将产品溶解在溶液中,请联系我们;
3、建议使用下列计算器进行相关计算(摩尔浓度计算器、稀释计算器、分子量计算器、重组计算器等);
4、母液配好之后,将其分装到常规用量,并储存在-20°C或-80°C,尽量减少反复冻融循环。
计算结果:
工作液浓度: mg/mL;
DMSO母液配制方法: mg 药物溶于 μL DMSO溶液(母液浓度 mg/mL)。如该浓度超过该批次药物DMSO溶解度,请首先与我们联系。
体内配方配制方法:取 μL DMSO母液,加入 μL PEG300,混匀澄清后加入μL Tween 80,混匀澄清后加入 μL ddH2O,混匀澄清。
(1) 请确保溶液澄清之后,再加入下一种溶剂 (助溶剂) 。可利用涡旋、超声或水浴加热等方法助溶;
(2) 一定要按顺序加入溶剂 (助溶剂) 。