| 规格 | 价格 | 库存 | 数量 |
|---|---|---|---|
| 1mg |
|
||
| 5mg |
|
||
| 10mg |
|
||
| 50mg |
|
||
| 100mg |
|
||
| Other Sizes |
| 靶点 |
α7 nAChR (Ki = 8.8 nM)[1]
|
|---|---|
| 体外研究 (In Vitro) |
N-[(3R)-1-氮杂二环[2.2.2]辛-3-基]呋喃并[2,3-c]吡啶-5-甲酰胺(14,PHA-543613)是α7神经元烟碱型乙酰胆碱受体(α7nAChR)的新型激动剂,已被确定为治疗精神分裂症认知缺陷的潜在方法。化合物14是一种强效且选择性的α7nAChR激动剂,具有出色的体外特性。[1]
化合物2、10、11、13和14(PHA-543613)在2和20μM的膜片钳hERG K+通道测定中进行了评估。28苯并噻吩10抑制hERG的水平与2相似。根据2.12的有效药物浓度,这些抑制水平被认为很高。19苯并呋喃11和13以及呋喃吡啶14在20μM时都显示出hERG抑制降低,这可能是用亲脂性较低的氧原子取代硫原子的结果。29为了进一步评估与hERG钾通道的相互作用,确定了2和14的浓度响应曲线。与筛选数据一致,14在抑制hERG通道介导的电流方面效果较差。虽然14在最高测试浓度20μM下产生的阻断不足以建立IC50,但将该浓度下产生的拮抗(14为29%)外推到2的拟合曲线表明,阻断hERG的效力至少降低了10倍[1]。 |
| 体内研究 (In Vivo) |
PHA-543613(0.3 mg/kg)可有效纠正东莨菪碱引起的短期记忆障碍[2]。 PHA-543613(腹腔注射一次;4 和 12 mg/kg)可减少脑水肿和行为异常 [3]。
14(PHA-543613)的功能活性通过大鼠海马神经元的天然α7nAChRs得到证实(图2)。当快速应用于全细胞膜片钳配置中记录的神经元时,14会引起脱敏内向电流,这些电流具有浓度依赖性,并被选择性α7nAChR拮抗剂甲基乌头碱(MLA,10nM)完全抑制。在0.3、3和30μM下施加14引起的反应幅度分别为100μM(−)尼古丁施加到同一细胞引起的反应的34±1%、103±7%和220±22%。这些结果表明,在天然α7 nAChRs中,14的活性略高于2,12这与使用α7 5HT3嵌合体的结合试验和FLIPR试验中报告的效力增加是一致的。[3] 化合物14(PHA-543613)也在一个经过验证的感觉门控受损的啮齿动物模型中进行了测试。11,12给药d-苯丙胺(1mg/kg,iv)显著扰乱了麻醉大鼠海马CA3区的听觉门控(对应于人类P50听觉门控),因为条件反射同时降低,测试反应相应增加。37随后给药α7nAChR激动剂14(iv,0.3或1mg/kg)显著逆转了苯丙胺诱导的门控缺陷(图3)。相比之下,在对照组大鼠中应用赋形剂并没有使苯丙胺诱导的门控缺陷正常化(从47±5.5%到41±6.8%,n=9)。在另一项实验中,14在较高剂量(iv,10mg/kg)下也显著改善了苯丙胺给药后的听觉门控(从51±3.9%到68±3.9%,n=16,p<0.005)。静脉注射激动剂1和10 mg/kg后的脑浓度分别为0.56±0.039 nM和14.9±1.4μM,表明14在广泛的脑暴露范围内对听觉门控有效。临床前研究表明,α7 nAChR激动剂可有效恢复药理学、遗传学或环境诱导的门控缺陷。 |
| 酶活实验 |
体外检测的详细信息。[1]
反应性代谢物测定(RMA)。如前所述进行测定。46在甲醇中制备试验化合物的储备溶液。培养基中甲醇的最终浓度为0.2%(v/v)。在37°C的振荡水浴中孵育60分钟。孵育体积为1 mL,由以下物质组成:0.1 M磷酸钾缓冲液(pH 7.4)、人肝微粒体(P450浓度=0.5μM)、NADPH(1.2 mM)和底物(200μM)。在加入NADPH之前,将反应混合物在37°C下预热2分钟。在与NADPH反应开始3分钟后加入GSH-EE(2mM)。缺乏NADPH或GSH-EE的培养物作为阴性对照,通过加入冰冷的乙腈(1 mL)终止反应。将溶液离心(3000g,15分钟),并在稳定的氮气流下干燥上清液。残余物用流动相复溶,并通过液相色谱-串联质谱法(LC/MS/MS)分析代谢物的形成,如之前对其他外源性物质所述。 人肝微粒体稳定性测定(HLM)。[1] 底物(终浓度=1μM)在人肝微粒体(HL-mix-101,由59名个体供体制备,P450终浓度为0.25μM)和100 mM磷酸钾缓冲液(pH 7.4)中孵育。通过加入NADPH生成系统(0.5 mM NADP+、10.5 mM MgCl2、5.6 mM dl异柠檬酸和0.5 U/mL异柠檬酸脱氢酶)引发反应。之前描述了用于缩放到体内条件的方程。 大鼠肝微粒体稳定性测定(RLM)。[1] 检测方案与HLM检测相同,在孵育过程中仅使用大鼠肝微粒体(RL混合物142,由雌性Spraque-Dawley大鼠制备)。之前描述了用于缩放到体内条件的方程。 α7-5-HT3嵌合体、5-HT3、神经肌肉接头(α1β1γδ)和神经节(α3β4)nAChRs的功能性高通量筛选。[1] α7-5-HT3嵌合体和5-HT3受体在SH-EP1细胞中稳定表达。TE671和SH-SY5Y细胞分别用作神经肌肉接头和神经节nAChR的内源性来源。48所有功能性高通量筛选都是使用荧光成像板阅读器(FLIPR,Molecular Devices)进行钙通量测定。转染的SH-EP1细胞在含有非必需氨基酸的最低必需培养基(MEM)中生长,该培养基补充了10%胎牛血清、l-谷氨酰胺、100单位/mL青霉素/链霉素、250 ng/mL真菌素、400μg/mL潮霉素B和800μg/mL遗传霉素。根据已发表的方法培养TE671和SH-SY5Y细胞。所有细胞都在37°C的培养箱中生长,其中含有5-6%的二氧化碳。将细胞胰蛋白酶消化,并在96孔或384孔黑色/透明测定板上铺板。将细胞装入在无水二甲亚砜中制备的2mM钙绿-1AM(分子探针)和20%普朗尼克F-127(分子探针”)的1:1混合物中。将该试剂直接添加到每个孔的生长培养基中,以达到2μM钙绿-1 AM的最终浓度。然后将细胞在37°C下在染料中孵育1小时,然后在洗板机中洗涤两个周期。每个循环被编程为用Mark改良的Earle平衡盐溶液(MMEBSS)洗涤每个孔四次,该溶液由以下成分组成(单位为mM):CaCl2(4)、MgSO4(0.8)、NaCl(20)、KCl(5.3)、d-葡萄糖(5.6)、Tris-HPES(20)和N-甲基-d-葡糖胺(120),pH 7.4。在最后一个循环后,允许细胞在MMEBSS中在37°C下孵育至少10分钟。FLIPR被设置为使用500-600 mW的功率在488 nm处激发钙绿-1 AM,并读取525 nm以上的荧光发射。使用0.5或0.7秒的曝光来照亮每个孔。在30秒的基线记录后,将测试化合物从3或4倍储备溶液中加入到测定板的每个孔中。在加入测试化合物后,激动剂反应被评估为信号比基线增加。在一些实验中,通过在加入测试化合物2分钟后加入尼古丁(nAChRs)或血清素(5-HT3R),并测量与用赋形剂处理的孔相比对已知激动剂的反应损失,来评估拮抗剂活性。 脑匀浆结合试验([3H]MLA,[3H]金雀花碱,49[3H]GR65630)。[1] 雄性Sprague-Dawley大鼠(300-350g)被斩首处死,大脑(全脑减去小脑)被快速解剖、称重,并使用旋转杵在50℃下以每克湿重9倍体积的0.32M冰冷蔗糖均质化(10次上下敲击)。将匀浆在40°C下以1000g离心10分钟。收集上清液,在40°C下以20000g离心20分钟。将所得沉淀重新悬浮至蛋白质浓度为1-8mg/mL。将5mL匀浆的等分试样在-80°C下冷冻,直至需要进行测定。在测定当天,将等分试样在室温下解冻,并用Kreb的20 mM HEPES缓冲液稀释,pH 7.0(在室温下),该缓冲液含有4.16 mM NaHCO3、0.44 mM KH2PO4、127 mM NaCl、5.36 mM KCl、1.26 mM CaCl2和0.98 mM MgCl2,每个试管中加入25-150 mg蛋白质。以牛血清白蛋白为标准,采用Bradford法测定蛋白质浓度。对于α7,在1μM MLA存在下平行孵育并在放射性配体之前添加的组织中测定了非特异性结合,在竞争研究中,在添加约3 nM[3H]MLA(25 Ci/mmol)之前,将化合物以越来越高的浓度添加到试管中。对于α4,在放射性配体之前添加1 mM(−)-尼古丁的情况下平行孵育的组织中测定了非特异性结合,在竞争研究中,在添加约1.0 nM[3H]金雀花碱之前,将化合物以越来越高的浓度添加到试管中。对于5-HT3,在放射性配体之前添加1μM ICS-205930的情况下,在平行孵育的组织中测定非特异性结合,在竞争研究中,在添加约0.45 nM[3H]GR65630之前,将化合物以越来越高的浓度添加到试管中。对于所有结合试验,将0.4 mL匀浆加入含有缓冲液、试验化合物和放射性配体的试管中,并在25°C下以0.5 mL的最终体积孵育1小时。通过安装在48孔Brandel细胞采集器上的Whatman GF/B玻璃滤纸进行快速真空过滤,终止培养。将过滤器预浸在pH 7.0的50 mM Tris-HCl和0.05%聚乙烯亚胺中。用5mL等分的0.9%冷盐水洗涤过滤器两次,然后通过液体闪烁光谱法计算放射性。抑制常数(Ki)是通过将数据拟合到Cheng-Prusoff方程中获得的放射性配体结合的浓度依赖性抑制来计算的。 |
| 细胞实验 |
膜片钳电生理学。[1]
根据Brewer(1997)的方法,从Sprague-Dawley大鼠(出生后第3天)制备培养的神经元。将大鼠斩首处死,取出它们的大脑,放入冰冷的Hibernate-A培养基中。轻轻移除海马区,切成小块,在35°C下放入含有1mg/mL木瓜蛋白酶的Hibernate-A培养基中60分钟。消化后,将组织在Hibernate-A培养基中洗涤几次,并转移到含有6mL Hibernate-A培养基和2%B-27补充剂的50mL锥形管中。通过温和研磨将神经元分离,并以300-700个细胞/mm2的密度铺在聚-d-赖氨酸/层粘连蛋白包被的盖玻片上,然后转移到24孔组织培养板上,该培养板含有由Neurobase-a培养基、B-27补充剂(2%)、l-谷氨酰胺(0.5 mM)、100 U/mL青霉素、100 mg/mL链霉素和0.25 mg/mL真菌素组成的温热培养基。细胞在37°C和6%CO2的加湿培养箱中保持1-2周。24小时后更换培养基,然后大约每3天更换一次。使用Flaming/Brown微量移液器(P97,Sutter Instrument,Novato,CA)从硼硅酸盐毛细管玻璃中拔出贴片移液管,并填充由以下成分组成的内部移液管溶液:CsCH3SO3(126 mM)、CsCl(10 mM)、NaCl(4 mM)、MgCl2(1 mM)、CaCl2(0.5 mM)、EGTA(5 mM)、HEPES(10 mM,ATP−Mg(3 mM)、GTP−Na(0.3 mM)、磷酸肌酸(4 mM,pH 7.2)。当填充内部溶液时,贴片管的电阻在3至6 MΩ之间。。所有实验均在室温下进行。将培养的细胞连续用含有NaCl(140 mM)、KCl(5 mM)、CaCl2(2 mM)、MgCl2(1 mM)、HEPES(10 mM)、葡萄糖(10 mmol)、荷包牡丹碱(10μM)、CNQX(5μM)和D-AP-5(5μM)河豚毒素(0.5μM)的外部浴溶液进行超灌注,pH 7.4。将化合物溶解在水中或DMSO中,稀释到含有0.1%最终DMSO浓度的外部浴溶液中,并通过多管快速灌注系统输送。使用Axopatch 200B放大器记录全细胞电流。模拟信号以1/5的采样频率进行滤波,数字化、存储,并使用pCLAMP软件进行测量。所有数据均以平均值±SEM的形式报告。 hERG测定。[1] 简而言之,稳定表达hERG的HEK293细胞被电压钳制在-80 mV,并逐步去极化至+20 mV 2 s,然后每10 s去极化至-40 mV 2 s。电流振幅被测量为将膜踩至-40 mV时诱发的峰值向外电流。PNU-28987的浓度反应数据是根据已发表的方法使用稳定表达hERG-通道的CHO-K1细胞生成的。并监测诱发电流直到达到新的稳态振幅。根据以下公式,以百分比绘制电流抑制图 其中Itest是在存在测试溶液的情况下测量的电流,Icontrol是在暴露测试溶液之前测量的电流。每个细胞都有自己的控制。连续曲线根据以下公式确定 其中[化合物]是测试化合物的浓度,希尔斜率n被约束为1。所有数据均以平均值±标准差表示。 |
| 动物实验 |
Animal/Disease Models: Male CD-1 mice (cerebral hemorrhage) ICH induction or sham surgery [3]
Doses: 4 and 12 mg/kg Route of Administration: intraperitoneal (ip) injection; 4 and 12 mg/kg; Results 1 hour after surgery: p-Akt increased, p-GSK-3 and CC3 expression diminished in the ipsilateral hemisphere, and neuronal cell death diminished in the area around the hematoma. Behavioral deficits and brain edema were diminished 72 hrs (hrs (hours)) after ICH. Details of the in Vivo Assays. Auditory Gating Assay. [1] Experiments were performed on male Sprague-Dawley rats (weighing 250−300 g) under chloral hydrate anesthesia (400 mg/kg, ip). The femoral artery and vein were cannulated for monitoring arterial blood pressure and administration of drugs or additional doses of anesthetic, respectively. Unilateral hippocampal field potential (EEG) was recorded by a metal monopolar macroelectrode placed into the CA3 region (coordinates: 3.0−3.5 mm posterior from the bregma, 2.6−3.0 mm lateral, and 3.8−4.0 mm ventral; Paxinos and Watson, 1986).51 Field potentials were amplified, filtered (0.1−100 Hz), displayed, and recorded for on-line and off-line analysis (Spike3). Quantitative EEG analysis was performed by means of fast Fourier transformation (Spike3). The auditory stimulus consisted of a pair of 10 ms, 5 kHz tone bursts with a 0.5 s delay between the first “conditioning” stimulus and second “test” stimulus. Auditory-evoked responses were computed by averaging of responses to 50 pairs of stimuli presented with an interstimulus interval of 10 s. [1] Object Recognition Task. [1] Male Sprague-Dawley rats, weighing between 235 and 280 g (at test), were housed in pairs with free access to food and water on a 12-h light/dark cycle (dark period from 700 to 1900 h). Rats were housed on solid bottom cages with wood chip bedding. All procedures in this study have been approved and conducted in compliance with the Animal Welfare Act Regulations (CFR Parts 1−3) and the “Guide for the Care and Use of Laboratory Animals” (ILAR, 1996), as well as with all internal company policies and guidelines. All testing and object exposures were conducted in a 14 in. × 22 in. × 14 in. semitransparent MaxCart food bin. A clean sheet of cardboard-like Techboard was placed on the floor before each trial. The test arena was indirectly and uniformly illuminated at a low-intensity level of 10−12 Lux. A video camera affixed about 4 feet above the floor of the arena was connected to a monitor and VCR located several feet away from the visually shielded arena. Two types of objects were used in all drug tests reported here: a 500 mL clear Erlenmeyer glass flask and a 500 mL amber-colored bottle (3 in. × 2.25 in. × 8 in.) with a black cap (filled with water). These objects were cleaned after every trial by swabbing with a 70% alcohol solution. Two or more different sets of each object were used to allow air-drying for several minutes between tests.[1] A 3-day procedure similar to the one used by Moser was utilized as follows. Day 1 involved 2 min of habituation, Techboard floor absorbent side up, and no objects. Day 2 involved 5 min of exploration, Techboard floor absorbent side down, and two identical objects. Objects are placed 2 in. from each of the two sidewalls of the corner. Each animal is allowed as much as 5 min to accumulate a maximum approach time of 20 s to either or both of the identical objects. Consequently, exploratory exposure to the sample object (familiar) was equated between rats by terminating the session after 20 s of object approach. Rats failing to explore the objects for more than 10 s were discarded. In general, greater than 90% of rats achieved this cut off criterion. Day 3 involved 3 min of test duration, Techboard floor absorbent side up, and two dissimilar objects. Approach time to each object was recorded separately and was the major response measure. In these studies, “approach” was defined as the nose of the rat within 2 cm of an object.[1] Vehicle and compound 14 were administered subcutaneously 30 min before each session. For all experiments, each treatment group consisted of 15 rats at the beginning of the experiments. For each session the animals were placed in the arena with their nose facing away from the objects (when present) and centered on the long side of the arena. Upon placement of the rat in the arena, the experimenter immediately sat in front of the monitor for scoring approach behavior without disturbing the rat. Approach time to each object during the test session was recorded separately and was the major response measure. These data were analyzed using a paired two-tail t-test to determine significant differences between novel and familiar approach time, with statistical significance defined by a p value less than 0.05.[1] |
| 药代性质 (ADME/PK) |
Further human and rat in vitro pharmacokinetic (PK) evaluation demonstrated moderate clearance and half-lives for compounds 2, 11, 13, and 14 (PHA-543613). In vivo PK evaluation in a rat constant infusion model verified the in vitro PK data and predicted good oral bioavailability of >60% for each of the compounds and clearance consistent with the RLM data. Differentiation of the compounds came from CYP2D6 evaluation, where benzofuran 11 was found to inhibit this key P450 enzyme. Fortunately, furopyridine 14 (PHA-543613) is inactive up to the highest dose tested (10 μM). Finally, a mouse brain uptake assay (MBUA) was used to evaluate CNS penetration.34 Compounds 2, 11, 13, and 14 (PHA-543613) each have excellent brain penetration; however, with the exception of furopyridine 14 each demonstrates a modest accumulation in the CNS. Brain accumulation was not a desirable attribute, given the α7 receptor's known desensitization profile.35 A separate PK study evaluating 14, utilizing a 5 mg/kg dose in rat, is in close agreement with the infusion data above: 65% oral bioavailability, low clearance of 33.3 mL·min-1·kg-1, and volume of distribution of 1.8 L·kg-1. On the basis of the data presented, compound 14 clearly differentiates itself from 2, 11, and 13, justifying further in vivo evaluation.
|
| 参考文献 |
|
| 其他信息 |
Pha-543613 is a phosphoramide and an organothiophosphorus compound.
|
| 分子式 |
C15H17N3O2
|
|---|---|
| 分子量 |
271.32
|
| 精确质量 |
307.109
|
| 元素分析 |
C, 66.40; H, 6.32; N, 15.49; O, 11.79
|
| CAS号 |
478149-53-0
|
| 相关CAS号 |
PHA-543613 dihydrochloride;478148-58-2; 1586767-92-1 (HCl)
|
| PubChem CID |
9930121
|
| 外观&性状 |
White to off-white solid powder
|
| LogP |
2.782
|
| tPSA |
58.37
|
| 氢键供体(HBD)数目 |
1
|
| 氢键受体(HBA)数目 |
4
|
| 可旋转键数目(RBC) |
2
|
| 重原子数目 |
20
|
| 分子复杂度/Complexity |
381
|
| 定义原子立体中心数目 |
1
|
| InChi Key |
IPKZCLGGYKRDES-ZDUSSCGKSA-N
|
| InChi Code |
InChI=1S/C15H17N3O2/c19-15(12-7-11-3-6-20-14(11)8-16-12)17-13-9-18-4-1-10(13)2-5-18/h3,6-8,10,13H,1-2,4-5,9H2,(H,17,19)/t13-/m0/s1
|
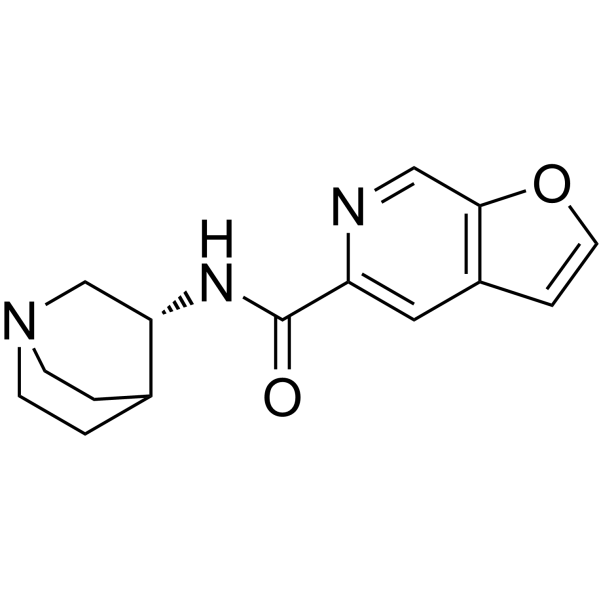
| 化学名 |
N-[(3R)-1-azabicyclo[2.2.2]octan-3-yl]furo[2,3-c]pyridine-5-carboxamide
|
| 别名 |
PHA543613; PHA 543613; PHA-543613; 478149-53-0; PHA-543,613; N-[(3R)-1-azabicyclo[2.2.2]oct-3-yl]furo[2,3-c]pyridine-5-carboxamide; (R)-N-(Quinuclidin-3-yl)furo(2,3-C)pyridine-5-carboxamide; R36R9KVD6Y; CHEMBL214268; DTXSID6047284; PHA-543613
|
| HS Tariff Code |
2934.99.9001
|
| 存储方式 |
Powder -20°C 3 years 4°C 2 years In solvent -80°C 6 months -20°C 1 month |
| 运输条件 |
Room temperature (This product is stable at ambient temperature for a few days during ordinary shipping and time spent in Customs)
|
| 溶解度 (体外实验) |
DMSO : ~250 mg/mL (~921.46 mM)
H2O : ~100 mg/mL (~368.58 mM) |
|---|---|
| 溶解度 (体内实验) |
注意: 如下所列的是一些常用的体内动物实验溶解配方,主要用于溶解难溶或不溶于水的产品(水溶度<1 mg/mL)。 建议您先取少量样品进行尝试,如该配方可行,再根据实验需求增加样品量。
注射用配方
注射用配方1: DMSO : Tween 80: Saline = 10 : 5 : 85 (如: 100 μL DMSO → 50 μL Tween 80 → 850 μL Saline)(IP/IV/IM/SC等) *生理盐水/Saline的制备:将0.9g氯化钠/NaCl溶解在100 mL ddH ₂ O中,得到澄清溶液。 注射用配方 2: DMSO : PEG300 :Tween 80 : Saline = 10 : 40 : 5 : 45 (如: 100 μL DMSO → 400 μL PEG300 → 50 μL Tween 80 → 450 μL Saline) 注射用配方 3: DMSO : Corn oil = 10 : 90 (如: 100 μL DMSO → 900 μL Corn oil) 示例: 以注射用配方 3 (DMSO : Corn oil = 10 : 90) 为例说明, 如果要配制 1 mL 2.5 mg/mL的工作液, 您可以取 100 μL 25 mg/mL 澄清的 DMSO 储备液,加到 900 μL Corn oil/玉米油中, 混合均匀。 View More
注射用配方 4: DMSO : 20% SBE-β-CD in Saline = 10 : 90 [如:100 μL DMSO → 900 μL (20% SBE-β-CD in Saline)] 口服配方
口服配方 1: 悬浮于0.5% CMC Na (羧甲基纤维素钠) 口服配方 2: 悬浮于0.5% Carboxymethyl cellulose (羧甲基纤维素) 示例: 以口服配方 1 (悬浮于 0.5% CMC Na)为例说明, 如果要配制 100 mL 2.5 mg/mL 的工作液, 您可以先取0.5g CMC Na并将其溶解于100mL ddH2O中,得到0.5%CMC-Na澄清溶液;然后将250 mg待测化合物加到100 mL前述 0.5%CMC Na溶液中,得到悬浮液。 View More
口服配方 3: 溶解于 PEG400 (聚乙二醇400) 请根据您的实验动物和给药方式选择适当的溶解配方/方案: 1、请先配制澄清的储备液(如:用DMSO配置50 或 100 mg/mL母液(储备液)); 2、取适量母液,按从左到右的顺序依次添加助溶剂,澄清后再加入下一助溶剂。以 下列配方为例说明 (注意此配方只用于说明,并不一定代表此产品 的实际溶解配方): 10% DMSO → 40% PEG300 → 5% Tween-80 → 45% ddH2O (或 saline); 假设最终工作液的体积为 1 mL, 浓度为5 mg/mL: 取 100 μL 50 mg/mL 的澄清 DMSO 储备液加到 400 μL PEG300 中,混合均匀/澄清;向上述体系中加入50 μL Tween-80,混合均匀/澄清;然后继续加入450 μL ddH2O (或 saline)定容至 1 mL; 3、溶剂前显示的百分比是指该溶剂在最终溶液/工作液中的体积所占比例; 4、 如产品在配制过程中出现沉淀/析出,可通过加热(≤50℃)或超声的方式助溶; 5、为保证最佳实验结果,工作液请现配现用! 6、如不确定怎么将母液配置成体内动物实验的工作液,请查看说明书或联系我们; 7、 以上所有助溶剂都可在 Invivochem.cn网站购买。 |
| 制备储备液 | 1 mg | 5 mg | 10 mg | |
| 1 mM | 3.6857 mL | 18.4284 mL | 36.8568 mL | |
| 5 mM | 0.7371 mL | 3.6857 mL | 7.3714 mL | |
| 10 mM | 0.3686 mL | 1.8428 mL | 3.6857 mL |
1、根据实验需要选择合适的溶剂配制储备液 (母液):对于大多数产品,InvivoChem推荐用DMSO配置母液 (比如:5、10、20mM或者10、20、50 mg/mL浓度),个别水溶性高的产品可直接溶于水。产品在DMSO 、水或其他溶剂中的具体溶解度详见上”溶解度 (体外)”部分;
2、如果您找不到您想要的溶解度信息,或者很难将产品溶解在溶液中,请联系我们;
3、建议使用下列计算器进行相关计算(摩尔浓度计算器、稀释计算器、分子量计算器、重组计算器等);
4、母液配好之后,将其分装到常规用量,并储存在-20°C或-80°C,尽量减少反复冻融循环。
计算结果:
工作液浓度: mg/mL;
DMSO母液配制方法: mg 药物溶于 μL DMSO溶液(母液浓度 mg/mL)。如该浓度超过该批次药物DMSO溶解度,请首先与我们联系。
体内配方配制方法:取 μL DMSO母液,加入 μL PEG300,混匀澄清后加入μL Tween 80,混匀澄清后加入 μL ddH2O,混匀澄清。
(1) 请确保溶液澄清之后,再加入下一种溶剂 (助溶剂) 。可利用涡旋、超声或水浴加热等方法助溶;
(2) 一定要按顺序加入溶剂 (助溶剂) 。