| 规格 | 价格 | 库存 | 数量 |
|---|---|---|---|
| 1mg |
|
||
| 5mg |
|
||
| 10mg |
|
||
| 25mg |
|
||
| 100mg |
|
||
| 500mg |
|
||
| Other Sizes |
|
| 靶点 |
Chemokine; Antibiotic; antibacterial; Synthetic cationic peptide; Innate defense modulator/peptide
|
|---|---|
| 体外研究 (In Vitro) |
IDR-1018 调节中性粒细胞粘附和活化标志物的表达[3]。IDR1018是迄今为止最有效的趋化因子诱导剂,已在小鼠模型中表现出抗感染和抗炎活性,包括与标准一线抗疟药物联合使用时对伯氏疟原虫 ANKA 脑型疟疾有效[3]。
与M1和M2巨噬细胞相比,在存在IDR1018的情况下分化的巨噬细胞显示出中等的细胞因子反应特征[2] 促炎细胞因子的减少和抗炎介质的增强是交替激活的M2巨噬细胞的标志;因此,我们试图在存在IDR1018的巨噬细胞中检测这一特征。为了确认IDR-1018的免疫调节作用,在PBMC中测试了几种打乱的合成肽,以观察趋化因子的表达(如图S1)。相反,天然宿主防御肽LL-37也被用于观察其对巨噬细胞分化的影响(图S2)。在这两种情况下,IDR-1018都显示出不同的反应。此外,为了选择合适的M2分化诱导剂,我们使用不同的分化方案进行了初步实验,包括Martinez等人描述的在整个分化过程中使用MCSF,然后添加IL-4作为M2诱导剂的方案(S图S2)。然而,我们选择使用一种更简单的方案,仅使用M-CSF,M-CSF是M2表型的已知诱导剂,并给出了非常相似的结果(图1)。将未经特异性刺激分化的巨噬细胞(M0细胞)和在IFNγ(M1细胞)和M-CSF(M2细胞)存在下分化的巨噬细胞用作对照,与IDR1018和IDR1018+M2(即添加M-CSF)分化的巨噬细胞进行比较。所有分化的巨噬细胞未经处理或用LPS攻击,通过ELISA分析细胞因子表达。 IDR1018分化的巨噬细胞以复杂的方式对LPS刺激作出反应。一些反应类似于M2巨噬细胞的反应,但与M1巨噬细胞的反应不同,因为促炎细胞因子TNFα强烈降低,而抗炎细胞因子IL10在刺激后4小时和24小时都高度表达(图1A)。同样,通过RT-qPCR分析,另一种促炎介质Cox-2的转录减少(图1B)。相反,对于其他炎症介质,如IL-12亚基以及IL-1RN和TGF-β,与M1巨噬细胞的反应相比,IDR1018分化的巨噬细胞的反应没有显著差异。相比之下,IDR-1018+M2分化的巨噬细胞在减少所有促炎介质同时增强抗炎介质方面表现出与M2巨噬细胞相似或更强的反应(图1)。总体而言,IDR-1018存在下的分化似乎导致了一种中间表型,类似于M1或M2巨噬细胞的特定方面。 在IDR1018存在下分化的巨噬细胞表现出与M2巨噬细胞不同的趋化因子谱[2] M1和M2巨噬细胞具有独特且非常特征性的趋化因子谱。例如,与M1巨噬细胞相比,M2巨噬细胞表现出趋化因子如CCL-3和IP-10的表达降低,CCL-22的表达升高。因此,我们检测了IDR1018分化巨噬细胞的趋化因子谱中的这些趋化因子。IDR-1018分化的巨噬细胞呈现出与M2巨噬细胞不同的特征。尽管与M1巨噬细胞相比,IP-10也有类似的减少,但CCL3没有减少,CCL22的产量更高(图2)。相比之下,IDR-1018+M2分化的巨噬细胞表现出与M2巨噬细胞相似的趋化因子谱。 在存在IDR1018的情况下,巨噬细胞的分化诱导了伤口愈合相关基因的表达[2] 伤口愈合是M2巨噬细胞的特征性功能,许多与伤口愈合相关的基因,如生长因子和细胞外基质成分,在这些细胞中表达。我们最近证明,IDR1018促进小鼠和猪的伤口愈合。因此,在IDR1018和IDR-1018+M2分化的巨噬细胞中研究了这些因子的表达水平(图3)。IDR1018和IDR-1018+M2分化的巨噬细胞对内皮生长因子(EGF)和蛋白多糖Versican(VCAN)的表达表现出与M2巨噬细胞相似或更高的差异性影响。尽管在其他伤口愈合基因(如血管内皮生长因子(VEGF)和甲酰肽受体样-1(FPRL-1))的基础水平上没有发现显著差异,但当用LPS刺激IDR-1018和IDR-1018+M2巨噬细胞时,观察到主要的差异变化,导致与LPS刺激的M2对照相似的特征。4个基因中有3个对LPS有反应,但EGF没有。 在存在IDR1018的情况下分化的巨噬细胞对凋亡细胞显示出增强的吞噬特性[2] 凋亡细胞的吞噬作用是交替激活的巨噬细胞的另一个独特功能。使用用CFDA-SE标记的紫外线诱导的凋亡Jurkat细胞作为在不同条件下分化的巨噬细胞的靶标,进行吞噬试验,并通过流式细胞术进行分析。为每种治疗创建斑马图,显示CFDA-SE阳性凋亡jurkat细胞的巨噬细胞百分比(图3A-S)。测量CFDA-SE门控巨噬细胞阳性的几何平均值(图3B-S)。通过对照M1巨噬细胞的几何平均值评估的吞噬活性与M0细胞相似,而M2细胞的吞噬作用大约是M0细胞的两倍。与M1对照组相比,IDR-1018分化细胞的吞噬作用显著但轻微增加,但仍远低于M2对照组。有趣的是,IDR-1018+M2分化的巨噬细胞的吞噬活性大于M2巨噬细胞。 IDR1018-巨噬细胞保持可塑性,使其能够恢复到促炎状态[2] 与免疫抑制相关的一些病理学,如内毒素耐受,被认为是由巨噬细胞锁定在M2表型中引起的,表明可塑性丧失。鉴于IDR肽作为治疗剂的拟议用途,重要的是确定在存在IDR1018的情况下分化是否影响巨噬细胞的正常可塑性,以及它们是否能够进入M1(LPS反应)状态。因此,在IDR-1018单独存在或与M-CSF联合存在的情况下,巨噬细胞如前所述分化,随后用M1促进细胞因子IFNγ处理。ELISA分析的促炎细胞因子TNF-α和抗炎细胞因子IL-10被用作表型标志物。IDR-1018和IDR-1018+M2分化的巨噬细胞在IFN-γ刺激下表现出TNF-α的产生增加和IL-10的减少,与M1巨噬细胞相似,而未经IFN-γ激发的同等巨噬细胞则表现出部分类似于M2巨噬细胞的细胞因子表达谱(图4)。这些结果表明,IDR-1018分化的巨噬细胞保持可塑性,从而调节其反应性。 IDR1018处理过的单核细胞和单核细胞衍生的巨噬细胞表达了对M2巨噬细胞发育很重要的转录因子[2] 先前已经鉴定出促进M2巨噬细胞发育的几种转录因子。因此,我们试图使用RT-qPCR分析这些因素在IDR1018分化的巨噬细胞和IDR-1018刺激的单核细胞中的作用。观察到所分析的3种转录因子的中间反应:干扰素调节因子4(IRF4)、信号转导子和转录激活子3(STAT3)和过氧化物酶体激活受体γ(PPARγ)(图5A)。IRF4在M1细胞中未被诱导,但在M2细胞中显著上调。IDR-1018分化的巨噬细胞表现出高IRF4诱导,而IDR-1018+M2分化的细胞更像M2细胞。关于STAT3,IDR-1018分化的巨噬细胞没有表现出与M1细胞一样的诱导作用,而IDR-1018+M2分化的细胞表现出对这种转录因子的轻微诱导作用。PPARγ在M1巨噬细胞中下调,但在M2巨噬细胞或在IDR-1018或1018+M2存在下分化的巨噬细胞中没有下调。[2] 有趣的是,与未刺激的单核细胞相比,用IDR1018刺激的单细胞中所有三种M2促进转录因子PPARγ、IRF4和STAT3的表达上调了5至6倍(图5B)。由于IRF4在IDR-1018分化的巨噬细胞中过表达,我们研究了其表达对下游反应的影响。对IDR-1018分化的单核细胞与未刺激的单核电池进行高通量RNA-seq,显示542个上调基因和334个下调基因(表S2)。IDR-1018处理的单核细胞中876个差异表达(DE)基因与M2极化巨噬细胞微阵列数据的交叉显示,165个(19%)DE基因也与M2巨噬细胞表型相关。为了确定IRF4对IDR-1018反应中M2亚群的影响程度,我们检查了IRF4结合位点的存在,并发现71个基因(41%)之前已经证明了IRF4的结合(表S3)。已知鉴定的一些基因与M2巨噬细胞的发育和/或与M2表型相关的其他活动有关,包括甘露糖受体(MR)、PPARγ和基质金属蛋白酶9(MMP9)。 IDR肽,如IDR1018,调节中性粒细胞上粘附分子和活化标志物的表达。 IDR肽对中性粒细胞与内皮细胞粘附的影响。 IDR肽诱导中性粒细胞在纤维连接蛋白涂层表面迁移。 IDR肽减弱了LPS诱导的中性粒细胞活化。 IDR肽增强了中性粒细胞对大肠杆菌的杀伤作用。 IDR肽诱导中性粒细胞胞外释放HDPs。 IDR肽激活MAPK通路是产生趋化因子所必需的[3]。 |
| 体内研究 (In Vivo) |
为了评估V-IDR1018在生理相关条件下对SSTI的疗效,我们使用MRSA USA300 LAC在高密度皮下感染的成熟体内脓肿模型中给药该化合物。雌性远交CD-1小鼠(5-7周龄)皮下感染了约5×107cfu,并在感染后1小时直接注射IDR1018、V-IDR1018(62.5μg,50μL,2.5mg kg-1)、万古霉素(6.25μg在50μL中,0.25mg kg-1)或赋形剂(5%葡萄糖,50μL)到脓肿中。3天后,通过测量脓肿大小,即皮肤坏死面积(由细菌发病机制引起)和细菌载量(cfu mL-1)来评估疗效。与载体和IDR1018治疗的感染相比,V-IDR1018显示脓肿大小显著减少了约90%(图6a,b)。与载体相比,V-IDR1018还导致细菌载量大幅减少(>104倍),并且IDR1018;单独使用万古霉素在测试浓度下没有明显效果(图6c)。使用表皮葡萄球菌重复实验,观察到类似的结果,治疗后脓肿大小大幅减小,细菌恢复(图S7)。这些发现是显著的,因为将HDP与抗生素万古霉素结合可以增强后者的抗菌活性,几乎完全预防皮肤坏死。V-IDR1018能够减少脓肿中的病变和细菌负荷,这强烈表明该结合物对临床相关葡萄球菌具有多模式联合活性[1]。
|
| 酶活实验 |
最低抑菌浓度[1]
MIC是使用之前描述的肉汤微量稀释法测定的。简而言之,将90μL的MHB细菌悬浮液等分到96孔聚丙烯圆底板(10μL孔-1)中的试验化合物(肽、偶联物或抗生素)的连续稀释液中。将平板在37°C下孵育过夜(18-20小时),第二天在OD600下使用微孔板分光光度计测定细胞生长。使用万古霉素、16-BAC和1:1 w/w万古霉素+IDR1018进行比较。分别使用未经处理的细菌培养物和无细菌的培养基作为阳性对照和阴性对照。MIC被定义为抑制孔中细菌生长的试验化合物的最低浓度。所有实验在三个独立的实验中进行了三次,并报告了中值。 对环丙沙星产生的持久性细胞的抗菌活性[1] 通过用10×MIC环丙沙星挑战MHB中的细菌悬浮液,产生MRSA USA300 LAC的持久细胞。在1 mL MHB中,细菌悬浮在1×108cfu mL-1。加入10μg mL-1环丙沙星,然后在37°C下以200rpm振荡培养6小时。在不同时间点取培养物等分试样,在PBS中连续稀释,并铺在营养琼脂平板上以测定cfu mL-1。6小时后,用PBS洗涤细菌以去除环丙沙星,并用16μg mL-1的MHB中的IDR1018或V-IDR1018进行攻击。在不同的时间点取处理过的悬浮液的等分试样,用PBS洗涤,连续稀释,并接种以测定cfu。进行了三个独立的实验,每个实验涉及三个重复,并给出了平均值。 连续通道阻力演变[1] 简而言之,1×107 cfu mL-1的MRSA USA300在1 mL含有肽IDR1018、V-IDR1018、万古霉素或环丙沙星的MHB中生长,其浓度梯度为0.25×MIC、0.5×MIC、1×MIC、2×MIC、4×MIC等。经过一夜温育后,检查培养物的细菌生长并记录MIC。将允许细菌生长(OD600≥1)的最高浓度抗菌剂(低于MIC)的培养物稀释在含有上述抗菌剂系列稀释液的新鲜MHB中。再次孵育过夜后,检查培养物中的细菌生长情况,并记录MIC;同样,从允许细菌生长(OD600≥1)的最高浓度试验化合物(低于MIC)中收获培养物,并测定MIC。该连续传代重复14次,一式三份,并给出平均值。 时间杀伤试验[1] 按照之前描述的方法分析了测试化合物(IDR1018、V-IDR1018或抗生素万古霉素)对MRSA USA300 LAC的时间杀伤动力学。简而言之,在无菌的Eppendorf试管中,将16μg mL-1的试验化合物添加到MHB培养基(500μL,1×107cfu mL-1)中的细菌悬浮液中。然后将处理过的样品在37°C下以200 rpm的速度振荡培养。以不同的时间间隔(1、30、60、120、240和360分钟)取10μL的等分试样,连续稀释,并铺在营养琼脂平板上进行cfu计数(检测限:1 log cfu mL-1)。对细菌菌落进行计数,并据此估算时间杀灭动力学。进行了三个独立的实验,每个实验涉及三个重复,并给出了平均值。 基于N/TERT的表皮模型、生物膜的建立和治疗[1] 如最近所述,我们建立了基于N/TERT细胞的皮肤模型。简而言之,将DermaLife K角质形成细胞完全培养基中的N/TERT细胞以每400μL 3×105的浓度接种在12孔板中的过滤器插入物(ThinCert细胞培养插入物)上。DermaLife K角质形成细胞完全培养基补充了LifeFactors(5μg mL-1 RH胰岛素、1μM肾上腺素、6 mM l-谷氨酰胺、0.5 ng mL-1 RH TGF-α、5μg mL-1 Apo转铁蛋白、0.4%提取物P LifeFactor和100 ng mL-1半琥珀酸氢化可的松)。将平板在37°C、7.3%CO2中孵育,每2天更换一次培养基,直到细胞达到融合。然后将培养基换成DMEM、Ham’s F-12和CnT Prime 3D Barrier培养基的混合培养基,比例为3:1:4,并加入必需补充剂。一天后,将过滤器顶部和底部的介质提起,形成空气/液体界面,在空气/液体接口后2-3天,亚油酸的量增加了一倍。样品在37°C和7.3%CO2中孵育10天,每两天更新一次培养基。 细菌,即PBS中2×108 5μL–1的MRSA lux,接种在表皮模型的中心,在7.3%CO2中于37°C下孵育24小时。在生物膜顶部加入30μL 300μg mL–1(0.03%)V–IDR1018,孵育4小时。使用万古霉素或载体(PBS)对照样品进行比较。使用ChemiDoc成像系统(BioRad)在治疗前后对皮肤模型上的生物膜(细菌菌落)进行可视化,并通过在LB琼脂平板上连续稀释均质皮肤样品进行定量分析。cfu计数的检测限为1×103。未处理和处理过的皮肤模型的代表性实例也在10%福尔马林溶液(pH 7.4)中固定24小时,浸入70%乙醇中,并送去进行h&E染色。 |
| 细胞实验 |
人巨噬细胞分化[2]
人巨噬细胞分化如前所述进行,但有一些修改。简而言之,在PBS中分离外周血单核细胞后,将细胞重新悬浮在无血清RPMI培养基中,并在6孔板上以5×106个细胞/孔的速度铺板30分钟。随后,更换了培养基,并添加了新的完整培养基。24小时后,轻轻清洗贴壁单核细胞,并用不同的刺激物处理,如下:20 ng/ml的IFNγ用于M1分化,10 ng/ml的M-CSF用于M2分化,5 ug/ml的IDR1018。细胞培养7天,在第二天和第六天轻轻清洗和更换培养基,在此期间重新添加处理。最后,在第七天,轻轻清洗细胞,不处理或用10ng/ml的LPS攻击。 IDR1018(VRLIVAVRIRR-CONH2)使用固相Fmoc化学合成,并使用反相HPLC纯化(纯度>95%)。通过质谱法确认了正确的肽质量。 RNA-seq及其分析[2] 使用Illumina Genome Analyzer IIx平台通过高通量下一代测序进行RNA-seq。最初从4名健康供体获得PBMC,然后使用EasySep单核细胞富集无CD16耗竭试剂盒分离单核细胞。按照制造商的说明。用20µg/ml的IDR1018刺激单核细胞4小时,并与未刺激的单核细胞进行比较。然后提取RNA,并如上所述评估其质量。对于文库制备,根据Illumina TruSeq RNA样品制备指南处理500 ng总RNA。简而言之,按照制造商的说明,使用poly-dT珠纯化mRNA,然后合成第一条和第二条cDNA链,添加单a悬垂的末端修复,连接接头和独特的条形码。通过15个循环的PCR进行DNA富集。定量后,在CBOT仪器上使用8 pM的dsDNA进行簇生成。RNA测序在GAIIx仪器上完成,作为51个扩增周期的单次读取运行。数据处理是在内部进行的,使用CASAVA将原始数据转换并解复用为FASTQ序列文件。使用Bowtie和Tophat将读取的数据与参考基因组进行比对,然后使用Bioconductor软件包GenomeRanges将其映射到基因。使用edgeR Bioconductor软件包测定差异基因表达,并使用Benjamini-Hochberg(假发现率)方法调整p值进行多次校正。 细胞制备和刺激[3] 如前所述,在红细胞沉淀后,在密度梯度离心之前,将上层部分分层到Ficoll-Paque Plus上。中性粒细胞纯度>95%,通过台盼蓝排斥法测定每种细胞制剂的细胞存活率,发现其>98%。将细胞悬浮在RPMI-1640培养基中,补充10%热灭活FBS、2 mM L-谷氨酰胺和1 mM丙酮酸钠,并用IDR肽(例如IDR1018)处理。 EA.hy926细胞是HUVEC和人上皮细胞系A549的杂交瘤,已被证明保留了天然内皮细胞的特性,在含有10%FBS和低氧胺、氨基蝶呤和胸苷培养基补充剂(Invitrogen)的DMEM(高糖)中培养。这些细胞在湿润的环境中生长,每3-4天用0.05%胰蛋白酶/0.02%EDTA分离细胞一次。 ELISA[3] 根据制造商的说明,在中性粒细胞与IDR肽(例如IDR1018)一起孵育指定时间后,对中性粒细胞进行离心以获得无细胞样本,并在-20°C下储存,直至用于ELISA。在一些实验中,中性粒细胞在用IDR肽刺激之前用MAPK特异性抑制剂预处理2小时。 流式细胞术分析中性粒细胞粘附和活化标志物的表达[3] 中性粒细胞(5×105)与IDR肽(例如IDR1018)在37°C下孵育3小时。将细胞在Opti-MEM中洗涤,并在冰上以饱和浓度的抗整合素CD11b、L-选择素CD62L、粘附分子CD64和GPI连接糖蛋白CD66b的抗体重新悬浮30分钟。对照样品用相同浓度的非特异性小鼠IgMλ或IgG1κAb染色。洗涤后,使用FACSCalibur流式细胞仪结合CellQuest Pro软件对样品进行分析。 中性粒细胞脱颗粒:MPO活性[3] MPO释放被选为中性粒细胞嗜天蓝色颗粒脱颗粒的标志物,并使用购自Sigma-Aldrich的测定试剂如前所述进行定量。简而言之,在有或没有LPS的情况下,用IDR肽(例如IDR1018)处理1×106中性粒细胞30分钟。然后离心细胞以获得无细胞样本。中性粒细胞释放的MPO在中性粒细胞上清液中定量,中性粒细胞上清在0.1 M磷酸钾缓冲液(pH 6)中的2×0.5%(w/v)十六烷基三甲基铵中以1:1稀释。收集上清液并进行分析。在0.0005%(v/v)H2O2和0.5mM邻联苯胺二盐酸盐存在下,在460nm波长下用分光光度法定量MPO活性。MPO的一个单位被定义为在25°C下使用1μmol/min H2O2的酶的量。 中性粒细胞粘附试验[3] 将中性粒细胞重新悬浮在含有1%FBS的RPMI-1640培养基中,在37°C下用不同剂量的IDR肽(如IDR1018)处理1小时,并洗涤以去除任何多余的刺激物。然后将细胞(1×105/100μl)加入48孔板中EA.hy926细胞的融合孔中,在37°C下孵育45分钟,并洗涤孔三次以去除任何不粘附的细胞。粘附在EA.hy926细胞上的中性粒细胞用0.5%Triton X-100裂解10分钟,然后测量细胞裂解物中的MPO活性。对于抑制实验,中性粒细胞首先在37°C下用10μg/ml的抗CD18单克隆抗体和/或抗CD62L单克隆抗体预处理1小时,并在粘附试验开始前洗涤两次。在一些实验中,48孔板在4°C下用25μg/ml纤维连接蛋白或2μg/ml ICAM-1(R&D Systems,Minneapolis,MN,USA)/孔涂覆过夜,以评估中性粒细胞对纤维连接蛋白和ICAM-1的粘附。用PBS洗涤涂层孔,在37°C下用含1%BSA的PBS封闭1小时,然后在使用前用PBS再次洗涤。将中性粒细胞(1×105)加入每个孔中,然后在37°C下用IDR肽(例如IDR1018)刺激1小时。然后去除非粘附细胞,用PBS洗涤孔两次。用0.5%Triton X-100裂解贴壁细胞,并在这些细胞裂解物中测量MPO活性。 细胞内ROS产生的测量[3] 如前所述,使用DCFDA使用流式细胞术测定细胞内ROS水平。将密度为2×106个细胞/ml的中性粒细胞重新悬浮在150μl RPMI 1640中,补充10%FBS,并在37°C下在有或没有LPS的情况下与每种IDR肽(例如IDR1018)一起孵育30分钟。洗涤细胞,将其重新悬浮在含有1μM DCFDA的Opti-MEM中,然后在37°C下孵育30分钟。在冰冷的PBS中洗涤一次后,通过流式细胞术分析细胞。 趋化性测定[3] 趋化性测定使用48孔微趋化室进行。将中性粒细胞(1×105)添加到腔室的上部孔中,并通过直径为3μm的聚碳酸酯膜与含IDR肽(例如IDR1018)的下部孔分离。这些膜没有涂层或涂有10μg/ml的纤维连接蛋白。孵育60分钟后,在用甲醇固定膜并用DiffQuick染色试剂盒染色后,在光学显微镜下计数粘附在过滤器下侧的迁移细胞数量。DiffQuick染色用于确认迁移的细胞在形态上是中性粒细胞(>98%)。 杀菌试验[3] 中性粒细胞在1.5 ml微量离心管中培养,在37°C、5%CO2的加湿气氛中重新悬浮在HBSS中30分钟,并用指定浓度的IDR肽(例如IDR1018)刺激1小时。然后用HBSS洗涤细胞两次,以500 g离心培养物,然后重新悬浮在HBSS中,并在分析前补充10%自体血清。同时,通过在11000 g下离心培养物,用HBSS洗涤两次,并将培养物重新悬浮在HBSS中,在微量离心管中补充10%的自体血清,收获发光大肠杆菌Xen-14。通过在37°C下轻轻倒置微量离心管20分钟,对人血清中的大肠杆菌进行调理。通过在5×106中性粒细胞/治疗条件下添加2.5×107 CFU的大肠杆菌来评估抗菌药物的杀灭效果,导致5次感染,然后孵育15-60分钟。将大肠杆菌添加到不含中性粒细胞的检测培养基中,作为细菌生长的对照。通过在每个指定时间点去除50μl共培养物并将其加入2.5ml稀NaOH溶液(pH 11)中5分钟以溶解中性粒细胞,确定每种处理条件下存活的大肠杆菌数量。然后将该溶液在HBSS中进一步稀释,并接种在LB琼脂平板上。根据以下公式计算杀死大肠杆菌的百分比:[1−(CFU治疗/CFUbacteria仅对照)]×100。 蛋白质印迹分析[3] 中性粒细胞(1×106)与IDR肽(例如IDR1018)一起孵育10分钟。刺激后,根据制造商的规范,通过在RIPA缓冲液中裂解细胞获得细胞裂解物。对等量的总蛋白进行12.5%SDS-PAGE。阻断非特异性结合位点后,将印迹与针对磷酸化或非磷酸化ERK、JNK和p38的pAb一起孵育过夜。该膜是用ECL检测试剂盒开发的。 |
| 动物实验 |
In Vivo Toxicity and Efficacy Testing in a Mouse Abscess Infection Model [1]
Experiments were performed as previously described, with minor modification. ∼24 CD-1 mice (female, 5–7 weeks) were subcutaneously injected with 50 μL of V–IDR1018 in 5% dextrose at 10, 5, or 2.5 mg kg–1, underneath the skin to determine the toxicity by visualizing the integrity of the outer and inner skin layers. For efficacy testing, bacterial cultures were grown in LB to an OD600 = 2.0, washed twice, and resuspended in PBS for final inocula of 5–6.5 × 107 cfu mL–1. Fifty microliters (4 × 107 cfu mL–1) of MRSA USA300 LAC was injected into the right dorsum of shaved mice weighing 20 ± 5 g at the time of experimentation. V–IDR1018 (2.5 mg kg–1), vancomycin (0.25 mg kg–1), IDR1018 (2.5 mg kg–1), or the vehicle (5% dextrose) was injected into the infected area 1 h later. Infection progress was monitored daily for 3 days, and mice were clinically graded. At the endpoint, lesion sizes (visible dermonecrosis or pathogenesis) were measured using a caliper. Tissue was collected for bacterial enumeration as previously described. |
| 参考文献 |
|
| 分子式 |
C71H125N25O13
|
|---|---|
| 分子量 |
1536.92
|
| CAS号 |
1453221-07-2
|
| 相关CAS号 |
IDR-1018;1453221-07-2
|
| PubChem CID |
155527735
|
| 序列 |
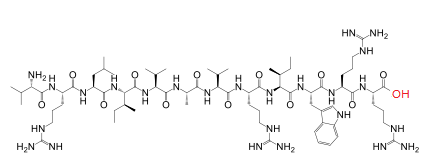
Val-Arg-Leu-Ile-Val-Ala-Val-Arg-Ile-Trp-Arg-Arg
|
| 短序列 |
VRLIVAVRIWRR
|
| 外观&性状 |
Typically exists as solids at room temperature
|
| LogP |
-1.1
|
| tPSA |
663 Ų
|
| 氢键供体(HBD)数目 |
22
|
| 氢键受体(HBA)数目 |
17
|
| 可旋转键数目(RBC) |
50
|
| 重原子数目 |
109
|
| 分子复杂度/Complexity |
3100
|
| 定义原子立体中心数目 |
14
|
| InChi Key |
RNOHIZCXHRBFRE-MUOSHHONSA-N
|
| InChi Code |
InChI=1S/C71H126N26O12/c1-14-39(11)54(66(108)93-50(33-42-34-86-44-23-17-16-22-43(42)44)61(103)89-46(25-19-29-83-69(76)77)58(100)88-45(56(73)98)24-18-28-82-68(74)75)96-60(102)48(27-21-31-85-71(80)81)91-65(107)53(38(9)10)94-57(99)41(13)87-64(106)52(37(7)8)95-67(109)55(40(12)15-2)97-62(104)49(32-35(3)4)92-59(101)47(26-20-30-84-70(78)79)90-63(105)51(72)36(5)6/h16-17,22-23,34-41,45-55,86H,14-15,18-21,24-33,72H2,1-13H3,(H2,73,98)(H,87,106)(H,88,100)(H,89,103)(H,90,105)(H,91,107)(H,92,101)(H,93,108)(H,94,99)(H,95,109)(H,96,102)(H,97,104)(H4,74,75,82)(H4,76,77,83)(H4,78,79,84)(H4,80,81,85)/t39-,40-,41-,45-,46-,47-,48-,49-,50-,51-,52-,53-,54-,55-/m0/s1
|
| 化学名 |
(2S,3S)-N-[(2S)-1-[[(2S)-1-[[(2S)-1-amino-5-(diaminomethylideneamino)-1-oxopentan-2-yl]amino]-5-(diaminomethylideneamino)-1-oxopentan-2-yl]amino]-3-(1H-indol-3-yl)-1-oxopropan-2-yl]-2-[[(2S)-2-[[(2S)-2-[[(2S)-2-[[(2S)-2-[[(2S,3S)-2-[[(2S)-2-[[(2S)-2-[[(2S)-2-amino-3-methylbutanoyl]amino]-5-(diaminomethylideneamino)pentanoyl]amino]-4-methylpentanoyl]amino]-3-methylpentanoyl]amino]-3-methylbutanoyl]amino]propanoyl]amino]-3-methylbutanoyl]amino]-5-(diaminomethylideneamino)pentanoyl]amino]-3-methylpentanamide
|
| 别名 |
IDR-1018; IDR1018; Innate defense regulator 1018; Val-Arg-Leu-Ile-Val-Ala-Val-Arg-Ile-Trp-Arg-Arg-NH2; Peptide 1018; CHEMBL4460197;
|
| HS Tariff Code |
2934.99.9001
|
| 存储方式 |
Powder -20°C 3 years 4°C 2 years In solvent -80°C 6 months -20°C 1 month |
| 运输条件 |
Room temperature (This product is stable at ambient temperature for a few days during ordinary shipping and time spent in Customs)
|
| 溶解度 (体外实验) |
H2O:: 51 mg/mL [4]
|
|---|---|
| 溶解度 (体内实验) |
注意: 如下所列的是一些常用的体内动物实验溶解配方,主要用于溶解难溶或不溶于水的产品(水溶度<1 mg/mL)。 建议您先取少量样品进行尝试,如该配方可行,再根据实验需求增加样品量。
注射用配方
注射用配方1: DMSO : Tween 80: Saline = 10 : 5 : 85 (如: 100 μL DMSO → 50 μL Tween 80 → 850 μL Saline)(IP/IV/IM/SC等) *生理盐水/Saline的制备:将0.9g氯化钠/NaCl溶解在100 mL ddH ₂ O中,得到澄清溶液。 注射用配方 2: DMSO : PEG300 :Tween 80 : Saline = 10 : 40 : 5 : 45 (如: 100 μL DMSO → 400 μL PEG300 → 50 μL Tween 80 → 450 μL Saline) 注射用配方 3: DMSO : Corn oil = 10 : 90 (如: 100 μL DMSO → 900 μL Corn oil) 示例: 以注射用配方 3 (DMSO : Corn oil = 10 : 90) 为例说明, 如果要配制 1 mL 2.5 mg/mL的工作液, 您可以取 100 μL 25 mg/mL 澄清的 DMSO 储备液,加到 900 μL Corn oil/玉米油中, 混合均匀。 View More
注射用配方 4: DMSO : 20% SBE-β-CD in Saline = 10 : 90 [如:100 μL DMSO → 900 μL (20% SBE-β-CD in Saline)] 口服配方
口服配方 1: 悬浮于0.5% CMC Na (羧甲基纤维素钠) 口服配方 2: 悬浮于0.5% Carboxymethyl cellulose (羧甲基纤维素) 示例: 以口服配方 1 (悬浮于 0.5% CMC Na)为例说明, 如果要配制 100 mL 2.5 mg/mL 的工作液, 您可以先取0.5g CMC Na并将其溶解于100mL ddH2O中,得到0.5%CMC-Na澄清溶液;然后将250 mg待测化合物加到100 mL前述 0.5%CMC Na溶液中,得到悬浮液。 View More
口服配方 3: 溶解于 PEG400 (聚乙二醇400) 请根据您的实验动物和给药方式选择适当的溶解配方/方案: 1、请先配制澄清的储备液(如:用DMSO配置50 或 100 mg/mL母液(储备液)); 2、取适量母液,按从左到右的顺序依次添加助溶剂,澄清后再加入下一助溶剂。以 下列配方为例说明 (注意此配方只用于说明,并不一定代表此产品 的实际溶解配方): 10% DMSO → 40% PEG300 → 5% Tween-80 → 45% ddH2O (或 saline); 假设最终工作液的体积为 1 mL, 浓度为5 mg/mL: 取 100 μL 50 mg/mL 的澄清 DMSO 储备液加到 400 μL PEG300 中,混合均匀/澄清;向上述体系中加入50 μL Tween-80,混合均匀/澄清;然后继续加入450 μL ddH2O (或 saline)定容至 1 mL; 3、溶剂前显示的百分比是指该溶剂在最终溶液/工作液中的体积所占比例; 4、 如产品在配制过程中出现沉淀/析出,可通过加热(≤50℃)或超声的方式助溶; 5、为保证最佳实验结果,工作液请现配现用! 6、如不确定怎么将母液配置成体内动物实验的工作液,请查看说明书或联系我们; 7、 以上所有助溶剂都可在 Invivochem.cn网站购买。 |
| 制备储备液 | 1 mg | 5 mg | 10 mg | |
| 1 mM | 0.6507 mL | 3.2533 mL | 6.5065 mL | |
| 5 mM | 0.1301 mL | 0.6507 mL | 1.3013 mL | |
| 10 mM | 0.0651 mL | 0.3253 mL | 0.6507 mL |
1、根据实验需要选择合适的溶剂配制储备液 (母液):对于大多数产品,InvivoChem推荐用DMSO配置母液 (比如:5、10、20mM或者10、20、50 mg/mL浓度),个别水溶性高的产品可直接溶于水。产品在DMSO 、水或其他溶剂中的具体溶解度详见上”溶解度 (体外)”部分;
2、如果您找不到您想要的溶解度信息,或者很难将产品溶解在溶液中,请联系我们;
3、建议使用下列计算器进行相关计算(摩尔浓度计算器、稀释计算器、分子量计算器、重组计算器等);
4、母液配好之后,将其分装到常规用量,并储存在-20°C或-80°C,尽量减少反复冻融循环。
计算结果:
工作液浓度: mg/mL;
DMSO母液配制方法: mg 药物溶于 μL DMSO溶液(母液浓度 mg/mL)。如该浓度超过该批次药物DMSO溶解度,请首先与我们联系。
体内配方配制方法:取 μL DMSO母液,加入 μL PEG300,混匀澄清后加入μL Tween 80,混匀澄清后加入 μL ddH2O,混匀澄清。
(1) 请确保溶液澄清之后,再加入下一种溶剂 (助溶剂) 。可利用涡旋、超声或水浴加热等方法助溶;
(2) 一定要按顺序加入溶剂 (助溶剂) 。