| 规格 | 价格 | 库存 | 数量 |
|---|---|---|---|
| 5mg |
|
||
| 10mg |
|
||
| 500mg |
|
||
| Other Sizes |
|
| 靶点 |
ER/estrogen receptor
|
|---|---|
| 体外研究 (In Vitro) |
雌激素缺乏会导致骨吸收型破骨细胞与骨形成型成骨细胞水平失衡,最终引发整体骨量流失。脱氢二松柏醇(DHCA)是一种最初从南瓜中分离的木脂素化合物,已被证实可与雌激素受体结合,并表现出多种雌激素活性(如抗炎和抗氧化应激作用)。本研究测试了合成DHCA是否能影响BMP-2诱导的体外成骨细胞分化。在MC3T3-E1细胞中,DHCA促进了BMP-2诱导的成骨细胞分化。与此一致的是,BMP-2诱导的三个成骨相关基因(ALP、骨钙素和OPG)的表达均因DHCA处理而上调。DHCA还通过激活Smad1/5/9和AMPK促进RUNX2的产生。瞬时转染实验数据表明DHCA可能激活雌激素受体信号通路。当细胞用ERα或ERβ特异性siRNA处理时,DHCA对BMP-2诱导成骨分化的作用减弱。综上,我们的结果表明DHCA可能通过其雌激素样效应调控成骨分化,从而开发为骨质疏松的有效治疗剂。[1]
DHCA促进BMP-2诱导的成骨分化且无细胞毒性[1] MC3T3-E1是小鼠前成骨细胞系,可在BMP-2刺激下分化为成骨细胞。为测试DHCA对成骨分化的影响,用BMP-2(25 ng/mL)和三种浓度DHCA(10、20和40 μM)处理MC3T3-E1细胞5天后,检测ALP阳性细胞数和ALP活性。如图1A所示,ALP染色显示DHCA以剂量依赖性方式显著增加ALP阳性细胞数。使用细胞裂解物和pNPP底物测量的实际ALP活性水平也随DHCA浓度升高而增强(图1B)。 单独使用DHCA(即不添加BMP-2)的效果也被检测。MC3T3-E1细胞经10、20、40和80 μM DHCA处理后,ALP阳性细胞数(图1C)和ALP活性水平(图1D)均无变化,表明DHCA仅在BMP-2诱导分化时发挥作用。通过MTT法检测细胞活力证实:无论是否存在BMP-2,72小时内所有测试浓度的DHCA对细胞存活率均无显著影响(图1E)。这些数据表明DHCA可能在无细胞毒性的前提下促进BMP-2诱导的成骨分化。 DHCA调控成骨分化相关基因表达[1] 既往报道显示BMP-2刺激可上调MC3T3-E1细胞中ALP、骨钙素和OPG的表达,这些基因在成骨细胞分化与功能中起关键作用。定量RT-PCR检测显示:BMP-2处理使三种基因RNA水平提高2-3倍,而40 μM DHCA共处理可进一步以剂量依赖性方式使其表达增强2倍(图2)。 DHCA通过Smad和AMPK激活促进BMP-2诱导的RUNX2产生[1] 在BMP-2诱导的成骨分化过程中,RUNX2通过Smad信号通路被激活,这是成骨细胞分化的关键步骤,而AMPK也被证实在此过程中起积极作用。Western blot显示:BMP-2处理增加RUNX2蛋白水平(图3A比较泳道1和2),DHCA共处理可进一步强化该效应。30分钟共处理实验表明,DHCA能增强BMP-2诱导的Smad1/5/9磷酸化(图3B比较泳道2和5)并上调AMPK磷酸化水平。但单独使用DHCA(无BMP-2)对RUNX2和磷酸化Smad1/5/9水平无影响(图3C-D),说明DHCA仅在BMP-2激活状态下增强RUNX2相关信号通路。 DHCA对成骨分化的作用由ERα和ERβ介导[1] 已知雌激素能促进早期成骨细胞分化。将含有雌激素反应元件(ERE)的荧光素酶报告质粒转染MC3T3-E1细胞后,40 μM DHCA处理使荧光素酶活性增加2.6倍(图4A),提示DHCA可能与雌激素受体相互作用。通过siRNA敲低实验发现:ERα或ERβ特异性siRNA均能显著降低BMP-2/DHCA共处理时的ALP阳性细胞数(图4C)、ALP活性(图4D)及三种成骨基因(ALP/骨钙素/OPG)的RNA水平(图4E-G)。这些数据表明DHCA可能通过同时作用于ERα和ERβ来促进BMP-2诱导的成骨分化。 DHCA对lps降低细胞活力和lps诱导的RAW 264.7细胞NO和IL-1β产生的影响[2] 炎症在伤口愈合过程中起着至关重要的作用。病原体的入侵引起一系列细胞免疫反应,其中巨噬细胞至关重要。巨噬细胞通过模式识别受体识别病原体,产生多种促炎介质,增加炎症细胞在创面的浸润。我们首先通过MTT法检测DHCA对RAW 246.7细胞活力的影响。结果显示,与对照组相比,DHCA(0-200µM)处理RAW 246.7细胞对细胞活力没有影响(图5a)。 DHCA抑制lps诱导的RAW 264.7细胞iNOS和NF-κB的表达[2] 为了进一步阐明DHCA的抗炎作用机制,采用免疫荧光法分析了RAW 264.7细胞中NF-κB和iNOS的活性。我们发现LPS刺激增加了RAW 264.7细胞中NF-κB的核易位,LPS也上调了iNOS的表达。然而,200µM DHCA处理降低了LPS诱导的NF-κB活化和iNOS表达(P < 0.05)(图6)。这些数据表明DHCA可能通过抑制NF-κB/iNOS信号通路抑制lps诱导的RAW 246.7细胞炎症介质NO的产生。 |
| 体内研究 (In Vivo) |
DHCA可通过促进上皮细胞增殖和胶原形成,减少炎症细胞浸润,促进小鼠头皮创面愈合。DHCA可显著抑制愈合区结缔组织中NF-κB核易位。DHCA还抑制了lps诱导的RAW 246.7细胞中一氧化氮(NO)和白细胞介素(IL)-1β的产生,并下调了诱导型一氧化氮合酶(iNOS)的表达。更重要的是,DHCA可上调p- i -κB α表达,诱导NF-κB核易位,但不影响其表达。
结论:我们的研究表明,DHCA通过使巨噬细胞NF-κB通路失活发挥抗炎作用,从而促进伤口愈合。[2]
DHCA促进小鼠头皮创面愈合[2] 采用小鼠全层头皮创面模型,研究DHCA对创面愈合的影响。创面在第一天开始缩小。低剂量组和高剂量组伤口收缩率在伤后3 d均显著高于对照组(P < 0.05)。更重要的是,DHCA高剂量组在第7天几乎没有未愈合的创面面积,而对照组创面愈合率仅为69%(图2a, b)。结果表明,DHCA能促进小鼠头皮创面愈合。 DHCA促进上皮细胞增殖和胶原形成,减少炎症细胞浸润[2] 为了进一步探讨DHCA促进皮肤创面愈合的机制,我们对创面组织切片进行H&E染色和马松三色染色。如图3a、b所示,DHCA低、高剂量组创面上皮细胞厚度较对照组明显增厚(P < 0.05),说明DHCA能促进创面上皮细胞增殖。此外,DHCA可以减少炎症细胞的数量,表明DHCA可以抑制愈合区炎症细胞的浸润(图3a)。马松三色染色显示,低剂量组和高剂量组结缔组织胶原密度均较对照组显著增加(P < 0.05),说明DHCA可促进愈合区胶原形成(图3c, d)。 DHCA抑制愈合区结缔组织中NF-κB核易位[2] 基于上述结果,我们推测DHCA可能通过作用于NF-κB信号通路促进小鼠头皮创面愈合。因此,我们采用免疫荧光法研究DHCA对创面组织NF-κB核易位的影响。如图4所示,与对照组相比,DHCA明显抑制愈合区结缔组织(P < 0.05)而非上皮(P < 0.05)的NF-κB核易位。说明DHCA可抑制结缔组织细胞NF-κB核易位,促进创面愈合。 DHCA降低小鼠血清IL-1β水平[2] 随后,我们研究了DHCA对小鼠血清中促炎因子IL-1β (NF-κB下游因子)水平的影响。如图4d所示,DHCA可以显著抑制IL-1β的产生(P < 0.05),再次证实DHCA促进伤口愈合可能与NF-κB信号通路有关。 |
| 细胞实验 |
体外成骨细胞分化实验 [1]
将MC3T3-E1细胞以2×10³个/孔的密度接种于含10% FBS的α-MEM培养基的96孔板中。24小时后,用25 ng/mL BMP-2和不同浓度DHCA处理细胞。培养5天后,按照制造商说明书使用白细胞碱性磷酸酶(ALP)检测试剂盒进行检测。 ALP活性测定 [1] 成骨分化后,向每孔加入100 μl含1% Tween-20的对硝基苯磷酸酯(pNPP)ELISA底物系统,37℃孵育30分钟测定ALP活性。加入50 μl 300 mM NaOH终止反应,在405 nm波长处测定吸光度。 MTT法检测 [1] 如前述方法进行MTT检测:MC3T3-E1细胞经BMP-2(25 ng/mL)或不同浓度DHCA处理24-72小时后,加入MTT标记试剂孵育4小时,再加入溶解液。24小时后用酶标仪在550 nm处测定OD值评估细胞毒性。 Western blot分析 [1] 将MC3T3-E1细胞接种于100 mm培养皿,24小时后用BMP-2(25 ng/mL)和不同浓度DHCA处理30分钟。冷PBS洗涤后,用磷酸盐安全提取缓冲液裂解细胞。总蛋白经SDS-PAGE分离后电转至PVDF膜。 荧光素酶报告基因检测 [1] 从QIAGEN购入可诱导雌激素反应元件(ERE)响应型荧光素酶报告质粒。按制造商方案,用lipofectamine 2000将ERE报告质粒与β-半乳糖苷酶质粒(1 μg)共转染MC3T3-E1细胞。转染24小时后,用17β-雌二醇(10 nM)和不同浓度DHCA处理24小时。裂解细胞后,使用荧光素酶报告试剂盒在微孔板发光仪上检测活性,并以β-半乳糖苷酶活性标准化。 MTT实验 [2] RAW 264.7细胞以1×10⁴个/孔接种96孔板,分别用不同浓度DHCA(0-200 μmol/l)和LPS(0-32 μg/ml)处理24小时。每孔加入10 μl MTT(5 mg/ml)继续孵育3小时,弃上清后加入150 μl DMSO溶解甲臜结晶。用Thermo Varioskan Flash多功能酶标仪在492 nm测定吸光度,计算各组细胞存活率。所有实验设三个复孔。 NO和IL-1β产量测定 [2] RAW 264.7细胞在96孔板中分别用DHCA(100/200 μmol/l)预处理4小时,再用1 μg/ml LPS刺激24小时。取50 μl培养上清加100 μl Griess试剂,540 nm处测定亚硝酸盐水平。另用商业ELISA试剂盒检测不同处理组细胞上清中IL-1β含量。所有实验设三个复孔。 免疫荧光检测 [2] RAW 264.7细胞接种6孔板,分别用50/100/200 μmol/l DHCA预处理4小时后,经1 μg/ml LPS刺激24小时。PBS洗涤三次,4%多聚甲醛固定20分钟,0.15% Triton X-100透化10分钟,10%胎牛血清封闭30分钟。与iNOS或NF-κB一抗孵育过夜后,DAPI复染细胞核。荧光显微镜采集图像,NIS-Elements AR软件分析。 Western blot分析 [2] RAW 264.7细胞接种6孔板,经50/100/200 μmol/l DHCA预处理4小时后,用LPS(1 μg/ml)刺激24小时。收集细胞后用含蛋白酶抑制剂的裂解液悬浮,12000g离心10分钟获取裂解物。BCA法测定总蛋白浓度,取30 μg蛋白经10% SDS-聚丙烯酰胺凝胶电泳分离后转至硝酸纤维素膜。4℃过夜孵育含β-actin(1:1000)、NF-κB(1:1000)、IκBα(1:1000)或p-IκBα(1:10000)抗体的tris-甘氨酸电泳缓冲液,室温孵育HRP标记二抗1小时。TBST洗涤三次后,用ECL试剂盒 增强化学发光显影。 |
| 动物实验 |
Establishment of a wound model [2]
All mice were housed under ambient conditions (12-h light/dark cycle at 25 °C) with water and standard mice chow ad libitum and were randomly assigned to four groups including control group, vehicle group and low dose and high dose groups. Subsequently, all mice were anaesthetized with 1% pentobarbital sodium, and fur of the back and scalp were removed with electric shaver. After shaving and sterilization, two full-thickness dermal excisional wounds were made on the mice scalp with a 2-mm sterile biopsy punch. Then, 30 μl of DHCA solution prepared with acetonitrile and olive oil (v/v 4 : 1) was dripped to each wound at a low dose group of 5 mg/ml and a high dose group of 20 mg/ml daily for 9 days. Mice in vehicle control group received vehicle alone, while no treatments were given to the wounds of mice in control group. Wound healing was macroscopically monitored by taking digital photographs at the first seven days. The wound sizes were measured with Image J software, and the percentage of wound contraction was calculated using the formula: wound contraction% = (wound area day 0 − wound area day n/wound area day 0) × 100. Nine days following injury, mice were anesthetized and serum was obtained for analyzing IL-1β level according to the manufacture’s protocol. Wound tissues of the scalp were harvested using 3-mm biopsy punches and were processed by paraffin embedding and fixation. |
| 参考文献 |
|
| 其他信息 |
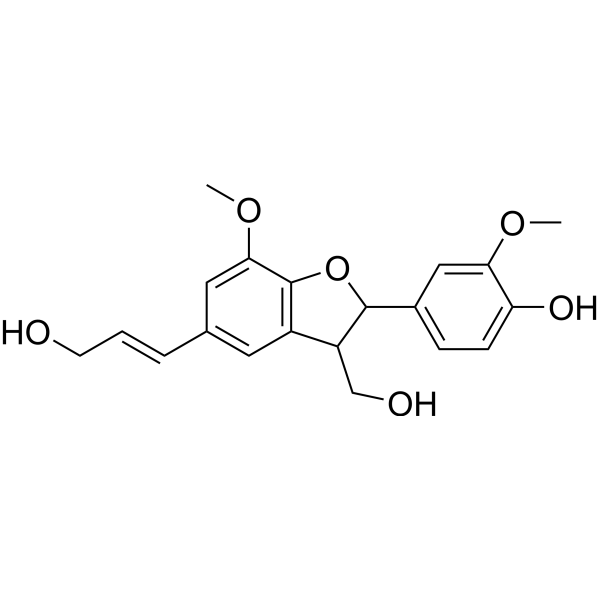
Dehydrodiconiferyl alcohol is a guaiacyl lignin obtained by cyclodimerisation of coniferol. It has a role as a plant metabolite and an anti-inflammatory agent. It is a member of 1-benzofurans, a primary alcohol, a guaiacyl lignin and a member of guaiacols. It is functionally related to a coniferol.
Dehydrodiconiferyl alcohol has been reported in Codonopsis pilosula, Urtica dioica, and other organisms with data available. Our data indicate that DHCA promotes BMP-2-induced osteoblast differentiation by interacting with either ERα or ERβ as an agonist for both receptors. We have recently shown that DHCA inhibits RANKL-induced osteoclast differentiation in vitro and ovariectomy-induced bone loss in vivo (submitted for publication). Taken together, our results indicate that DHCA may be developed as an efficient therapeutic for osteoporosis by controlling the osteoclast/osteoblast ratio through its estrogenic effects.[1] In summary, we reported firstly that DHCA could promote wound healing by accelerating proliferation of epithelial cells, increasing collagen formation and inhibiting infiltration of inflammatory cells in a full-thickness scalp wound healing model in mice. And the inactivation of NF-κB pathways was involved in the anti-inflammatory effects of DHCA in macrophages. These findings brought to light preliminarily the promising therapeutic potential of DHCA in skin wound healing. [2] Objectives: The aim of this study was to investigate the molecular mechanisms of the efficacy of lignin compound dehydrodiconiferyl alcohol (DHCA) isolated from Silybum marianum (L.) Gaertn in improving wound healing. These findings preliminarily brought to light the promising therapeutic potential of DHCA in skin wound healing. Methods: First, the effect of DHCA on healing in vivo was studied using a full-thickness scalp wound model of mice by topical administration. Histopathological examinations were then conducted by haematoxylin and eosin (H&E), Masson's trichrome staining and the immunofluorescence assay. Second, we further examined the anti-inflammatory mechanism of DHCA in lipopolysaccharide (LPS)-induced RAW 264.7 macrophages by immunofluorescence assay and Western blot analysis. [2] |
| 分子式 |
C20H22O6
|
|---|---|
| 分子量 |
358.3851
|
| 精确质量 |
358.142
|
| CAS号 |
4263-87-0
|
| 相关CAS号 |
(7R,8S)-Dehydrodiconiferyl alcohol;155836-29-6;(E)-Dehydrodiconiferyl alcohol;528814-97-3
|
| PubChem CID |
5372367
|
| 外观&性状 |
Typically exists as solid at room temperature
|
| 密度 |
1.292g/cm3
|
| 沸点 |
562ºC at 760mmHg
|
| 熔点 |
161-162℃
|
| 闪点 |
293.7ºC
|
| 折射率 |
1.63
|
| LogP |
2.624
|
| tPSA |
88.38
|
| 氢键供体(HBD)数目 |
3
|
| 氢键受体(HBA)数目 |
6
|
| 可旋转键数目(RBC) |
6
|
| 重原子数目 |
26
|
| 分子复杂度/Complexity |
469
|
| 定义原子立体中心数目 |
0
|
| SMILES |
O1C2C(=C([H])C(/C(/[H])=C(\[H])/C([H])([H])O[H])=C([H])C=2[C@]([H])(C([H])([H])O[H])[C@@]1([H])C1C([H])=C([H])C(=C(C=1[H])OC([H])([H])[H])O[H])OC([H])([H])[H]
|
| InChi Key |
KUSXBOZNRPQEON-ONEGZZNKSA-N
|
| InChi Code |
InChI=1S/C20H22O6/c1-24-17-10-13(5-6-16(17)23)19-15(11-22)14-8-12(4-3-7-21)9-18(25-2)20(14)26-19/h3-6,8-10,15,19,21-23H,7,11H2,1-2H3/b4-3+
|
| 化学名 |
4-[3-(hydroxymethyl)-5-[(E)-3-hydroxyprop-1-enyl]-7-methoxy-2,3-dihydro-1-benzofuran-2-yl]-2-methoxyphenol
|
| 别名 |
Dehydrodiconiferyl alcohol; 4263-87-0; dehydrodiconiferol; 4-[3-(hydroxymethyl)-5-[(E)-3-hydroxyprop-1-enyl]-7-methoxy-2,3-dihydro-1-benzofuran-2-yl]-2-methoxyphenol; lignin cw compound-2004; Coniferyl alcohol, dehydrodi-; Diconiferyl alcohol, dehydro-; CHEBI:91184;
|
| HS Tariff Code |
2934.99.9001
|
| 存储方式 |
Powder -20°C 3 years 4°C 2 years In solvent -80°C 6 months -20°C 1 month |
| 运输条件 |
Room temperature (This product is stable at ambient temperature for a few days during ordinary shipping and time spent in Customs)
|
| 溶解度 (体外实验) |
May dissolve in DMSO (in most cases), if not, try other solvents such as H2O, Ethanol, or DMF with a minute amount of products to avoid loss of samples
|
|---|---|
| 溶解度 (体内实验) |
注意: 如下所列的是一些常用的体内动物实验溶解配方,主要用于溶解难溶或不溶于水的产品(水溶度<1 mg/mL)。 建议您先取少量样品进行尝试,如该配方可行,再根据实验需求增加样品量。
注射用配方
注射用配方1: DMSO : Tween 80: Saline = 10 : 5 : 85 (如: 100 μL DMSO → 50 μL Tween 80 → 850 μL Saline)(IP/IV/IM/SC等) *生理盐水/Saline的制备:将0.9g氯化钠/NaCl溶解在100 mL ddH ₂ O中,得到澄清溶液。 注射用配方 2: DMSO : PEG300 :Tween 80 : Saline = 10 : 40 : 5 : 45 (如: 100 μL DMSO → 400 μL PEG300 → 50 μL Tween 80 → 450 μL Saline) 注射用配方 3: DMSO : Corn oil = 10 : 90 (如: 100 μL DMSO → 900 μL Corn oil) 示例: 以注射用配方 3 (DMSO : Corn oil = 10 : 90) 为例说明, 如果要配制 1 mL 2.5 mg/mL的工作液, 您可以取 100 μL 25 mg/mL 澄清的 DMSO 储备液,加到 900 μL Corn oil/玉米油中, 混合均匀。 View More
注射用配方 4: DMSO : 20% SBE-β-CD in Saline = 10 : 90 [如:100 μL DMSO → 900 μL (20% SBE-β-CD in Saline)] 口服配方
口服配方 1: 悬浮于0.5% CMC Na (羧甲基纤维素钠) 口服配方 2: 悬浮于0.5% Carboxymethyl cellulose (羧甲基纤维素) 示例: 以口服配方 1 (悬浮于 0.5% CMC Na)为例说明, 如果要配制 100 mL 2.5 mg/mL 的工作液, 您可以先取0.5g CMC Na并将其溶解于100mL ddH2O中,得到0.5%CMC-Na澄清溶液;然后将250 mg待测化合物加到100 mL前述 0.5%CMC Na溶液中,得到悬浮液。 View More
口服配方 3: 溶解于 PEG400 (聚乙二醇400) 请根据您的实验动物和给药方式选择适当的溶解配方/方案: 1、请先配制澄清的储备液(如:用DMSO配置50 或 100 mg/mL母液(储备液)); 2、取适量母液,按从左到右的顺序依次添加助溶剂,澄清后再加入下一助溶剂。以 下列配方为例说明 (注意此配方只用于说明,并不一定代表此产品 的实际溶解配方): 10% DMSO → 40% PEG300 → 5% Tween-80 → 45% ddH2O (或 saline); 假设最终工作液的体积为 1 mL, 浓度为5 mg/mL: 取 100 μL 50 mg/mL 的澄清 DMSO 储备液加到 400 μL PEG300 中,混合均匀/澄清;向上述体系中加入50 μL Tween-80,混合均匀/澄清;然后继续加入450 μL ddH2O (或 saline)定容至 1 mL; 3、溶剂前显示的百分比是指该溶剂在最终溶液/工作液中的体积所占比例; 4、 如产品在配制过程中出现沉淀/析出,可通过加热(≤50℃)或超声的方式助溶; 5、为保证最佳实验结果,工作液请现配现用! 6、如不确定怎么将母液配置成体内动物实验的工作液,请查看说明书或联系我们; 7、 以上所有助溶剂都可在 Invivochem.cn网站购买。 |
| 制备储备液 | 1 mg | 5 mg | 10 mg | |
| 1 mM | 2.7903 mL | 13.9513 mL | 27.9026 mL | |
| 5 mM | 0.5581 mL | 2.7903 mL | 5.5805 mL | |
| 10 mM | 0.2790 mL | 1.3951 mL | 2.7903 mL |
1、根据实验需要选择合适的溶剂配制储备液 (母液):对于大多数产品,InvivoChem推荐用DMSO配置母液 (比如:5、10、20mM或者10、20、50 mg/mL浓度),个别水溶性高的产品可直接溶于水。产品在DMSO 、水或其他溶剂中的具体溶解度详见上”溶解度 (体外)”部分;
2、如果您找不到您想要的溶解度信息,或者很难将产品溶解在溶液中,请联系我们;
3、建议使用下列计算器进行相关计算(摩尔浓度计算器、稀释计算器、分子量计算器、重组计算器等);
4、母液配好之后,将其分装到常规用量,并储存在-20°C或-80°C,尽量减少反复冻融循环。
计算结果:
工作液浓度: mg/mL;
DMSO母液配制方法: mg 药物溶于 μL DMSO溶液(母液浓度 mg/mL)。如该浓度超过该批次药物DMSO溶解度,请首先与我们联系。
体内配方配制方法:取 μL DMSO母液,加入 μL PEG300,混匀澄清后加入μL Tween 80,混匀澄清后加入 μL ddH2O,混匀澄清。
(1) 请确保溶液澄清之后,再加入下一种溶剂 (助溶剂) 。可利用涡旋、超声或水浴加热等方法助溶;
(2) 一定要按顺序加入溶剂 (助溶剂) 。