| 规格 | 价格 | 库存 | 数量 |
|---|---|---|---|
| 1mg |
|
||
| 5mg |
|
||
| 10mg |
|
||
| 25mg |
|
||
| 50mg |
|
||
| 100mg |
|
||
| 1g | |||
| Other Sizes |
| 靶点 |
Target: IFN-γ, IL-6, IL-17, and TNF-α[1]
|
|---|---|
| 体外研究 (In Vitro) |
在 T84 细胞中,2'-岩藻糖基乳糖(2'-FL;0–12 mg/mL;48 小时)可减弱 LPS (100 μg/mL) 并刺激 IL-8 分泌,同时抑制细胞相关的 CD14 表达[1]。在 T84 和 HCT8 细胞中,2'-岩藻糖基乳糖(2 mg/mL;48 小时)可减少细菌入侵引起的炎症。抑制 ETEC 侵袭和减少随后的 IL-8 释放是 2'-岩藻糖基乳糖的两个作用[1]。在 T84 和 HCT8 细胞中,2'-岩藻糖基乳糖(2 mg/mL;48 小时)可激活巨噬细胞迁移抑制因子的信号通路,从而减少炎症[1]。
2′-FL/2′-岩藻糖基乳糖抑制CD14表达[1] LPS在UPEC侵入膀胱上皮和ETEC侵入T84细胞期间介导促炎信号传导(未显示)。LPS在100 μg/mL引发T84细胞显著释放IL-8(见在线补充图S5),HMOS减弱了这种诱导作用(图1A)。在这个更简单的简化模型中,分别测试了2′-FL/2′-岩藻糖基乳糖、3-FL、6′-SL、3′-SL,LNFP I和TFiLNO(图1B)在母乳中的浓度对减轻炎症的能力(图1C)。只有2′-FL抑制了LPS诱导的T84细胞中IL-8水平的诱导(图1B)。 At 2 mg/mL,2′-FL使LPS处理的T84细胞中诱导的IL-8分泌降低了45%,与5 mg/mL HMOS(图1B)。2′-FL的抑制作用呈剂量依赖性(图1D,E),4μmol/L对IL-8诱导的抑制作用达到80%时趋于平稳 mg/mL 2′-FL(图1E)。细胞松弛素D抑制ETEC用于侵袭的T84细胞中的细胞内肌动蛋白机制。孵化2 μM细胞松弛素D在2′-FL存在或不存在的情况下均不影响IL-8的基础表达(图1F,第5和第6条)。ETEC感染前T84细胞的细胞松弛素D预处理降低了暴露于ETEC后IL-8的诱导(图1F,第3条和第7条)。2′-FL无法抑制残留的IL-8表达(图1F,第7条和第8条),表明2′-FL仅抑制ETEC侵袭特异性诱导的IL-8。 2′-FL/2′-岩藻糖基乳糖改善细菌入侵引起的炎症[1] 与上述对LPS的影响一致,2 mg/mL 2′-FL/2′-岩藻糖基乳糖抑制了T84细胞中ETEC的侵袭,并抑制了相关的IL-8诱导(图3A),与5 mg/mL HMOS见在线补充图S1。为了确保2′-FL显示的抑制作用对T84细胞系不是特异性的,在HCT8细胞中测试了2′-FL活性,HCT8细胞是一种对ETEC侵袭特别敏感的IEC人回肠细胞系。在这些HCT8细胞中,预处理48 h,2′-FL为2 mg/mL抑制ETEC侵袭并减弱随后的IL-8分泌(图3B)。 为了测试上述观察结果是否适用于其他1型菌毛生物,在另外两种1型菌皮大肠杆菌AIEC(LF82菌株)和UPEC(CF073菌株)中测试了2′-FL抑制炎症信号传导的能力。作为对照,我们测试了2′-FL在鼠伤寒沙门氏菌(SL1344菌株)侵袭T84时的活性,该菌株的侵袭独立于1型菌毛,而需要III型分泌系统或拉链样或触发器样进入过程。2′-FL分别抑制AIEC和UPEC侵袭T84细胞约50%(图3C,D),抑制IL-8产生约25%和约40%(未显示)。尽管SL1344的侵袭受到总HMOS的抑制,但2′-FL没有抑制(图3E)。这表明2′-FL以外的HMOS成分可能抑制其他发病机制,但2′-FL特异性抑制1型菌毛发病。 2′-FL/2′-岩藻糖基乳糖诱导巨噬细胞移动抑制因子信号通路,抑制炎症[1] 在T84细胞中研究了与2′-FL诱导的CD14表达变化相关的细胞内信号传导的变化。通过512种信号蛋白抗体阵列测量信号分子。使用GenePix Pro阵列分析软件分析Cy5/Cy3荧光信号比。根据统计显著性,将筛选标准设置为>1.3或<0.77的内部归一化比率,并对多重比较进行校正。 根据这些标准,2′-FL/2′-岩藻糖基乳糖处理细胞显著调节了28个信号分子(表1)。使用Metacore(GeneGo,http://trials.genego.com).巨噬细胞移动抑制因子(MIF)炎症信号网络的亚群表现出2′-FL诱导的变化,与2′-FL诱导的抗炎结果相匹配(见在线补充图S6)。2′-FL处理诱导的抗体微阵列配体的这些变化通过LPS/TLR4信号通路介质的蛋白质印迹得到证实:2′-FL抑制CD14和NF-κB的表达,同时诱导NF-κB信号通路的负调节因子iκB的表达式(图4A)。TLR4和MyD88的表达没有变化(图4A)。Erk磷酸化减少,而p38和Akt磷酸化增加(图4A)。在细胞因子信号传导抑制剂(SOCSs)中,2′-FL增加了SOCS2的表达,但没有增加SOCS1或SOCS3的表达(图4A)。2′-FL增加了信号转导子和转录激活子3(STAT3)的磷酸化(激活),STAT3是几个SOCS通路共享的下游信号分子,但STAT1没有(图4A)。图4B显示了所有测量的信号分子的蛋白质印迹强度的变化。在H4细胞(未成熟肠上皮细胞模型)中,2′-FL调节了类似的信号分子:CD14和NF-κB的诱导受到抑制,而iκB和SOCS2的表达以及STAT3的磷酸化被诱导(图4C)。因此,2′-FL在未成熟和成熟肠上皮细胞模型中调节了相同的信号通路。 |
| 体内研究 (In Vivo) |
2'-岩藻糖基乳糖(2'-FL;100 mg(200 μL);ig;每天,持续 4 天;患有 AIEC 感染的 C57BL/6 小鼠)可减少体内炎症和 AIEC 感染[1]。
2'-FL/2'-岩藻糖基乳糖抑制体内AIEC感染和炎症[1] 在第4天用0.25%DSS(低剂量)和链霉素治疗三天会破坏小鼠的微生物群。第5天接种AIEC导致明显感染,表现为AIEC后3天和4天体重减轻(约10%)<接种前4天每天一次强饲>2'-岩藻糖基乳糖/2′-FL可防止体重减轻(图5A)。AIEC感染的小鼠结肠缩短,但用2′-FL预处理的AIEC接种小鼠的结肠长度更接近正常(图5B)。针对O83抗原的抗体(在LPS阳性的AIEC LF82上表达)显示,2′-FL预处理组的定植较少(图5C)。来自新鲜粪便(未显示)和结肠的培养物证实,接种AIEC的2′-FL预处理组小鼠的菌落较少(图5D)。2′-FL处理的小鼠结肠隐窝中AIEC诱导的CD14表达较少(图5E),粘膜肌层中CD14阳性细胞较少(未显示),CD14 mRNA水平较低(图5F)。AIEC感染小鼠结肠组织的H&E染色显示上皮细胞脱落、免疫细胞浸润和肌层粘膜增生,而2′-FL预处理小鼠的结肠显示出较少的炎症表现(见在线补充图S7)。AIEC感染伴随着小鼠黏膜主要炎性细胞因子IL-6、IL-17和TNF-α的升高,2′-FL预处理抑制了这种诱导(图5G)。AIEC感染和2′-FL均未对IL-1β、IFN-γ和IL-10产生显著影响(未显示)。 |
| 酶活实验 |
体外LPS刺激[1]
IEC在24孔板中以每孔5×104个细胞(亚融合)的速度培养48 h在500 μL培养基含有接近生理水平的HMOS(HMOS,5 mg/mL;2'-岩藻糖基乳糖/2′-FL,2 mg/mL;3-FL,0.4 mg/mL;6′-SL,0.5 mg/mL;3′-SL,0.5 mg/mL;LNFP I,2.5 mg/mL;TFiLNO,3 pg/mL),然后LPS(大肠杆菌)刺激(T84细胞100 μg/mL;H4电池200 ng/mL)持续16分钟 h.上清液在-20°C下储存,直至分析。 细胞松弛素D[1]抑制ETEC感染 细胞松弛素D是一种肌动蛋白聚合抑制剂,可灭活细菌入侵所需的宿主细胞机制。将细胞松弛素D(2μM)加入T84细胞培养基中30 在接种ETEC(MOI=20)前min和暴露于ETEC后,在六个重复实验中测量了2'-Fucosyllactose/2′-FL抑制IL-8表达的能力。 |
| 细胞实验 |
蛋白质印迹分析[1]
细胞类型: T84 细胞 测试浓度: 0、2 和 4 mg/mL 孵育持续时间:48 小时 实验结果:抑制 CD14 mRNA 并降低细胞相关 CD14 蛋白表达。 蛋白质印迹分析[1] 细胞类型: T84 和 HCT8 细胞T84 和 HCT8 细胞 测试浓度: 2 mg/mL 孵育持续时间:48小时 实验结果:抑制CD14 mRNA并降低细胞相关CD14蛋白表达。抑制 CD14 和 NF-κB 诱导。诱导 iκB 和 SOCS2 表达以及 STAT3 磷酸化。 |
| 动物实验 |
Animal/Disease Models: C57BL/6 mice (8 weeks) with AIEC (uropathogenic E. coli, and adherent-invasive E. coli) infection[1]
Doses: 100 mg (200 μL) Route of Administration: po (oral gavage); daily, for 4 days Experimental Results: Had colons lengths were closer to normal. Inhibited the colonization of the colonic mucosa by O83-positive bacteria. diminished CD14 expression, CD14 mRNA levels, IL-6, IL-17 and TNF -α levels in colonic. In vivo study: A murine model of AIEC infection.37 ,38 was adapted and validated. Eight-week-old female C57BL/6 mice received 0.25% dextran sodium sulfate (DSS) in their drinking water for 3 days, and were given 20 mg of streptomycin by gavage on day 4; half also received 100 mg of 2'-Fucosyllactose/2′-FL in 200 μL by gavage for each of the 4 days. On the 5th day, the two groups of experimental mice were inoculated with 109 colony forming unit (CFU) AIEC via 200 μL gavage and sacrificed after an additional 4 days; a control group received DSS and antibiotic, but only a sham PBS inoculation. Body weight was monitored daily. AIEC in faeces and colonic tissue were quantified as CFU on erythromycin/ampicillin LB plates.37 Formalin (4%) fixed, paraffin-embedded 5 μm sections of mouse colon were stained with H&E. Cryosections (5 μm) of mouse colons stained with CD14 or O83 antibodies were studied by confocal microscopy. Total RNA was extracted from other colonic samples with Trizol for real-time quantitative PCR of CD14 mRNA levels, and protein was extracted for ELISA analysis of proinflammatory cytokines. |
| 参考文献 |
|
| 其他信息 |
2'-Fucosyllactose is under investigation in clinical trial NCT03847467 (Pilot and Feasibility Study of 2'-FL as a Dietary Supplement in IBD Patients Receiving Stable Maintenance Anti-tnf Therapy).
Background: A major cause of enteric infection, Gram-negative pathogenic bacteria activate mucosal inflammation through lipopolysaccharide (LPS) binding to intestinal toll-like receptor 4 (TLR4). Breast feeding lowers risk of disease, and human milk modulates inflammation. Objective: This study tested whether human milk oligosaccharides (HMOSs) influence pathogenic Escherichia coli-induced interleukin (IL)-8 release by intestinal epithelial cells (IECs), identified specific proinflammatory signalling molecules modulated by HMOSs, specified the active HMOS and determined its mechanism of action. Methods: Models of inflammation were IECs invaded by type 1 pili enterotoxigenic E. coli (ETEC) in vitro: T84 modelled mature, and H4 modelled immature IECs. LPS-induced signalling molecules co-varying with IL-8 release in the presence or absence of HMOSs were identified. Knockdown and overexpression verified signalling mediators. The oligosaccharide responsible for altered signalling was identified. Results: HMOSs attenuated LPS-dependent induction of IL-8 caused by ETEC, uropathogenic E. coli, and adherent-invasive E. coli (AIEC) infection, and suppressed CD14 transcription and translation. CD14 knockdown recapitulated HMOS-induced attenuation. Overexpression of CD14 increased the inflammatory response to ETEC and sensitivity to inhibition by HMOSs. 2'-fucosyllactose (2'-FL), at milk concentrations, displayed equivalent ability as total HMOSs to suppress CD14 expression, and protected AIEC-infected mice. Conclusions: HMOSs and 2'-FL directly inhibit LPS-mediated inflammation during ETEC invasion of T84 and H4 IECs through attenuation of CD14 induction. CD14 expression mediates LPS-TLR4 stimulation of portions of the 'macrophage migration inhibitory factors' inflammatory pathway via suppressors of cytokine signalling 2/signal transducer and activator of transcription 3/NF-κB. HMOS direct inhibition of inflammation supports its functioning as an innate immune system whereby the mother protects her vulnerable neonate through her milk. 2'-FL, a principal HMOS, quenches inflammatory signalling.[1] Human milk contains large amounts of free oligosaccharides (HMOs). HMOs have been shown to exert antiinflammatory properties, and evidence for their immunomodulatory effects is increasing. The purpose of this study was to evaluate influences of two human breast milk-derived oligosaccharide samples (neutral and acidic oligosaccharides), and of a low-molecular-weight fucoidan on cytokine production and activation of cord blood mononuclear cells. Cord blood mononuclear cells from randomly chosen healthy newborns were co-cultured with the oligosaccharide samples. By means of flow cytometry, intracellular cytokine production (d 20) and surface marker expression of T cells (d 5) were measured. In vitro-induced Ig levels were quantified nephelometrically (total IgG1) and by ELISA (total IgE) in the supernatant of cell cultures. The acidic oligosaccharide fraction increased the percentage of interferon-gamma producing CD3+CD4+ and CD3+CD8+ cells (p < 0.05) and the IL-13 production in CD3+CD8+ cells (p < 0.05). In acidic oligosaccharide cultures, CD25+ expression on CD3+CD4+ cells was significantly elevated (p < 0.05). Low-molecular-weight fucoidan induced IL-4 production in CD3+CD4+ T cells (p < 0.05) and IL-13 production in CD3+CD8+ T cells (p < 0.05), whereas interferon-gamma production remained unaffected in both T-cell populations. Ig production (total IgE and total IgG1) remained unaffected. Human milk-derived oligosaccharides and plant-derived oligosaccharides affect the cytokine production and activation of cord blood derived T cells in vitro. Therefore, oligosaccharides and, in particular, acidic oligosaccharides may influence lymphocyte maturation in breast-fed newborns.[2] |
| 分子式 |
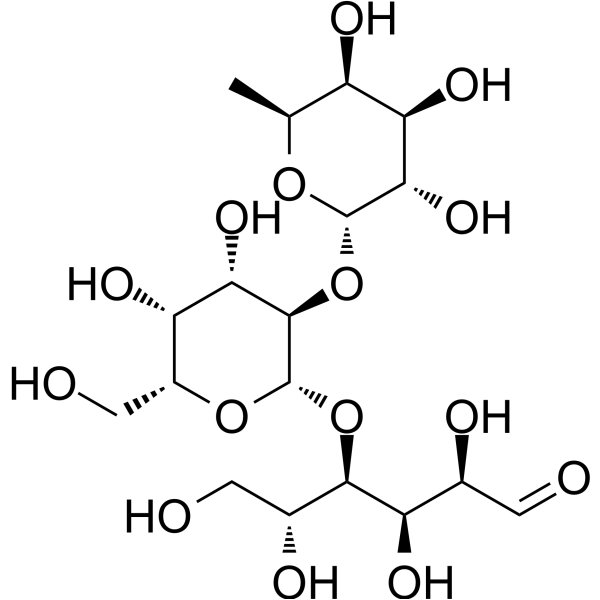
C18H32O15
|
|---|---|
| 分子量 |
488.44
|
| 精确质量 |
488.174
|
| 元素分析 |
C, 44.26; H, 6.60; O, 49.13
|
| CAS号 |
41263-94-9
|
| PubChem CID |
170484
|
| 外观&性状 |
White to off-white solid powder
|
| 密度 |
1.68g/cm3
|
| 沸点 |
902.2ºC at 760 mmHg
|
| 熔点 |
230-231 °C
|
| 闪点 |
311.9ºC
|
| 蒸汽压 |
0mmHg at 25°C
|
| 折射率 |
1.631
|
| LogP |
-6.1
|
| tPSA |
248.45
|
| 氢键供体(HBD)数目 |
10
|
| 氢键受体(HBA)数目 |
15
|
| 可旋转键数目(RBC) |
10
|
| 重原子数目 |
33
|
| 分子复杂度/Complexity |
609
|
| 定义原子立体中心数目 |
14
|
| SMILES |
C[C@H]1[C@H]([C@H]([C@@H]([C@@H](O1)O[C@@H]2[C@H]([C@H]([C@H](O[C@H]2O[C@H]([C@@H](CO)O)[C@@H]([C@H](C=O)O)O)CO)O)O)O)O)O
|
| InChi Key |
HWHQUWQCBPAQQH-BWRPKUOHSA-N
|
| InChi Code |
InChI=1S/C18H32O15/c1-5-9(24)12(27)14(29)17(30-5)33-16-13(28)11(26)8(4-21)31-18(16)32-15(7(23)3-20)10(25)6(22)2-19/h2,5-18,20-29H,3-4H2,1H3/t5-,6-,7+,8+,9+,10+,11-,12+,13-,14-,15+,16+,17-,18-/m0/s1
|
| 化学名 |
(2R,3R,4R,5R)-4-[(2S,3R,4S,5R,6R)-4,5-dihydroxy-6-(hydroxymethyl)-3-[(2S,3S,4R,5S,6S)-3,4,5-trihydroxy-6-methyloxan-2-yl]oxyoxan-2-yl]oxy-2,3,5,6-tetrahydroxyhexanal
|
| 别名 |
2'-Fucosyllactose; 41263-94-9; 2'-O-fucosyllactose; Lactose, 2'-o-fucosyl-; 2'-o-l-fucosyl-d-lactose; XO2533XO8R; UNII-XO2533XO8R; DTXSID40194179;
|
| HS Tariff Code |
2934.99.9001
|
| 存储方式 |
Powder -20°C 3 years 4°C 2 years In solvent -80°C 6 months -20°C 1 month 注意: 本产品在运输和储存过程中需避光。 |
| 运输条件 |
Room temperature (This product is stable at ambient temperature for a few days during ordinary shipping and time spent in Customs)
|
| 溶解度 (体外实验) |
H2O : 50 mg/mL (102.37 mM)
|
|---|---|
| 溶解度 (体内实验) |
注意: 如下所列的是一些常用的体内动物实验溶解配方,主要用于溶解难溶或不溶于水的产品(水溶度<1 mg/mL)。 建议您先取少量样品进行尝试,如该配方可行,再根据实验需求增加样品量。
注射用配方
注射用配方1: DMSO : Tween 80: Saline = 10 : 5 : 85 (如: 100 μL DMSO → 50 μL Tween 80 → 850 μL Saline)(IP/IV/IM/SC等) *生理盐水/Saline的制备:将0.9g氯化钠/NaCl溶解在100 mL ddH ₂ O中,得到澄清溶液。 注射用配方 2: DMSO : PEG300 :Tween 80 : Saline = 10 : 40 : 5 : 45 (如: 100 μL DMSO → 400 μL PEG300 → 50 μL Tween 80 → 450 μL Saline) 注射用配方 3: DMSO : Corn oil = 10 : 90 (如: 100 μL DMSO → 900 μL Corn oil) 示例: 以注射用配方 3 (DMSO : Corn oil = 10 : 90) 为例说明, 如果要配制 1 mL 2.5 mg/mL的工作液, 您可以取 100 μL 25 mg/mL 澄清的 DMSO 储备液,加到 900 μL Corn oil/玉米油中, 混合均匀。 View More
注射用配方 4: DMSO : 20% SBE-β-CD in Saline = 10 : 90 [如:100 μL DMSO → 900 μL (20% SBE-β-CD in Saline)] 口服配方
口服配方 1: 悬浮于0.5% CMC Na (羧甲基纤维素钠) 口服配方 2: 悬浮于0.5% Carboxymethyl cellulose (羧甲基纤维素) 示例: 以口服配方 1 (悬浮于 0.5% CMC Na)为例说明, 如果要配制 100 mL 2.5 mg/mL 的工作液, 您可以先取0.5g CMC Na并将其溶解于100mL ddH2O中,得到0.5%CMC-Na澄清溶液;然后将250 mg待测化合物加到100 mL前述 0.5%CMC Na溶液中,得到悬浮液。 View More
口服配方 3: 溶解于 PEG400 (聚乙二醇400) 请根据您的实验动物和给药方式选择适当的溶解配方/方案: 1、请先配制澄清的储备液(如:用DMSO配置50 或 100 mg/mL母液(储备液)); 2、取适量母液,按从左到右的顺序依次添加助溶剂,澄清后再加入下一助溶剂。以 下列配方为例说明 (注意此配方只用于说明,并不一定代表此产品 的实际溶解配方): 10% DMSO → 40% PEG300 → 5% Tween-80 → 45% ddH2O (或 saline); 假设最终工作液的体积为 1 mL, 浓度为5 mg/mL: 取 100 μL 50 mg/mL 的澄清 DMSO 储备液加到 400 μL PEG300 中,混合均匀/澄清;向上述体系中加入50 μL Tween-80,混合均匀/澄清;然后继续加入450 μL ddH2O (或 saline)定容至 1 mL; 3、溶剂前显示的百分比是指该溶剂在最终溶液/工作液中的体积所占比例; 4、 如产品在配制过程中出现沉淀/析出,可通过加热(≤50℃)或超声的方式助溶; 5、为保证最佳实验结果,工作液请现配现用! 6、如不确定怎么将母液配置成体内动物实验的工作液,请查看说明书或联系我们; 7、 以上所有助溶剂都可在 Invivochem.cn网站购买。 |
| 制备储备液 | 1 mg | 5 mg | 10 mg | |
| 1 mM | 2.0473 mL | 10.2367 mL | 20.4733 mL | |
| 5 mM | 0.4095 mL | 2.0473 mL | 4.0947 mL | |
| 10 mM | 0.2047 mL | 1.0237 mL | 2.0473 mL |
1、根据实验需要选择合适的溶剂配制储备液 (母液):对于大多数产品,InvivoChem推荐用DMSO配置母液 (比如:5、10、20mM或者10、20、50 mg/mL浓度),个别水溶性高的产品可直接溶于水。产品在DMSO 、水或其他溶剂中的具体溶解度详见上”溶解度 (体外)”部分;
2、如果您找不到您想要的溶解度信息,或者很难将产品溶解在溶液中,请联系我们;
3、建议使用下列计算器进行相关计算(摩尔浓度计算器、稀释计算器、分子量计算器、重组计算器等);
4、母液配好之后,将其分装到常规用量,并储存在-20°C或-80°C,尽量减少反复冻融循环。
计算结果:
工作液浓度: mg/mL;
DMSO母液配制方法: mg 药物溶于 μL DMSO溶液(母液浓度 mg/mL)。如该浓度超过该批次药物DMSO溶解度,请首先与我们联系。
体内配方配制方法:取 μL DMSO母液,加入 μL PEG300,混匀澄清后加入μL Tween 80,混匀澄清后加入 μL ddH2O,混匀澄清。
(1) 请确保溶液澄清之后,再加入下一种溶剂 (助溶剂) 。可利用涡旋、超声或水浴加热等方法助溶;
(2) 一定要按顺序加入溶剂 (助溶剂) 。