| 规格 | 价格 | |
|---|---|---|
| 500mg | ||
| 1g | ||
| Other Sizes |

| 靶点 |
Trypsin-like serine proteases; Tryptase (Ki = 20 μM); Trypsin (Ki = 21 μM)
|
|---|---|
| 体外研究 (In Vitro) |
Benzamidine盐酸盐(50 μM)可降低成纤维细胞的[³H]胸苷合成,表明其与活性催化位点存在耦合作用。苯甲脒盐酸盐能减弱类胰蛋白酶促进胶原合成的能力[2]。
结合脒类抑制剂结构的变异性[1] 通过比较表1中加粗条目所示的uPA、tPA、胰蛋白酶和凝血酶的抑制剂复合物结构,可发现这类小分子抑制剂的结合模式存在显著多样性。根据结合抑制剂芳香环平面的取向,这些复合物大致可分为两组:第一组抑制剂围绕其长对称轴相对于第二组旋转约20°。因此,为维持S1位点的氢键相互作用,第一组中的脒基会围绕脒基-芳香键相对于第二组旋转约-20°。第一组包括胰蛋白酶-、凝血酶-和uPA-4-碘苯并[b]噻吩-2-甲脒,uPA-噻吩并[2,3-b]吡啶-2-甲脒,以及uPA-和tPA-苄脒;第二组包含胰蛋白酶-和凝血酶-苄脒,以及胰蛋白酶-噻吩并[2,3-b]吡啶-甲脒。结合抑制剂的芳香脒二面角范围为-20°至+18°(表2)。 类胰蛋白酶丝氨酸蛋白酶复合物中S1位点结构的多样性[1] Benzamidine/苄脒或其他小分子脒类抑制剂在类胰蛋白酶复合物中结合结构的差异,反映了相应S1位点架构存在微妙但重要的变化。在uPA-苄脒复合物中,OγSer190、OηTyr228和水分子1的位置较胰蛋白酶-苄脒复合物发生了约0.5 Å的位移(图2a,表3a)。在胰蛋白酶-苄脒(及多数其他胰蛋白酶-脒类复合物)中,水分子1形成四个氢键:接受来自OγSer190(3.14±0.06 Å)和N1苄脒(3.04±0.06 Å)的氢键,同时向OTrp215(3.06±0.06 Å)和OVal227(2.87±0.05 Å)提供氢键(表2)。而在uPA-苄脒中,后两个氢键消失(水分子1–OTrp215=3.4 Å,水分子1–OVal227=3.3 Å),此时N1–OγSer190和水分子1–OγSer190的氢键距离(2.5 Å和2.8 Å)比其他胰蛋白酶和uPA复合物更短(表2)。这种水分子介导的氢键差异在uPA-和胰蛋白酶-4-碘苯并[b]噻吩-2-甲脒复合物中未出现,二者均保持水分子1与OγSer190、N1及OVal/Phe227的氢键(表2)。 对比uPA-和凝血酶-苄脒结构(图2b)可见,uPA的S1位点深度较凝血酶显著增加。结合苄脒位移0.5 Å,Asp189侧链相应位移约0.6 Å(表3a)。当使用相同抑制剂时,uPA与凝血酶的Asp189侧链相对位置差异最为显著(整体RMSD达0.29 Å),而uPA与tPA的S1位点结构高度相似(图3c)。苄脒在这两种蛋白酶中的结合位置、取向及平面性相似,但tPA复合物中Ser190侧链缺失导致其抑制效能降低7.7倍[1]。 抑制剂复合物与对应游离酶的结构比较[1] 胰蛋白酶中与抑制剂结合的蛋白基团(Oδ1,2Asp189、OγSer190和OGly219)的B因子显著降低(表S1b),OγSer190原子在胰蛋白酶-苄脒复合物中位移达0.5 Å(表3b)。苄脒与凝血酶结合会降低Nϵ2His57、Oδ1,2Asp189和CβAla190的B因子(表S1b)。凝血酶结合抑制剂引发的结构变化较胰蛋白酶更显著:凝血酶-苄脒/游离凝血酶的RMSD为0.27 Å,而胰蛋白酶对应值为0.14 Å(表3b)。苄脒诱导凝血酶S1位点沿CαGlu192–CαTrp215向量收缩0.8 Å(胰蛋白酶仅收缩0.2 Å),反映在CαGlu192位置0.6 Å的变化(表3b)。 介导S1位点结合的"水分子1"在游离胰蛋白酶(图4a)、凝血酶(图4b)和因子Xa中位置相似。游离胰蛋白酶中该水分子与OγSer190、OVal227、OTrp215形成氢键(类似胰蛋白酶-苄脒复合物),并与另一有序水分子形成第四个氢键(图4a)。尽管其运动性(B=29 Ų)较复合物状态(B=18–25 Ų)有所增加,但其位置和取向在游离酶中仍高度有序。 预孵育类胰蛋白酶与亮抑酶肽或苄脒盐酸盐均可减少成纤维细胞对[³H]胸苷的摄取(图1A),提示该过程依赖活性催化位点。使用相同浓度抑制剂时,亮抑酶肽对类胰蛋白酶(18/36 mU/ml)水解BAPNA的活性抑制率达90%,苄脒盐酸盐为75%。单独使用这两种抑制剂不影响[³H]胸苷摄取(图1B)。本研究中所有类胰蛋白酶制剂均以1:1(wt/wt)比例含肝素以维持酶活,但实验浓度肝素对细胞增殖无显著影响(图1B)[2]。 [³H]脯氨酸掺入实验显示,类胰蛋白酶可使成纤维细胞上清中胶原合成增加2.5倍(图3A)。亮抑酶肽和苄脒盐酸盐能减弱该刺激作用。120 mU/ml类胰蛋白酶组反应降低但无细胞毒性(显微镜观察单层细胞完整)。由于合成胶原主要释放至上清(图3B显示极少细胞残留),15/30 mU/ml组细胞裂解物中脯氨酸掺入量轻微增加(30 mU/ml组不受苄脒盐酸盐抑制),可能反映非特异性结合的残留胶原。单独使用抑制剂或肝素(10-100 mg/ml)对胶原合成无显著影响[2] |
| 酶活实验 |
人凝血酶-乙酰水蛭素及其复合物。[1]
酶-乙酰水蛭素复合物按前述方法制备:将凝血酶(1.0 mg/ml,溶于50 mM HEPES,50%甘油,pH 7.0)与1.0 mM乙酰水蛭素在4℃孵育1小时,实验组分别添加5当量4-碘苯并[b]噻吩-2-甲脒、10 mM 苄脒或饱和浓度[2,3-b]噻吩并吡啶-2-甲脒(~2 mM)。使用Amicon Centricon 10超滤浓缩至~10 mg/ml时去除甘油。通过气相扩散悬滴法(经晶种划线接种)获得结晶,空间群C2(a=71.2,b=71.8,c=72.7 Å,β=100.7°),pH 7.3或7.8,含/不含小分子抑制剂。S1位点无抑制剂的结构称为apo-凝血酶。悬滴由3 μl复合物溶液与3 μl储液(0.10 M HEPES,0.30 M NaCl,22%(体积比)PEG 5K单甲醚,pH 7.5或8.2)混合形成。>0.2 mm的大单晶在一周内长出。 牛胰蛋白酶复合物及无抑制剂胰蛋白酶。[1] 胰蛋白酶按已报道方法结晶。P3121空间群的胰蛋白酶-苄脒复合物结构在2.02 M MgSO₄·7H₂O,100 mM MES,1.0 mM CaCl₂,pH 7.5条件下解析,分辨率1.20 Å。甲脒类复合物通过将胰蛋白酶-苄脒晶体浸泡于抑制剂饱和的合成母液中制备,浸泡液每日更换1次,共更换4次。pH 8.2的复合物浸泡液含1.73 M MgSO₄·7H₂O,150 mM Tris,1 mM CaCl₂和2%二甲基亚砜(DMSO)。pH 5.5的4-碘苯并[b]噻吩-2-甲脒复合物使用85%饱和柠檬酸钠,1 mM CaCl₂,2.0% DMSO,抑制剂饱和溶液(pH 5.5,用饱和柠檬酸调节pH)。噻吩并[2,3-b]吡啶-2-甲脒复合物(pH 5.5)的浸泡液为1.73 M MgSO₄·7H₂O,150 mM MES,1 mM CaCl₂,2% DMSO。制备无抑制剂胰蛋白酶晶体时,将胰蛋白酶-苄脒晶体在1.84 M MgSO₄·7H₂O,150 mM MES或Tris,1.0 mM CaCl₂(目标pH值)中浸泡数周,期间定期更换浸泡液。 |
| 细胞实验 |
细胞增殖实验。用非酶细胞解离液将汇合的成纤维细胞从培养瓶中分离,以10⁵个细胞/ml密度接种于含10%胎牛血清(FCS)的MEM培养基的96孔微孔板中。待细胞汇合后,更换为无血清(SF)培养基(含5 mg/ml牛胰腺胰岛素、5 mg/ml转铁蛋白和5 ng/ml亚硒酸钠的MEM)。血清剥夺24小时后,加入经肝素(1:1,wt/wt,用于稳定酶活性)在4℃下对PBS透析24小时的纯化类胰蛋白酶。在使用蛋白酶抑制剂的实验中,含肝素的类胰蛋白酶与亮抑酶肽或Benzamidine/苄脒盐酸盐在4℃预孵育1小时,随后测定类胰蛋白酶对BAPNA的水解活性以计算抑制率。未加抑制剂的对照组类胰蛋白酶在相同条件下孵育。抑制剂浓度经预实验证实对成纤维细胞无毒性且不影响胸苷掺入。处理后,细胞在37℃培养32小时,最后8小时每孔加入1 μCi甲基-[³H]胸苷以检测DNA合成。收获细胞后用闪烁液计数。此外,将成纤维细胞接种于24孔板,与两个最适剂量类胰蛋白酶孵育72小时,台盼蓝染色后通过Neubauer血球计数板计数测定总细胞数。[2]
胶原测定实验。通过检测[³H]脯氨酸掺入量测定胶原合成。将成纤维细胞以10⁵/ml密度接种于96孔板,在含10% FCS和无脯氨酸/羟脯氨酸的MEM中培养至汇合。汇合细胞血清剥夺48小时后进行处理。含肝素(1:1,wt/wt)的纯化类胰蛋白酶经MEM透析后使用。通过25 mU/ml类胰蛋白酶(含肝素)与1 μCi [³H]脯氨酸共同孵育3、6、24和48小时确定胶原生成时程。总蛋白合成量通过100 μl细胞上清液玻璃纤维滤膜沉淀后闪烁计数测定。非胶原蛋白测定:取另一份100 μl上清液,用40 μg纯化细菌胶原酶37℃消化2小时(Peterkofsky和Diegelman法),沉淀的胶原酶抗性蛋白定义为非胶原蛋白。预实验证实该浓度胶原酶2小时可完全消化上清中胶原蛋白(数据未显示)。总蛋白与非胶原蛋白计数差值反映胶原合成量。对照组上清与纯化胰蛋白酶(Worthington)孵育以验证胶原酶特异性(数据未显示)。后续实验中,用不同剂量类胰蛋白酶(含肝素)处理细胞48小时测定剂量效应。细胞相关胶原水平通过上述方法测定细胞单层:PBS冲洗两次,胰酶消化后裂解于200 μl冷裂解缓冲液(20 mM Tris HCl pH7.4,含150 mM NaCl、1 mM MgCl₂、0.1 mM ZnCl₂、1 mM EGTA、1 mM PMSF、1 μg/ml亮抑酶肽、5 mM Benzamidine/苄脒盐酸盐和1% NP-40)。[2] 为验证类胰蛋白酶作用是否依赖催化位点,细胞分别与:1) 纯化类胰蛋白酶(含肝素);2) 经亮抑酶肽或Benzamidine/苄脒盐酸盐预处理的类胰蛋白酶(方法同上)共同孵育。对照组为单独亮抑酶肽/苄脒盐酸盐、不同浓度TGF-β及肝素处理的成纤维细胞上清。鉴于TGF-β是强效胶原合成刺激因子且成纤维细胞可分泌该细胞因子,需排除类胰蛋白酶通过促进TGF-β释放起效的可能性:实验组在TGF-β中和抗体或无关兔抗体存在下与类胰蛋白酶(含肝素)孵育;另设单独抗体(含肝素)或等浓度无关抗体对照组。研究后期获得足量抗类胰蛋白酶单抗(AA5),通过免疫亲和纯化类胰蛋白酶(肥大细胞类胰蛋白酶刺激胶原合成1315)进一步验证其作用[2]。 |
| 毒性/毒理 (Toxicokinetics/TK) |
mouse LD50 intraperitoneal 580 mg/kg BRAIN AND COVERINGS: MENINGEAL CHANGES; BEHAVIORAL: SOMNOLENCE (GENERAL DEPRESSED ACTIVITY); LUNGS, THORAX, OR RESPIRATION: OTHER CHANGES Biology of Reproduction., 20(1045), 1979 [PMID:113041]
|
| 参考文献 |
|
| 其他信息 |
Background: Urokinase-type plasminogen activator (uPA) is a protease associated with tumor metastasis and invasion. Inhibitors of uPA may have potential as drugs for prostate, breast and other cancers. Therapeutically useful inhibitors must be selective for uPA and not appreciably inhibit the related, and structurally and functionally similar enzyme, tissue-type plasminogen activator (tPA), involved in the vital blood-clotting cascade.
Results: We produced mutagenically deglycosylated low molecular weight uPA and determined the crystal structure of its complex with 4-iodobenzo[b]thiophene 2-carboxamidine (K(i) = 0.21 +/- 0.02 microM). To probe the structural determinants of the affinity and selectivity of this inhibitor for uPA we also determined the structures of its trypsin and thrombin complexes, of apo-trypsin, apo-thrombin and apo-factor Xa, and of uPA, trypsin and thrombin bound by compounds that are less effective uPA inhibitors, benzo[b]thiophene-2-carboxamidine, thieno[2,3-b]-pyridine-2-carboxamidine and Benzamidine. The K(i) values of each inhibitor toward uPA, tPA, trypsin, tryptase, thrombin and factor Xa were determined and compared. One selectivity determinant of the benzo[b]thiophene-2-carboxamidines for uPA involves a hydrogen bond at the S1 site to Ogamma(Ser190) that is absent in the Ala190 proteases, tPA, thrombin and factor Xa. Other subtle differences in the architecture of the S1 site also influence inhibitor affinity and enzyme-bound structure.
Conclusions: Subtle structural differences in the S1 site of uPA compared with that of related proteases, which result in part from the presence of a serine residue at position 190, account for the selectivity of small thiophene-2-carboxamidines for uPA, and afford a framework for structure-based design of small, potent, selective uPA inhibitors. [1]
The structures of thrombin– and tPA–Benzamidine provide insight into the poor benzamidine potencies for these proteases (Ki=320 μM and 750 μM, respectively, Table 1). When bound to thrombin and tPA, benzamidine not only lacks a hydrogen bond with residue 190 (alanine in these cases), but also has considerable conformational strain (the phenyl-amidine dihedral is –7° in thrombin, and –3° in tPA). An example of how structural features other than residue 190 can influence inhibitor affinity can be seen by comparing the structures and associated Ki values for uPA– and trypsin–benzamidine, both of which have serine at position 190. The S1 site of uPA is deeper than that of trypsin; the OγSer190–CαSer195 distance is 0.5 Å shorter in trypsin–benzamidine than in uPA–benzamidine. The S1 site of uPA is also wider, by 0.7 Å, along the CαAsp189–NGly226 vector (Table S1a). These enlargements in the S1 pocket of uPA compared with that of trypsin result in the loss of the water1–OPhe227 and water1–OTrp215 hydrogen bonds in uPA–benzamidine compared with trypsin–benzamidine. The shift in the position of water1 in uPA–benzamidine, by 0.5 Å, from its location in trypsin–benzamidine, is accompanied by an unfavorable change in the phenyl-amidine dihedral, from –20 ± 2° in trypsin–benzamidine, to 5° in uPA–benzamidine. The dihedral change corresponds to a calculated increase in conformational strain of 1.9 kcal/mol, larger than the actual decrease in binding energy of 0.9 kcal/mol calculated from the 4.6-fold decrease in affinity (Table 1). Favorable changes that may partially offset the conformational strain in uPA-bound Benzamidine include the significantly shorter (by 3.3 σ and 5.0 σ, respectively) N1–OγSer190 and water1–OγSer190 hydrogen bonds (Table 2). [1] Mast cell activation is a characteristic feature of chronic inflammation, a condition that may lead to fibrosis as a result of increased collagen synthesis by fibroblasts. We have investigated the potential of tryptase, the major protease of human mast cells, to stimulate collagen synthesis in the human lung fibroblast cell line MRC-5. Tryptase was isolated from human lung tissue by ion-exchange and affinity chromatography. At concentrations of 18 and 36 mU/ml, tryptase stimulated both an increase in cell numbers, and a fivefold increase in DNA synthesis as determined by methyl-[3H]thymidine incorporation. Similar concentrations of tryptase resulted in a 2.5-fold increase in collagen synthesis as determined both by incorporation of [3H]proline into collagen, and by assay of hydroxyproline concentrations in the supernatants. There was also a twofold increase in collagenolytic activity in the culture medium after tryptase treatment, indicating that the increase in collagen synthesis was not a consequence of decreased collagenase production. All of these actions of tryptase were reduced in the presence of the protease inhibitors leupeptin and Benzamidine hydrochloride, indicating a requirement for an active catalytic site. SDS-PAGE and autoradiographic analysis of the [3H]collagen produced by the cells revealed it to be predominantly type I collagen. Our findings suggest that the release of tryptase from activated mast cells may provide a signal for abnormal fibrosis in inflammatory disease. [2] A series, consisting of 52 benzamidine derivatives, was evaluated for inhibitory activity against homogeneous boar sperm acrosin. All of the compounds in the series proved to be more potent than benzamidine (Ki = 4.0 x 10(-6) M), with one of the derivatives, alpha-(4-amidino-2,6-diiodophenoxy)-3-nitrotoluene (compound 16), showing outstanding potency with a Ki value of 4.5 X 10(-8) M. Although all of the derivatives were effective acrosin inhibitors, structural specificity was observed within homologous groups of compounds. The information gained from this preliminary study should prove extremely beneficial in the design and synthesis of future acrosin inhibitors.[3] |
| 分子式 |
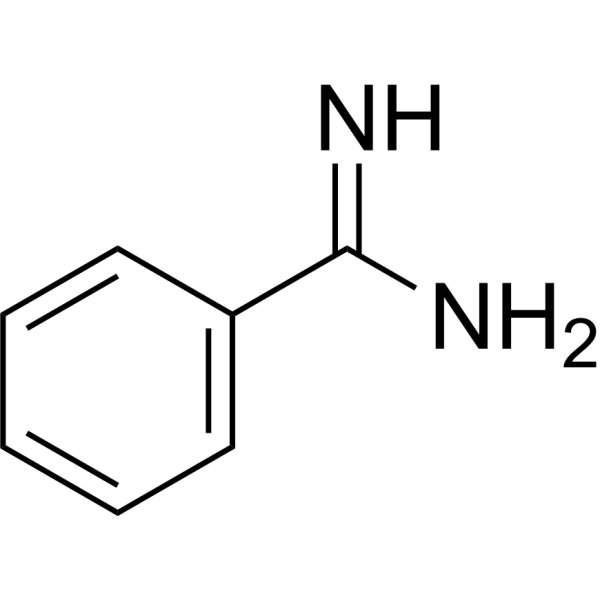
C7H8N2
|
|---|---|
| 分子量 |
120.15
|
| CAS号 |
618-39-3
|
| 相关CAS号 |
Benzamidine hydrochloride;1670-14-0;Benzamidine hydrochloride hydrate;206752-36-5
|
| PubChem CID |
2332
|
| 外观&性状 |
Solid powder
|
| 密度 |
1.1±0.1 g/cm3
|
| 沸点 |
208.5±23.0 °C at 760 mmHg
|
| 熔点 |
65-70ºC
|
| 闪点 |
79.9±22.6 °C
|
| 蒸汽压 |
0.2±0.4 mmHg at 25°C
|
| 折射率 |
1.57
|
| LogP |
0.65
|
| tPSA |
49.87
|
| 氢键供体(HBD)数目 |
2
|
| 氢键受体(HBA)数目 |
1
|
| 可旋转键数目(RBC) |
1
|
| 重原子数目 |
9
|
| 分子复杂度/Complexity |
103
|
| 定义原子立体中心数目 |
0
|
| SMILES |
N([H])([H])/C(/C1C([H])=C([H])C([H])=C([H])C=1[H])=N\[H]
|
| 别名 |
Benzylamine
|
| HS Tariff Code |
2934.99.9001
|
| 存储方式 |
Powder -20°C 3 years 4°C 2 years In solvent -80°C 6 months -20°C 1 month |
| 运输条件 |
Room temperature (This product is stable at ambient temperature for a few days during ordinary shipping and time spent in Customs)
|
| 溶解度 (体外实验) |
May dissolve in DMSO (in most cases), if not, try other solvents such as H2O, Ethanol, or DMF with a minute amount of products to avoid loss of samples
|
|---|---|
| 溶解度 (体内实验) |
注意: 如下所列的是一些常用的体内动物实验溶解配方,主要用于溶解难溶或不溶于水的产品(水溶度<1 mg/mL)。 建议您先取少量样品进行尝试,如该配方可行,再根据实验需求增加样品量。
注射用配方
注射用配方1: DMSO : Tween 80: Saline = 10 : 5 : 85 (如: 100 μL DMSO → 50 μL Tween 80 → 850 μL Saline)(IP/IV/IM/SC等) *生理盐水/Saline的制备:将0.9g氯化钠/NaCl溶解在100 mL ddH ₂ O中,得到澄清溶液。 注射用配方 2: DMSO : PEG300 :Tween 80 : Saline = 10 : 40 : 5 : 45 (如: 100 μL DMSO → 400 μL PEG300 → 50 μL Tween 80 → 450 μL Saline) 注射用配方 3: DMSO : Corn oil = 10 : 90 (如: 100 μL DMSO → 900 μL Corn oil) 示例: 以注射用配方 3 (DMSO : Corn oil = 10 : 90) 为例说明, 如果要配制 1 mL 2.5 mg/mL的工作液, 您可以取 100 μL 25 mg/mL 澄清的 DMSO 储备液,加到 900 μL Corn oil/玉米油中, 混合均匀。 View More
注射用配方 4: DMSO : 20% SBE-β-CD in Saline = 10 : 90 [如:100 μL DMSO → 900 μL (20% SBE-β-CD in Saline)] 口服配方
口服配方 1: 悬浮于0.5% CMC Na (羧甲基纤维素钠) 口服配方 2: 悬浮于0.5% Carboxymethyl cellulose (羧甲基纤维素) 示例: 以口服配方 1 (悬浮于 0.5% CMC Na)为例说明, 如果要配制 100 mL 2.5 mg/mL 的工作液, 您可以先取0.5g CMC Na并将其溶解于100mL ddH2O中,得到0.5%CMC-Na澄清溶液;然后将250 mg待测化合物加到100 mL前述 0.5%CMC Na溶液中,得到悬浮液。 View More
口服配方 3: 溶解于 PEG400 (聚乙二醇400) 请根据您的实验动物和给药方式选择适当的溶解配方/方案: 1、请先配制澄清的储备液(如:用DMSO配置50 或 100 mg/mL母液(储备液)); 2、取适量母液,按从左到右的顺序依次添加助溶剂,澄清后再加入下一助溶剂。以 下列配方为例说明 (注意此配方只用于说明,并不一定代表此产品 的实际溶解配方): 10% DMSO → 40% PEG300 → 5% Tween-80 → 45% ddH2O (或 saline); 假设最终工作液的体积为 1 mL, 浓度为5 mg/mL: 取 100 μL 50 mg/mL 的澄清 DMSO 储备液加到 400 μL PEG300 中,混合均匀/澄清;向上述体系中加入50 μL Tween-80,混合均匀/澄清;然后继续加入450 μL ddH2O (或 saline)定容至 1 mL; 3、溶剂前显示的百分比是指该溶剂在最终溶液/工作液中的体积所占比例; 4、 如产品在配制过程中出现沉淀/析出,可通过加热(≤50℃)或超声的方式助溶; 5、为保证最佳实验结果,工作液请现配现用! 6、如不确定怎么将母液配置成体内动物实验的工作液,请查看说明书或联系我们; 7、 以上所有助溶剂都可在 Invivochem.cn网站购买。 |
| 制备储备液 | 1 mg | 5 mg | 10 mg | |
| 1 mM | 8.3229 mL | 41.6146 mL | 83.2293 mL | |
| 5 mM | 1.6646 mL | 8.3229 mL | 16.6459 mL | |
| 10 mM | 0.8323 mL | 4.1615 mL | 8.3229 mL |
1、根据实验需要选择合适的溶剂配制储备液 (母液):对于大多数产品,InvivoChem推荐用DMSO配置母液 (比如:5、10、20mM或者10、20、50 mg/mL浓度),个别水溶性高的产品可直接溶于水。产品在DMSO 、水或其他溶剂中的具体溶解度详见上”溶解度 (体外)”部分;
2、如果您找不到您想要的溶解度信息,或者很难将产品溶解在溶液中,请联系我们;
3、建议使用下列计算器进行相关计算(摩尔浓度计算器、稀释计算器、分子量计算器、重组计算器等);
4、母液配好之后,将其分装到常规用量,并储存在-20°C或-80°C,尽量减少反复冻融循环。
计算结果:
工作液浓度: mg/mL;
DMSO母液配制方法: mg 药物溶于 μL DMSO溶液(母液浓度 mg/mL)。如该浓度超过该批次药物DMSO溶解度,请首先与我们联系。
体内配方配制方法:取 μL DMSO母液,加入 μL PEG300,混匀澄清后加入μL Tween 80,混匀澄清后加入 μL ddH2O,混匀澄清。
(1) 请确保溶液澄清之后,再加入下一种溶剂 (助溶剂) 。可利用涡旋、超声或水浴加热等方法助溶;
(2) 一定要按顺序加入溶剂 (助溶剂) 。