| 规格 | 价格 | 库存 | 数量 |
|---|---|---|---|
| 5mg |
|
||
| 10mg |
|
||
| 25mg |
|
||
| 50mg |
|
||
| 100mg |
|
||
| Other Sizes |
| 靶点 |
Fluorescent dye
|
|---|---|
| 体外研究 (In Vitro) |
在生命科学研究中,异硫氰酸罗丹明B是一种生化试剂,可用作有机物质或生物材料。
为了了解RBITC-PEG的肿瘤特异性荧光机制,我们首先研究了聚乙二醇化染料在胎牛血清(FBS)和小鼠全血存在下的体外荧光。如图3a所示,添加FBS后,水中RBITC-PEG的荧光增加,但被全血淬灭。相比之下,Cy5.5(Cy7)-PEG荧光没有淬灭,而是被血液和FBS增强,因为更好的分散减少了染料的自淬灭。令人惊讶的是,肝、脾、肾和肺的基底组织也可以淬灭RBITC-PEG荧光,但肿瘤组织没有;然而,这些基质组织并没有影响Cy5.5-PEG的荧光(图3b&c)。另一个重要发现是,在处死小鼠以去除血液之前,用磷酸盐缓冲溶液(PBS)灌注小鼠,器官中的荧光得以恢复(图3d&e)。这些结果表明,器官中的红细胞可能是RBITC-PEG荧光淬灭的原因。[1] 然后,静脉注射的4个T1-Luc-GFP细胞用于模拟循环癌症细胞,以进一步探讨其对主要器官和早期转移的影响(图第6a段)。细胞注射2天后,整个小鼠体内没有检测到生物发光信号,表明尚未形成肿瘤。7天后,小鼠肺部只出现了一个大的生物发光点,14天后变得更加强烈(图6b和c)。然而,注射RBITC-PEG的荧光成像显示,即使在癌症细胞注射后2天,在肝脏中也已经观察到强烈的荧光信号,在肺和肾脏中几乎没有。7天时,肝脏出现大量且扩散的荧光,肺和肾脏的荧光也变得更强。在14天时,肝脏、肺和肾脏都有强烈的荧光(图6d和e)。主要器官切片的共聚焦显微镜和组织学分析发现,非常令人惊讶的是,鉴于其广泛的荧光,仅在肺中发现了活的GFP荧光癌症细胞,而在肝、肾和脾中没有发现(图6f)。因此,静脉注射的癌症细胞很容易被困在肺中,并由于其大尺寸而形成肿瘤。另一个重要发现是,在形成转移性肿瘤之前,循环肿瘤细胞确实调节了肝脏和其他器官的微环境(图6g)。通过对患有原位和静脉注射4 T1肿瘤的小鼠进行血液学分析(图S3),我们发现静脉注射模型中血液HgB浓度显著下降,表明转移确实会影响HgB,这种变化可以通过RBITC衍生物的荧光来反映。此外,我们建立了一个心内注射转移模型(图S4),荧光信号随着转移的严重程度而增加(从1号到3号)。因此,RBITC-PEG可能有助于检测微环境变化和转移前生态位[1]。 |
| 体内研究 (In Vivo) |
荧光通常用于分子和纳米结构的体内跟踪和成像,假设荧光强度与染料浓度成正比。在此,我们报告了罗丹明B异硫氰酸酯衍生物(RBITCs)的独特肿瘤特异性荧光特性,它在癌组织(包括小转移性肿瘤)中选择性地发出荧光,但在血液和健康组织中被淬灭。初步机制研究表明,血红蛋白上RBITCs中的硫脲基团结合会淬灭其荧光,但肿瘤中活性氧物种升高对硫脲的氧化会激活荧光。因此,RBITCs的荧光强度与组织的微环境相关,并与癌症分期呈正相关。这些发现表明,RBITCs不适合在存在红细胞的情况下追踪货物,但可能有助于癌症成像和早期诊断,以及探索肿瘤微环境。[1]
体内肿瘤特异性荧光成像[1] 通过RBITC的异硫氰酸酯基团与PEG(500 Da)的末端胺基团反应制备了RBITC衍生物,获得了RBITC与PEG的偶联物(RBITC-PEG)(图1)。广泛使用的染料Cy7和Cy5.5也被聚乙二醇化,以获得Cy7-PEG和Cy5.5-PEG进行比较。 我们首先通过离体荧光成像评估了RBITC-PEG的体内荧光特性。将携带皮下(sc)BCap37异种移植物肿瘤的小鼠静脉注射染料。12小时后,处死它们,解剖并成像其血液、肿瘤和主要器官,包括心脏、肝脏、脾脏、肺和肾脏(图2a)。注射RBITC-PEG的小鼠肿瘤显示出强烈的荧光,而其血液和健康器官的荧光非常弱。相比之下,Cy5.5-PEG或Cy7-PEG在肿瘤中发出非常弱的荧光,但在正常器官中发出非常强的荧光,尤其是在肝脏、肺和肾脏中。计算肿瘤与肝脏(T/Li)和肿瘤与肺(T/Lu)的荧光强度比,以定量分析这些染料的荧光特性(图2b和c)。RBITC PEG处理的小鼠的T/Li和T/Lu比值都是Cy5或Cy7-PEG处理的5倍以上。我们还验证了携带sc宫颈HeLa肿瘤、胰腺BxPC3肿瘤和乳腺MCF-7/ADR耐药肿瘤的小鼠中RBITC-PEG的肿瘤特异性荧光,并观察到只有肿瘤有强荧光的现象(图2d)。使用离体成像追踪静脉注射RBITC-PEG后器官和肿瘤中荧光的时间依赖性(图2e)。RBITC-PEG在肿瘤中的荧光在半小时内就已经很强,此后保持不变,而肝脏、肺和肾脏中的荧光最初很强,但随着时间的推移会衰减,在12小时后变得非常弱。 肿瘤中的强荧光似乎表明RBITC-PEG具有令人兴奋的肿瘤特异性靶向作用。然而,通过高效液相色谱法(HPLC)对器官和肿瘤中真实的RBITC-PEG浓度进行分析后发现,注射后12小时,肿瘤中仅积聚了1.15%剂量的注射RBITC-PEG,但肝脏、脾脏和肺部的浓度约为肿瘤中浓度的7-9倍(图2f)。因此,RBITC荧光在肿瘤中被激活,但在健康器官(包括肝脏和肺)中被淬灭,表明RBITC荧光与其浓度无关。因此,一个重要的迹象是,在用于体内研究(如标记生物分布分析的载体)之前,必须仔细校准RBITC的荧光行为。[1] 为了进一步证实这一假设,我们在注射RBITC-PEG 12小时后收集了小鼠的全血。血液没有荧光。然而,在离心分离血清和红细胞后,上层血清层有很强的荧光,但红细胞没有荧光(图3f)。有趣的是,在盐浓度从0.5%到5%时,添加盐会略微增加荧光,当盐浓度达到7.5%或更高时,荧光会变得非常强。 为了进一步测试红细胞的血红蛋白(HgB)是否负责RBC淬灭RBITC-PEG荧光,比较了其在产生HgB前后与细胞的荧光。K562人红系祖细胞是一种模拟红系分化的体外实验模型,可以被氯化血红素诱导为血红蛋白生成细胞。RBITC-PEG与K562细胞混合后发出强烈的荧光,但一旦与K562细胞诱导产生HgB,其荧光急剧降低(图3g)。因此,HgB淬灭了RBITC-PEG的荧光。 可以得出结论,在血液和健康组织中,红细胞的HgB淬灭了RBITC-PEG荧光,但为什么肿瘤中的红细胞不能淬灭它尚不清楚。已知肿瘤会遭受持续的全身氧化应激,活性氧(ROS)水平升高。因此,进一步探讨了ROS在HgB淬灭的RBITC-PEG激活中的作用。分离红细胞膜和HgB,分别与RBITC-PEG混合。在预期范围内,HgB立即淬灭了RBITC-PEG,而RBC膜不影响荧光(图3h&i)。一旦加入最常见的ROS类型H2O2(1 mM),含有HgB的RBITC-PEG就会表现出强烈的荧光,表明荧光被去淬灭,而带有RBC膜的RBITC-PEG的荧光不会被H2O2改变。这一结果表明,肿瘤氧化环境逆转了RBITC-PEG的HgB淬灭。 苯肼(PHZ)诱导红细胞氧化,PHZ诱导的毒性是药物诱导的红细胞氧化应激。因此,通过多次腹膜注射PHZ建立了PHZ诱导的贫血小鼠模型,以进一步研究体内氧化环境对RBITC-PEG荧光的影响(图4a)。经过多次PHZ治疗后,PHZ治疗小鼠的红细胞萎缩变形(图4b);小鼠的爪子变得苍白,表明血液红细胞和血红蛋白显著减少,血红素和胆红素水平也升高(图4c),表明贫血小鼠的构建成功。将贫血小鼠静脉注射RBITC-PEG,并在注射后12小时对其血液进行取样和成像。贫血小鼠的血液比对照组小鼠的血液具有更强的荧光(图4d&e)。PHZ诱导的贫血小鼠模型中HgB的数量减少,从而导致荧光淬灭减少。贫血导致血红素和胆红素水平升高,对RBITC-PEG的荧光没有影响。向对照组小鼠的血液中加入7.5%的NaCl破坏了RBITC-PEG和HgB之间的结合,并恢复了荧光,证实RBITC-PGE在红细胞上但淬灭。因此,红细胞的体内氧化微环境抑制了HgB的淬灭作用。[1] 我们进一步测试了正常组织中氧化微环境对RBITC荧光的影响。众所周知,亚砷酸钠(NaAsO2)会诱导肝脏氧化应激,进而导致肝硬化和癌变。NaAsO2处理的小鼠静脉注射RBITC-PEG,收集其主要器官进行离体成像。与肝脏没有荧光的正常小鼠相比,NaAsO2处理的小鼠的肝脏发出强烈的荧光,而在其他器官中没有发现明显的荧光(图4f和g)。这一结果证实,肝脏中的氧化应激确实阻止了RBITC-PEG的荧光淬灭。 下一个问题是RBITC-PEG中的哪个基团使其HgB可淬灭但氧化不可淬灭的荧光。在分子水平上,硫脲基团容易与铁离子中心络合,非常容易被氧化。因此,硫脲基团与苄基溴反应,将其转化为S-苄基取代的RBITC-PEG(M-RBITC-聚乙二醇,图5a)。M-RBITC-PEG显示出与RBITC-聚乙二醇相同的吸收和荧光光谱,荧光强度略有降低(图5b)。然后将RBITC-PEG和M-RBITC-PEG静脉注射到携带BCap37肿瘤的小鼠体内,并在注射后12小时解剖其主要器官和肿瘤进行荧光成像。如图5c和d所示,与RBITC-PEG相比,M-RBITC-PEG的荧光失去了肿瘤特异性,在肝脏和肾脏中表现出强烈的荧光,在肿瘤中表现出较低的荧光。M-RBITC-PEG的总荧光信号远高于RBITC-聚乙二醇,这意味着M-RBITC-PEG荧光不受红细胞或血红蛋白的影响。因此,硫脲/HgB络合物淬灭了RBITC-PEG的荧光[1]。 |
| 细胞实验 |
细胞系[1]
人胰腺癌症细胞系BxPC3、人子宫颈腺癌细胞系Hela和人慢性粒细胞白血病K562细胞购自美国典型培养物保藏中心。使用人阿霉素耐药乳腺癌细胞系MCF7/ADR、人乳腺癌细胞株BCap37、稳定表达萤光素酶(Luc)的小鼠乳腺癌和绿色荧光蛋白(GFP)细胞系(4 T1-Luc-GFP)。细胞在RPMI-1640培养基中维持。所有培养基均补充10%胎牛血清和1%青霉素/链霉素。MCF7/ADR细胞用0.5μM阿霉素连续维持。K562是悬浮培养的细胞。预培养24小时后,加入50μM氯化血红素3天,观察红系分化情况。 红系分化测定[1] 通过联苯胺过氧化氢染色检测血红蛋白表达细胞,证实K562细胞成功分化为红系。简而言之,收集细胞并用PBS洗涤两次。新鲜细胞用含有3%H2O2的联苯胺溶液染色3分钟,并在光学显微镜下检查。蓝色表示HgB的产生。 |
| 动物实验 |
Mice Model [1]
(1) Subcutaneous tumor models: Experiments were carried out on nude mice bearing subcutaneous grown xenografts of breast cancer cells. Each experimental group consisted of 3 animals, the tumor was measured by a caliper every day and calculated as a2 × b/2 where a and b are the shortest and longest diameter of the tumor in mm, respectively. When the tumor reached a mean size of 100 mm3, mice were treated intravenously with different dyes-PEG conjugates (200 μL, 1 mM in PBS). [1] (2) Models of orthotopic metastases carcinoma by intra-mammary gland injection, lung metastases tumor model by tail intravenous injection, and general metastases tumor model by intracardiac injection of 4 T1-Luc-GFP cells: 4 T1-Luc-GFP cells at a dose of 2 × 105 cells were injected into 6- to 8-week-old BALB/c mice. Tumor metastasis was measured by quantitative bioluminescence imaging. In vivo and ex vivo fluorescent imaging [1] Whole-body optical imaging was performed at 12 h post-injection of dyes on a Kodak In-Vivo FX Professional Imaging Syste equipped with fluorescent filter sets. For in vivo imaging, prior to imaging, the mice were anesthetized by intra-abdominal injection of 1% pentobarbital sodium (45 mg/kg). For ex vivo imaging, major organs and tumors were excised and washed with 0.9% saline. |
| 参考文献 |
[1]. Tumor-specific fluorescence activation of rhodamine isothiocyanate derivatives. J Control Release. 2021 Feb 10:330:842-850.
|
| 其他信息 |
In summary, RBITC derivatives can complex with HgB via the thiourea group and became nonfluorescent, while the oxidation microenvironment can oxidize the thiourea group and reactivate their fluorescence. Therefore, the fluorescence of RBITCs is sensitive to the RBCs or HgB and the microenvironment, and thus uses of the dyes, for instance, biodistribution study, must be carefully calibrated first. On the other hand, this unique property makes the dyes useful fluorescent probes for cancer imaging and diagnosis. [1]
|
| 分子式 |
C29H30CLN3O3S
|
|---|---|
| 分子量 |
536.08
|
| 精确质量 |
535.169
|
| CAS号 |
36877-69-7
|
| PubChem CID |
44134928
|
| 外观&性状 |
Green to dark green solid powder
|
| 密度 |
1.23g/cm3
|
| 沸点 |
717.2ºC at 760 mmHg
|
| 闪点 |
387.6ºC
|
| 折射率 |
1.639
|
| LogP |
3.299
|
| tPSA |
101.14
|
| 氢键供体(HBD)数目 |
1
|
| 氢键受体(HBA)数目 |
7
|
| 可旋转键数目(RBC) |
8
|
| 重原子数目 |
37
|
| 分子复杂度/Complexity |
965
|
| 定义原子立体中心数目 |
0
|
| SMILES |
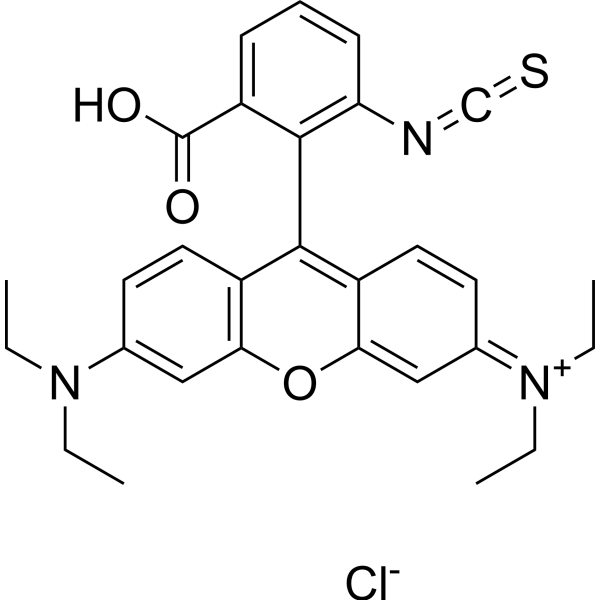
CCN(CC)C1=CC2=C(C=C1)C(=C3C=CC(=[N+](CC)CC)C=C3O2)C4=C(C=CC=C4N=C=S)C(=O)O.[Cl-]
|
| InChi Key |
ASPXTKVHMNAXGJ-UHFFFAOYSA-N
|
| InChi Code |
InChI=1S/C29H29N3O3S.ClH/c1-5-31(6-2)19-12-14-21-25(16-19)35-26-17-20(32(7-3)8-4)13-15-22(26)27(21)28-23(29(33)34)10-9-11-24(28)30-18-36;/h9-17H,5-8H2,1-4H3;1H
|
| 化学名 |
[9-(2-carboxy-6-isothiocyanatophenyl)-6-(diethylamino)xanthen-3-ylidene]-diethylazanium;chloride
|
| 别名 |
Rhodamine B isothiocyanate; RBITC; [9-(2-carboxy-6-isothiocyanatophenyl)-6-(diethylamino)xanthen-3-ylidene]-diethylazanium;chloride; 1879951-72-0; N-(9-(2-carboxy-6-isothiocyanatophenyl)-6-(diethylamino)-3H-xanthen-3-ylidene)-N-ethylethanaminium chloride; Isothiocyanatorhodamine B; MFCD00136007;
|
| HS Tariff Code |
2934.99.9001
|
| 存储方式 |
Powder -20°C 3 years 4°C 2 years In solvent -80°C 6 months -20°C 1 month 注意: 请将本产品存放在密封且受保护的环境中(例如氮气保护),避免吸湿/受潮和光照。 |
| 运输条件 |
Room temperature (This product is stable at ambient temperature for a few days during ordinary shipping and time spent in Customs)
|
| 溶解度 (体外实验) |
DMSO: 12.5 mg/mL (23.32 mM )
|
|---|---|
| 溶解度 (体内实验) |
注意: 如下所列的是一些常用的体内动物实验溶解配方,主要用于溶解难溶或不溶于水的产品(水溶度<1 mg/mL)。 建议您先取少量样品进行尝试,如该配方可行,再根据实验需求增加样品量。
注射用配方
注射用配方1: DMSO : Tween 80: Saline = 10 : 5 : 85 (如: 100 μL DMSO → 50 μL Tween 80 → 850 μL Saline)(IP/IV/IM/SC等) *生理盐水/Saline的制备:将0.9g氯化钠/NaCl溶解在100 mL ddH ₂ O中,得到澄清溶液。 注射用配方 2: DMSO : PEG300 :Tween 80 : Saline = 10 : 40 : 5 : 45 (如: 100 μL DMSO → 400 μL PEG300 → 50 μL Tween 80 → 450 μL Saline) 注射用配方 3: DMSO : Corn oil = 10 : 90 (如: 100 μL DMSO → 900 μL Corn oil) 示例: 以注射用配方 3 (DMSO : Corn oil = 10 : 90) 为例说明, 如果要配制 1 mL 2.5 mg/mL的工作液, 您可以取 100 μL 25 mg/mL 澄清的 DMSO 储备液,加到 900 μL Corn oil/玉米油中, 混合均匀。 View More
注射用配方 4: DMSO : 20% SBE-β-CD in Saline = 10 : 90 [如:100 μL DMSO → 900 μL (20% SBE-β-CD in Saline)] 口服配方
口服配方 1: 悬浮于0.5% CMC Na (羧甲基纤维素钠) 口服配方 2: 悬浮于0.5% Carboxymethyl cellulose (羧甲基纤维素) 示例: 以口服配方 1 (悬浮于 0.5% CMC Na)为例说明, 如果要配制 100 mL 2.5 mg/mL 的工作液, 您可以先取0.5g CMC Na并将其溶解于100mL ddH2O中,得到0.5%CMC-Na澄清溶液;然后将250 mg待测化合物加到100 mL前述 0.5%CMC Na溶液中,得到悬浮液。 View More
口服配方 3: 溶解于 PEG400 (聚乙二醇400) 请根据您的实验动物和给药方式选择适当的溶解配方/方案: 1、请先配制澄清的储备液(如:用DMSO配置50 或 100 mg/mL母液(储备液)); 2、取适量母液,按从左到右的顺序依次添加助溶剂,澄清后再加入下一助溶剂。以 下列配方为例说明 (注意此配方只用于说明,并不一定代表此产品 的实际溶解配方): 10% DMSO → 40% PEG300 → 5% Tween-80 → 45% ddH2O (或 saline); 假设最终工作液的体积为 1 mL, 浓度为5 mg/mL: 取 100 μL 50 mg/mL 的澄清 DMSO 储备液加到 400 μL PEG300 中,混合均匀/澄清;向上述体系中加入50 μL Tween-80,混合均匀/澄清;然后继续加入450 μL ddH2O (或 saline)定容至 1 mL; 3、溶剂前显示的百分比是指该溶剂在最终溶液/工作液中的体积所占比例; 4、 如产品在配制过程中出现沉淀/析出,可通过加热(≤50℃)或超声的方式助溶; 5、为保证最佳实验结果,工作液请现配现用! 6、如不确定怎么将母液配置成体内动物实验的工作液,请查看说明书或联系我们; 7、 以上所有助溶剂都可在 Invivochem.cn网站购买。 |
| 制备储备液 | 1 mg | 5 mg | 10 mg | |
| 1 mM | 1.8654 mL | 9.3270 mL | 18.6539 mL | |
| 5 mM | 0.3731 mL | 1.8654 mL | 3.7308 mL | |
| 10 mM | 0.1865 mL | 0.9327 mL | 1.8654 mL |
1、根据实验需要选择合适的溶剂配制储备液 (母液):对于大多数产品,InvivoChem推荐用DMSO配置母液 (比如:5、10、20mM或者10、20、50 mg/mL浓度),个别水溶性高的产品可直接溶于水。产品在DMSO 、水或其他溶剂中的具体溶解度详见上”溶解度 (体外)”部分;
2、如果您找不到您想要的溶解度信息,或者很难将产品溶解在溶液中,请联系我们;
3、建议使用下列计算器进行相关计算(摩尔浓度计算器、稀释计算器、分子量计算器、重组计算器等);
4、母液配好之后,将其分装到常规用量,并储存在-20°C或-80°C,尽量减少反复冻融循环。
计算结果:
工作液浓度: mg/mL;
DMSO母液配制方法: mg 药物溶于 μL DMSO溶液(母液浓度 mg/mL)。如该浓度超过该批次药物DMSO溶解度,请首先与我们联系。
体内配方配制方法:取 μL DMSO母液,加入 μL PEG300,混匀澄清后加入μL Tween 80,混匀澄清后加入 μL ddH2O,混匀澄清。
(1) 请确保溶液澄清之后,再加入下一种溶剂 (助溶剂) 。可利用涡旋、超声或水浴加热等方法助溶;
(2) 一定要按顺序加入溶剂 (助溶剂) 。