| 规格 | 价格 | 库存 | 数量 |
|---|---|---|---|
| 1mg |
|
||
| 5mg |
|
||
| 10mg |
|
||
| Other Sizes |
|
| 靶点 |
BTK
|
|---|---|
| 体外研究 (In Vitro) |
Cys481 可能在 Elsubrutinib 抑制 BTK 的过程中发挥作用,因为 Elsubrutinib 抑制 BTK (C481S) 的 IC50 为 2.6 μM,表明用酒精交换目标硫醇亲核试剂后效力显着损失。 Elsubrutinib 不可逆地阻止 BTK 依赖性细胞激活和 BTK 酶活性。 Elsubrutinib 可阻断 IgE 刺激的嗜碱性粒细胞释放组胺,以及 IgG 刺激的单核细胞释放 IL-6(分别使用 Fce 和 Fcc 受体)。 Elsubrutinib 可抑制 IgM 介导的 B 细胞增殖,该增殖依赖于 BCR 信号传导。 Elsubrutinib 还可以防止 CpG-DNA 刺激的 PBMC 释放 TNF,CpG-DNA 通过 TLR9 发出信号。然而,它对不使用 ITAM 基序的 TLR 没有影响,例如 TLR4(用 LPS 刺激)或 TLR7/8(用 R848 刺激)。 Elsubrutinib 显着影响 IgM 介导的 B 细胞增殖[1]。
Elsubrutinib(ABBV-105):一种不可逆、选择性和强效的BTK抑制剂[1] ABBV-105被优化为使用丙烯酰胺部分作为亲电试剂来共价修饰活性位点半胱氨酸481,从而不可逆地抑制BTK。类似的策略已被证明可以成功地提供持久的BTK抑制和对大多数缺乏活性位点半胱氨酸的蛋白激酶的有利选择性[24]。ABBV-105以时间依赖的方式抑制BTK催化结构域的活性,随着BTK与药物的预孵育时间延长,BTK酶活性降低(数据未显示)。由于ABBV-105具有不可逆的相互作用(见下文),因此IC50不是结合亲和力的平衡估计值,而是反应速率常数的替代值。在这里,我们根据在没有预孵育药物和酶的情况下,在一小时酶法测定的规定条件下观察到的抑制程度来定义IC50,ABBV-105对BTK催化结构域的IC50为0.18 μM(图1(A),表1)。将Cys481突变为丝氨酸导致BTK催化结构域具有与野生型构建体相似的比活性和ATP-KM(未显示,手稿正在制备中)。ABBV-105抑制BTK(C481S),IC50为2.6 μM,表明用醇交换目标巯基亲核试剂后效力显著降低,表明Cys481在ABBV-105抑制BTK的方式中很重要。 共价激酶抑制剂如Elsubrutinib(ABBV-105)的激酶选择性需要从两个不同的方面来解决:它对其他十种蛋白激酶与类似位置的半胱氨酸的潜在共价反应性(一种时间依赖现象),以及它对没有活性位点亲核试剂的激酶其余部分的结合亲和力(一种平衡测量)。我们使用活性位点半胱氨酸对这10种其他激酶中的每一种进行了活性测定,保持了与BTK方法相同的时间参数,并分别生成了ABBV-105的IC50值。对于这十种激酶,ABBV-105的选择性比(相对于BTK)范围为33至>280(图1(B))。该实验还表明,对于许多激酶,ABBV-105的选择性优于我们小组中之前描述的BTK共价抑制剂CC-292。与CC-292相比,ABBV-105在TEC家族中的选择性有所提高,ITK、ETK/BMX、TEC和TXK的选择性比有所增加。 Elsubrutinib(ABBV-105)也在由456种激酶组成的DiscoverX KINOMEscan®小组中进行了测试,该小组使用配体竞争法。我们在达到80%抑制的浓度下评估了激酶选择性,这是我们在PK/PD建模中用于确定有效暴露的阈值。发现这发生在0.015 μM ABBV-105在DiscoverX BTK测定中的剂量反应实验中。Kinome分析为0.015 μM ABBV-105发现仅对BTK有显著抑制作用(补充表1)。DiscoverX面板中较低的BTK生化IC50(3.1 nM,未显示)可能是由于比用于生成图1(a)的孵育时间更长,这突显了在比较时间依赖性抑制剂的生化IC50估计值时控制时间变量的重要性。 为了确认Elsubrutinib(ABBV-105)与BTK不可逆地相互作用,我们评估了ABBV-105的解离动力学。将IC90处的ABBV-105与BTK混合并孵育30分钟 分钟,以便完全关联。然后将该混合物稀释400倍至小于IC10,并通过TR-FRET检测磷酸化产物来测量酶活性。相对于未暴露于抑制剂的BTK,测量激酶活性的恢复率。一旦化合物被稀释,用ABBV-105对BTK进行预处理会导致缺乏任何可测量的BTK活性,这表明抑制剂与BTK的不可逆结合时间超过24小时 小时(图1(C))。 Elsubrutinib (ABBV-105)在多种细胞信号通路中的评估 由于BTK是几种不同免疫细胞类型中ITAM偶联信号受体的下游,我们在基于细胞的检测中评估了ABBV-105,以评估ABBV-105的特异性和作用机制(图1(D);表1)。ABBV-105分别利用Fcε和Fcγ受体抑制IgE刺激的嗜碱性粒细胞释放组胺和IgG刺激的单核细胞释放IL-6。ABBV-105抑制IgM介导的B细胞增殖,这依赖于BCR的信号传导。ABBV-105还抑制了CpG DNA刺激的PBMC释放TNF,TNF通过TLR9发出信号,尽管它没有抑制不使用ITAM基序的TLR的功能,即通过TLR4(用LPS)或通过TLR7/8(用R848)刺激的PBMCs释放TNF。 |
| 体内研究 (In Vivo) |
elsubrutinib(10 mg/kg;口服)可抑制对 NP-Ficoll 和 NP-KLH 的抗体反应,但不会抑制对 NP-LPS 或 Prevnar-13 的抗体反应[1]。在10 mg/kg QD和BID剂量下,elsubrutinib(0.1~10 mg/kg;po)可有效延迟蛋白尿的开始,延长生存期,并在整个病程中抑制足爪水肿;较低剂量不会明显抑制这些终点[1]。爪子体积的增加被证明与艾司布替尼的暴露依赖性抑制有关。 Elsubrutinib 以剂量依赖性方式显着减少骨量损失,这与已注意到的抗炎作用一致[1]。
Elsubrutinib (ABBV-105)在胸腺非依赖性和胸腺依赖性抗体反应中的评估 XLA患者表现出缺乏特异性抗体产生,细菌感染风险增加。同样,BTK缺陷小鼠不能引发对胸腺非依赖性和胸腺依赖性抗原的正常抗体反应。由于ABBV-105对体外IgM介导的B细胞增殖有显著影响,因此临床使用BTK抑制剂可能会降低或消除患者对抗原挑战产生抗体反应的能力。为了更好地了解ABBV-105对不同抗原抗体反应的影响,我们检查了对胸腺非依赖性抗原NP-LPS和NP-Ficoll、肺炎球菌疫苗Prevnar或胸腺依赖性抗原NPT-KLH的反应。 我们在用胸腺非依赖性抗原NP-LPS和NP-Ficoll免疫后第7天评估了小鼠的抗NP-IgM和IgG3反应。从免疫接种前一天开始,用Elsubrutinib(ABBV-105)10mg/kg QD或BID治疗小鼠。ABBV-105没有显著抑制NP-LPS的抗NP-IgM或IgG3反应(图2(A))。相比之下,当小鼠用NP-Ficoll免疫时,抗NP-IgM和IgG3反应均受到显著抑制(图2(B))。与QD给药相比,ABBV-105的BID给药没有显著增加反应。由于ABBV-105与BTK结合的共价性和不可逆性,可以通过使用衍生自相关共价BTK抑制剂的生物素化探针测量BTK占有率来在体内定量靶结合。脾脏BTK占有率测量为24 每天一次给药的小鼠在最后一剂ABBV-105后数小时和12小时 每两天一次给药的小鼠的脾脏占用率相似(10 mg/kg QD=64.3%) ± 8.1%; BID = 77.8% ± 1.5%) 或NP Ficoll(每日一次10mg/kg = 53.1% ± 8.1%; BID = 65.6% ± 3.0%). 为了评估Elsubrutinib(ABBV-105)对疫苗反应的潜在影响,我们评估了肺炎球菌疫苗Prevnar的抗体反应。ABBV-105的剂量反应治疗始于Prevnar免疫接种当天,14天后测量了疫苗中含有的13种多糖的IgM和IgG抗体反应。ABBV-105没有显著抑制抗肺炎球菌IgM或IgG反应,而阳性对照环磷酰胺完全消除了抗体反应(图2(C))。脾脏BTK占有率测量为24 在最后一剂ABBV-105后数小时,其占用率呈剂量依赖性增加(10mg/kg = 46.8% ± 3.4%; 3 mg/kg = 40.2% ± 3.2%; 1 mg/kg = 34.3% ± 4.1%). 为了进一步了解BTK抑制对抗体反应的影响,我们评估了对胸腺依赖性抗原NP-KLH的初级和次级抗NP-IgM和IgG1反应。Elsubrutinib(ABBV-105)在第35天加强治疗前不影响抗NP IgM反应(图2(D))。然而,在第35天加强治疗后,ABBV-105治疗显著降低了抗NP IgM抗体,这既发生在研究开始时接受治疗的小鼠身上,也发生在加强治疗前开始治疗的小鼠体内。ABBV-105的QD和BID治疗之间没有观察到显著差异。ABBV-105在第7、14或21天没有显著影响抗NP IgG1反应(图2(E))。治疗10 mg/kg ABBV-105在第35天显著抑制了抗NP IgG1反应,但其他治疗组与赋形剂对照组没有显著差异。在最后一剂ABBV-105后两小时测量脾脏BTK占有率,并证明所有组的占有率相当(10mg/kg QDD1–42 = 99.0% ± 0.2%; 10 mg/kg BID1-42 = 97.2% ± 0.5%; 10 毫克/千克QDD34-42 = 98.9% ± 0.2%; 10 mg/kg,每日两次34-42 = 97.7% ± 0.6%). Elsubrutinib(ABBV-105)治疗CIA的疗效及其与BTK占用率的关系[1] 在RA中,致病性抗体部分通过FcγR介导的信号传导激活下游炎症过程。由于我们之前已经证明ABBV-105抑制IgG刺激的细胞因子产生(图1(D)),我们接下来想知道在已知FcγR信号有显著贡献的啮齿动物关节炎模型中,抑制BTK是否足以抑制炎症。因此,我们在大鼠CIA模型中评估了ABBV-105,并从炎症的最初迹象开始进行治疗。 在整个疾病过程中,每天口服Elsubrutinib(ABBV-105)对大鼠的足肿胀产生剂量依赖性抑制(图3(A); n = 9 每组)。每组从三只动物身上采集全血样本,以测量研究结束时的药物浓度和曲线下面积(AUC)药物浓度值 ± SEM用于评估暴露-反应关系。来自两个独立CIA实验的爪肿胀数据用于药代动力学/药效学(PKPD)建模。我们使用直接Emax模型,选择药物浓度AUC作为PKPD评估的暴露参数。ABBV-105显示出对爪子体积增加的暴露依赖性抑制作用(图3(B))。计算了在最后一天提供50%和80%抑制爪肿胀的暴露量(AUC50,0-24 = 4.5 ± 1.9 ng × 小时/mL;AUC80,0–24 = 19 ± 8 ng × 小时/mL)。 在大鼠CIA模型中,炎症过程导致破骨细胞活性介导的踝关节骨破坏。此外,对小鼠的研究表明,BTK在破骨细胞生成中起着重要作用。为了评估Elsubrutinib(ABBV-105)对骨骼的疾病改善作用,我们在研究结束时通过微型计算机断层扫描(μCT)分析了脚踝。骨侵蚀可以通过踝关节的三维评估来量化,以计算总骨体积。与载体对照治疗的动物相比,ABBV-105以与观察到的抗炎作用一致的剂量依赖方式显著抑制了骨体积损失(图3(C))。 为了了解CIA模型中靶点参与与疗效之间的关联,我们评估了脾脏BTK占用情况,以评估其与抑制足肿胀之间的关系。给药后,血浆中Elsubrutinib(ABBV-105)迅速清除,而ABBV-105在均质化脾脏样本中对BTK的占用持续了很长一段时间(图3(D))。BTK占用率呈剂量依赖性增加,在给药后两小时达到最大值,并随时间推移而降低(图3(E))。在2点和12点 给药后数小时,BTK占据率与抑制爪肿胀之间存在很强的正相关关系(图3(F))。 Elsubrutinib (ABBV-105)在IFNα加速狼疮肾炎模型中的疗效[1] 通过其在BCR信号传导中的作用,BTK在致病性自身抗体的发展中起着关键作用。这在小鼠狼疮模型中得到了证实,研究表明,BTK缺陷型xid菌株与狼疮易感MRL/lpr背景交叉,导致自身抗体产生减少。此外,BTK抑制剂在MRL/lpr和NZB/W狼疮肾炎模型中均显示出疗效。因此,我们在NZB/W F1小鼠的IFN-α加速狼疮模型中评估了ABBV-105。通常,NZB x NZW杂交F1代雌性小鼠会出现蛋白尿,导致12个月龄时死亡率增加。对患病前的小鼠施用表达IFN-α的腺病毒可导致蛋白尿和死亡的快速发作,从而创建了一个更短的模型来表征新的治疗方法。 我们在IFN-α加速模型中评估了Elsubrutinib(ABBV-105)治疗,在注射IFN-α腺病毒七天后但在蛋白尿发作之前开始QD或BID治疗。ABBV-105显著预防了蛋白尿的发作,并在10天内延长了生存期 mg/kg QD和BID剂量,而较低剂量没有显著抑制这些终点(图4(A,B); n = 20 每组)。与每天一次给药相比,每天两次给药ABBV-105对存活率或蛋白尿的影响没有更大。我们还评估了ABBV-105对IFN-α腺病毒给药后第14天和第28天抗dsDNA自身抗体产生的影响。两者10 mg/kg QD和BID剂量的ABBV-105在第28天显著降低了抗dsDNA IgG抗体的血浆水平(图4(C))。10例患者的抗dsDNA IgG抗体水平没有显著差异 mg/kg BID和QD剂量。 |
| 酶活实验 |
BTK酶占用率评价[1]
Elsubrutinib (ABBV-105)对BTK共价占据率的评估与已发表的研究相似。简而言之,在蛋白酶抑制剂存在的情况下,使用Dounce组织匀浆器 对快速冷冻的脾脏进行匀浆。将脾匀浆与共价占据探针混合,并在室温下在摇床上孵育两小时。将样品转移到涂有链霉抗生物素蛋白的96孔板上,在室温下在摇床上孵育一小时。洗涤后,用兔抗小鼠BTK(1:1000)和山羊抗兔HRP偶联抗体(1:5000)检测BTK。BTK占用百分比是通过与化合物处理的脾脏相比,载体处理的脾脏中游离BTK的比例来计算的。 生化检测[1] 人BTK(aa 393-659)在SF9细胞中表达,带有N端His6标签。使用基于时间分辨荧光共振能量转移(TR-FRET)的磷酸化肽(生物素-(Ahx)-GAEEIYAAFFA-COOH)检测来测量活性。最终浓度:9 nM酶(BTK),0.2 μM肽,50 mM MOPSO pH 6.5,10 mM氯化镁,2 mM氯化锰,2.5 mM DTT,0.01%BSA,0.1 mM Na3VO4和0.01 mM ATP。反应在60℃时终止 分钟与100 mM EDTA,然后加入30 mM HEPES pH 7.0,0.06%BSA,0.006%吐温-20,0.24 M KF,80 ng/mL PT66K和0.6 μg/mL SAX。60天后测量TR-FRET计数 在Rubystar(BMG)上的几分钟。通过孵育400℃来测量BTK结合的可逆性 nM BTK与抑制剂在IC90处作用30分钟 分钟。在反应缓冲液中稀释400倍后,如上所述测量活性。如上所述,在相当于其KM的ATP下测量了额外的激酶测定。 |
| 细胞实验 |
IgE介导的嗜碱性粒细胞脱颗粒[1]
肝素化人全血与抑制剂一起孵育30分钟 37分钟 °C,用抗IgE(Beckman Coulter,Brea,CA)刺激,孵育30分钟 37分钟 °C.在冰上保持10分钟后 分钟,样品离心10分钟 1000分钟 转速为4 °C.通过均相时间分辨荧光(HTRF)分析上清液中的组胺。 IgM介导的人B细胞增殖[1] 将原代人B细胞解冻,重新悬浮在培养基中(RPMI补充了10%FBS,2 mM L-谷氨酰胺,10 mM HEPES,1 mM丙酮酸钠和1%青霉素-链霉素),并以1 × 105 100个细胞/孔 μL.将培养基中的抑制剂/1%DMSO加入细胞中,孵育30分钟 分钟。然后用抗人IgM刺激细胞,孵育48小时 用1μCi/25μL/孔[CH3-3H]胸苷脉冲,孵育16-18小时 小时。使用UniFilter-96细胞收获机收获细胞。用1×PBS洗涤样品,干燥,并在加入50μg的TopCount NXT HTS(PerkinElmer,Waltham,MA)后计数 μL/孔闪烁剂。 IgG介导的巨噬细胞IL-6的产生[1] 将原代人单核细胞作为37添加到抑制剂中 30°C 分钟(2× 105 细胞/孔,在含有10%FBS、1%青霉素-链霉素、1%L-谷氨酰胺和0.4%DMSO的RPMI中)。将细胞加入涂有40 ng/μL人血清IgG,孵育过夜,离心,收集上清液以评估IL-6。 TLR刺激人PBMC TNF的产生[1] 将原代人外周血单个核细胞解冻,重新悬浮在培养基中(RPMI补充了2%FBS和1%青霉素-链霉素),在2℃下接种 × 105 细胞/孔,与抑制剂一起孵育30分钟 分钟。用CpG(2.5μM)、LPS(100ng/ml;Sigma-Aldrich,密苏里州圣路易斯)或R848(3μg/ml)。24之后 小时后,将平板离心,收集上清液中的TNFα。 |
| 动物实验 |
Animal/Disease Models: Female C57/BL6 mice[1]
Doses: 10 mg/kg Route of Administration: Po Experimental Results: Inhibited antibody responses to NP-Ficoll and NP-KLH, but not to NP-LPS or Prevnar-13. Animal/Disease Models: Lewis rats[1] Doses: 0.1~10 mg/kg Route of Administration: Po Experimental Results: Resulted in dose-dependent inhibition of paw swelling throughout the course of disease. Animal/Disease Models: NZBWF1 mice[1] Doses: 0.1~10 mg/kg Route of Administration: Po Experimental Results: Dramatically prevented the onset of proteinuria and prolonged survival at the 10 mg/kg QD and BID doses , while lower doses did not Dramatically inhibit these endpoints. Immunization of mice with thymus-dependent and -independent antigens [1] To assess antibody responses to thymus independent antigens, female C57/BL6 were immunized IP with either 20 μg NP-LPS or NP-Ficoll (Biosearch Technologies, Petaluma, CA) in PBS. Mice were dosed orally with Elsubrutinib (ABBV-105) once a day (QD) or twice a day (BID) beginning one day prior to immunization. After seven days, mice were sacrificed and plasma was collected for anti-NP antibody analysis. To assess antibody responses to Prevnar-13 vaccine, female C57/BL6 mice were immunized IP with 1 μg Prevnar-13 in PBS. Mice were dosed orally QD with Elsubrutinib (ABBV-105) for 14 days or IP three times per week with cyclophosphamide beginning on the day of immunization. Plasma was collected on day 14 to evaluate antibody titers. For evaluation of the antibody response to the thymus dependent antigen, female C57/BL6 mice were immunized IP with 100 μg NP(23)-KLH in PBS with Imject Alum Thermo Scientific, IL). After 35 days, mice were boosted with 100 μg NP(23)-KLH in PBS. Mice were dosed orally QD or BID with 10mpk Elsubrutinib (ABBV-105). Treatment started on day –1 continuing through day 42 or started on day 35 prior to boost continuing through day 42. Mice were bled, and plasma collected on days 7, 14, 21, 35, and 42. Induction of collagen-induced arthritis [1] Lewis rats were immunized with 600 µg bovine type II collagen in incomplete Freund’s adjuvant (IFA) intradermally on day 0 on the base of tail, left flank, and right flank and boosted with collagen in IFA near the same locations on day 6. Paw volume was measured using a micro-controlled volume meter plethysmograph with left and right paw volumes averaged for analysis. Paw volume baseline was assessed on day 8 (baseline), 11, 13, 15, and 18. Rats were dosed orally QD for seven days beginning on day 11 post-immunization with Elsubrutinib (ABBV-105). Data are presented as a pooled analysis of two independent experiments. On day 18, plasma was collected to measure drug concentrations from three animals per group at 0.25, 0.5, 1, 2, 4, 6, 12, and 24 hours post-dose. For BTK occupancy analysis spleens were collected and frozen in liquid nitrogen from three animals per group at 2, 12, and 24 hours post-dose. |
| 参考文献 | |
| 其他信息 |
Elsubrutinib is under investigation in clinical trial NCT04451772 (A Study of the Safety of Oral Elsubrutinib Capsules and Oral Upadacitinib Tablets Given Alone or in Combination (ABBV-599) for Adult Participants With Moderately to Severely Active Systemic Lupus Erythematosus to Assess Change in Disease State).
ELSUBRUTINIB is a small molecule drug with a maximum clinical trial phase of II (across all indications) and has 2 investigational indications. Objectives: Bruton's tyrosine kinase (BTK) is a non-receptor tyrosine kinase required for intracellular signaling downstream of multiple immunoreceptors. We evaluated ABBV-105, a covalent BTK inhibitor, using in vitro and in vivo assays to determine potency, selectivity, and efficacy to validate the therapeutic potential of ABBV-105 in inflammatory disease. Methods: ABBV-105 potency and selectivity were evaluated in enzymatic and cellular assays. The impact of ABBV-105 on B cell function in vivo was assessed using mechanistic models of antibody production. Efficacy of ABBV-105 in chronic inflammatory disease was evaluated in animal models of arthritis and lupus. Measurement of BTK occupancy was employed as a target engagement biomarker. Results: ABBV-105 irreversibly inhibits BTK, demonstrating superior kinome selectivity and is potent in B cell receptor, Fc receptor, and TLR-9-dependent cellular assays. Oral administration resulted in rapid clearance in plasma, but maintenance of BTK splenic occupancy. ABBV-105 inhibited antibody responses to thymus-independent and thymus-dependent antigens, paw swelling and bone destruction in rat collagen induced arthritis, and reduced disease in an IFNα-accelerated lupus nephritis model. BTK occupancy in disease models correlated with in vivo efficacy. Conclusion: ABBV-105, a selective BTK inhibitor, demonstrates compelling efficacy in pre-clinical mechanistic models of antibody production and in models of rheumatoid arthritis and lupus.[1] |
| 分子式 |
C17H19N3O2
|
|---|---|
| 分子量 |
297.351663827896
|
| 精确质量 |
297.147
|
| 元素分析 |
C, 68.67; H, 6.44; N, 14.13; O, 10.76
|
| CAS号 |
1643570-23-3
|
| 相关CAS号 |
Elsubrutinib;1643570-24-4
|
| PubChem CID |
117773886
|
| 外观&性状 |
White to off-white solid powder
|
| LogP |
1.6
|
| tPSA |
79.2
|
| 氢键供体(HBD)数目 |
2
|
| 氢键受体(HBA)数目 |
2
|
| 可旋转键数目(RBC) |
3
|
| 重原子数目 |
22
|
| 分子复杂度/Complexity |
465
|
| 定义原子立体中心数目 |
1
|
| SMILES |
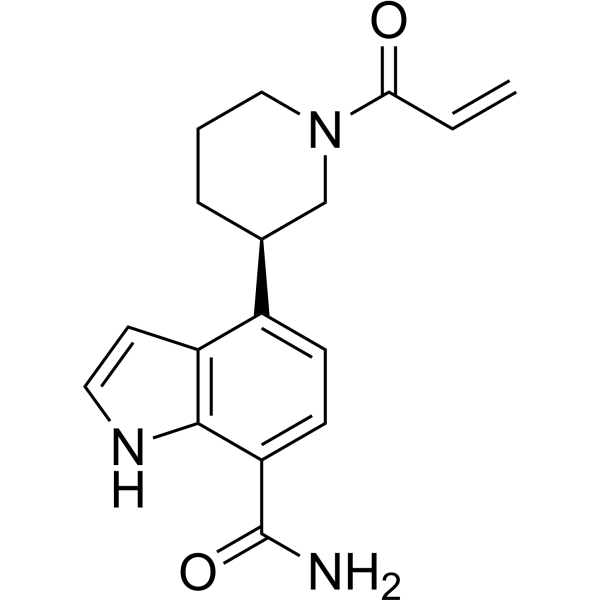
N1C2=C(C([C@H]3CCCN(C(=O)C=C)C3)=CC=C2C(N)=O)C=C1
|
| InChi Key |
UNHZLHSLZZWMNP-NSHDSACASA-N
|
| InChi Code |
InChI=1S/C17H19N3O2/c1-2-15(21)20-9-3-4-11(10-20)12-5-6-14(17(18)22)16-13(12)7-8-19-16/h2,5-8,11,19H,1,3-4,9-10H2,(H2,18,22)/t11-/m0/s1
|
| 化学名 |
4-[(3R)-1-prop-2-enoylpiperidin-3-yl]-1H-indole-7-carboxamide
|
| 别名 |
(R)-Elsubrutinib; 1643570-23-3; SCHEMBL16337373; (R)-ABBV-105;
|
| HS Tariff Code |
2934.99.9001
|
| 存储方式 |
Powder -20°C 3 years 4°C 2 years In solvent -80°C 6 months -20°C 1 month |
| 运输条件 |
Room temperature (This product is stable at ambient temperature for a few days during ordinary shipping and time spent in Customs)
|
| 溶解度 (体外实验) |
DMSO: 25 mg/mL (84.08 mM)
|
|---|---|
| 溶解度 (体内实验) |
注意: 如下所列的是一些常用的体内动物实验溶解配方,主要用于溶解难溶或不溶于水的产品(水溶度<1 mg/mL)。 建议您先取少量样品进行尝试,如该配方可行,再根据实验需求增加样品量。
注射用配方
注射用配方1: DMSO : Tween 80: Saline = 10 : 5 : 85 (如: 100 μL DMSO → 50 μL Tween 80 → 850 μL Saline)(IP/IV/IM/SC等) *生理盐水/Saline的制备:将0.9g氯化钠/NaCl溶解在100 mL ddH ₂ O中,得到澄清溶液。 注射用配方 2: DMSO : PEG300 :Tween 80 : Saline = 10 : 40 : 5 : 45 (如: 100 μL DMSO → 400 μL PEG300 → 50 μL Tween 80 → 450 μL Saline) 注射用配方 3: DMSO : Corn oil = 10 : 90 (如: 100 μL DMSO → 900 μL Corn oil) 示例: 以注射用配方 3 (DMSO : Corn oil = 10 : 90) 为例说明, 如果要配制 1 mL 2.5 mg/mL的工作液, 您可以取 100 μL 25 mg/mL 澄清的 DMSO 储备液,加到 900 μL Corn oil/玉米油中, 混合均匀。 View More
注射用配方 4: DMSO : 20% SBE-β-CD in Saline = 10 : 90 [如:100 μL DMSO → 900 μL (20% SBE-β-CD in Saline)] 口服配方
口服配方 1: 悬浮于0.5% CMC Na (羧甲基纤维素钠) 口服配方 2: 悬浮于0.5% Carboxymethyl cellulose (羧甲基纤维素) 示例: 以口服配方 1 (悬浮于 0.5% CMC Na)为例说明, 如果要配制 100 mL 2.5 mg/mL 的工作液, 您可以先取0.5g CMC Na并将其溶解于100mL ddH2O中,得到0.5%CMC-Na澄清溶液;然后将250 mg待测化合物加到100 mL前述 0.5%CMC Na溶液中,得到悬浮液。 View More
口服配方 3: 溶解于 PEG400 (聚乙二醇400) 请根据您的实验动物和给药方式选择适当的溶解配方/方案: 1、请先配制澄清的储备液(如:用DMSO配置50 或 100 mg/mL母液(储备液)); 2、取适量母液,按从左到右的顺序依次添加助溶剂,澄清后再加入下一助溶剂。以 下列配方为例说明 (注意此配方只用于说明,并不一定代表此产品 的实际溶解配方): 10% DMSO → 40% PEG300 → 5% Tween-80 → 45% ddH2O (或 saline); 假设最终工作液的体积为 1 mL, 浓度为5 mg/mL: 取 100 μL 50 mg/mL 的澄清 DMSO 储备液加到 400 μL PEG300 中,混合均匀/澄清;向上述体系中加入50 μL Tween-80,混合均匀/澄清;然后继续加入450 μL ddH2O (或 saline)定容至 1 mL; 3、溶剂前显示的百分比是指该溶剂在最终溶液/工作液中的体积所占比例; 4、 如产品在配制过程中出现沉淀/析出,可通过加热(≤50℃)或超声的方式助溶; 5、为保证最佳实验结果,工作液请现配现用! 6、如不确定怎么将母液配置成体内动物实验的工作液,请查看说明书或联系我们; 7、 以上所有助溶剂都可在 Invivochem.cn网站购买。 |
| 制备储备液 | 1 mg | 5 mg | 10 mg | |
| 1 mM | 3.3630 mL | 16.8152 mL | 33.6304 mL | |
| 5 mM | 0.6726 mL | 3.3630 mL | 6.7261 mL | |
| 10 mM | 0.3363 mL | 1.6815 mL | 3.3630 mL |
1、根据实验需要选择合适的溶剂配制储备液 (母液):对于大多数产品,InvivoChem推荐用DMSO配置母液 (比如:5、10、20mM或者10、20、50 mg/mL浓度),个别水溶性高的产品可直接溶于水。产品在DMSO 、水或其他溶剂中的具体溶解度详见上”溶解度 (体外)”部分;
2、如果您找不到您想要的溶解度信息,或者很难将产品溶解在溶液中,请联系我们;
3、建议使用下列计算器进行相关计算(摩尔浓度计算器、稀释计算器、分子量计算器、重组计算器等);
4、母液配好之后,将其分装到常规用量,并储存在-20°C或-80°C,尽量减少反复冻融循环。
计算结果:
工作液浓度: mg/mL;
DMSO母液配制方法: mg 药物溶于 μL DMSO溶液(母液浓度 mg/mL)。如该浓度超过该批次药物DMSO溶解度,请首先与我们联系。
体内配方配制方法:取 μL DMSO母液,加入 μL PEG300,混匀澄清后加入μL Tween 80,混匀澄清后加入 μL ddH2O,混匀澄清。
(1) 请确保溶液澄清之后,再加入下一种溶剂 (助溶剂) 。可利用涡旋、超声或水浴加热等方法助溶;
(2) 一定要按顺序加入溶剂 (助溶剂) 。