| 规格 | 价格 | ||
|---|---|---|---|
| 500mg | |||
| 1g | |||
| Other Sizes |
| 靶点 |
β-GABA transporter (BGT-1) (IC50 = 10.6 μM)
|
|---|---|
| 体外研究 (In Vitro) |
NNC 05-2090 的 ED50 值为 19 μmol/kg,以剂量依赖性方式抑制 DBA/2 小鼠由声音引起的强直和阵挛性惊厥[3]。 NNC 05-2090 的 ED50 值为 73 mmol/kg,是一种剂量依赖性拮抗剂,可对抗最大电击 (MES) 实验中的强直后肢伸展反应 [3]。在最高剂量 (72-242 mmol/kg) 下,NNC 05-2090 也显着降低 (P < 0.05) 全身性癫痫(癫痫 3-5 级)的严重程度。放电后持续时间缩短(P<0.05)[3]。
NNC05-2090 盐酸盐与螺哌酮和哌唑嗪结合的 IC50 值分别为 1632 nM 和 266 nM[1]。 NNC 05-2090盐酸盐 (0.1-100 μM) 抑制大鼠皮质突触体对 [3H]GABA 的摄取,IC50 值为 4.4 μM。 NNC05-2090 盐酸盐 (0.1-100 μM) 抑制下丘突触体中的 [3H]GABA 吸收,IC50 值为 2.5 μM [1]。血清素、去甲肾上腺素、多巴胺转运蛋白和 BGT-1 均被 NNC 05-2090 盐酸盐抑制,IC50 值分别为 5.29、7.91、4.08 和 10.6 μM[1]。 NNC05-2090 盐酸盐抑制 GAT-1、GAT-2 和 GAT-3,IC50 值分别为 29.62、45.29 和 22.51 μM[1]。 GAT抑制剂抑制效力的比较为了分析GAT抑制剂对[3H]GABA摄取的影响,我们之前使用CHO细胞建立了稳定表达GAT亚型的细胞系。使用这些细胞系和稳定表达大鼠单胺转运蛋白SERT、NET和DAT的CHO细胞来比较抑制GAT亚型的效力,我们分析了GAT抑制剂对GABA和单胺类摄取的影响。抑制剂SKF89976A和(S)-SNAP5114分别对GAT-1(IC50:0.28 mM)和GAT-3(IC50:5.31 mM)表现出亚型选择性(表1)。然而,NNC 05-2090能有效抑制GAT-1(IC50:29.62 mM),BGT-1(10.60 mM)的IC50值低2.5倍以上。NNC05-2090对GAT-2(45.29 mM)和GAT-3(22.51 mM)的IC50值也明显较高。这些结果表明,在所有检查的GAT抑制剂中,NNC 05-2090在GAT抑制剂之间抑制BGT-1的效力最高。NNC05-2090还抑制SERT、NET和DAT(IC50:5.29 mM、7.91 mM和4.08 mM),这些IC50值与BGT-1的IC50值相似[2]。 |
| 体内研究 (In Vivo) |
NNC05-2090 盐酸盐 (ip) 可保护 DBA/2 小鼠免受强直和阵挛性惊厥,ED50 分别为 19 μmol/kg 和 26 μmol/kg,并防止最大电击 (MES),ED50 为 73 μmol/kg[ 1]。在坐骨神经结扎小鼠中,NNC05-2090盐酸盐(0.01、0.1、0.3mg/kg;腹腔注射或鞘内注射,一次)可以纠正一些机械性异常性疼痛。
两种新的尼泊苷酸衍生物1-(3-(9H-咔唑-9-基)-1-丙基)-4-(4-甲氧基苯基)-4-哌啶醇(NNC 05-2045)和1-(3-。NNC 05-2045和NNC 05-20090抑制[3H]GABA从大脑皮层摄取到突触体的IC50值分别为12+/-2和4.4+/-0.8微M。在1微M 1-(2-(((二苯基亚甲基)氨基)氧)乙基)-1,2,5,6-四氢-3-吡啶甲酸(NNC 05-0711)(一种高效和选择性的GAT-1抑制剂)存在下,下丘突触体中抑制[3H]GABA摄取的IC50值分别为1.0+/-0.1和2.5+/-0.7微M。受体谱显示,NNC 05-2045对σ、α1-和D2受体的结合亲和力分别为113、550和122 nM。NNC 05-2090显示α1-和D2受体亲和力分别为266和1632 nM。腹膜内注射后,在四种啮齿动物模型中测试了这两种化合物的抗惊厥作用。NNC 05-2090均能剂量依赖性地抑制DBA/2小鼠声音诱导的强直性和阵挛性惊厥,ED50值分别为6和19 mumol/kg。NNC 05-2045还拮抗了遗传性癫痫易感大鼠(GEP大鼠)的声音诱发的癫痫发作,其ED50值分别为33、39和39 mumol/kg的野生跑步、阵挛和强直性惊厥(NNC 05-2090未在GEP大白鼠中进行测试)。在ED50值分别为29和73 mumol/kg的最大电击(MES)试验中,NNC 05-2045和NNC 05-2009均以剂量依赖性方式拮抗强直性后肢伸展。在杏仁核点燃的大鼠中,NNC 05-2045和NNC 05-20090在最高剂量(72-242 mumol/kg)下显著降低了全身性癫痫发作的严重程度(癫痫发作等级3-5)(P<0.05),NNC 05-2090在这些剂量下也显著缩短了出院后的持续时间(P<0.05)。这些数据表明,通过非GAT-1转运蛋白抑制GABA摄取与选择性GAT-1抑制剂(如噻加宾)具有不同的抗惊厥作用,因为观察到对MES的疗效增强,对点燃性癫痫的疗效降低。虽然不能完全排除肾上腺素能激动作用的贡献,但有人提出,抑制GAT-3(小鼠GAT4)是这两种尼泊苷酸衍生物在MES、杏仁核点燃的大鼠以及GEP大鼠和DBA/2小鼠声音诱导癫痫发作中的抗惊厥作用的主要原因。[1] GAT抑制剂对PSL小鼠模型中机械性异常性疼痛的影响部分坐骨神经结扎(PSL)模型小鼠同侧的机械性戒断阈值明显低于假手术动物(图1)。对侧的机械性戒断阈值没有降低(图2B、3B、4和5)。PSL小鼠模型中的机械性异常性疼痛不受盐水治疗的影响(图1B)。腹腔注射0.1mg/kg NNC 05-2090后3小时,PSL模型小鼠的机械戒断阈值有所增加(图1B)。另一方面,0.3mg/kg的SKF89976A腹腔注射对PSL模型小鼠的戒断阈值没有产生任何显著影响(图1B)。静脉注射BGT-1抑制剂NNC05-2090显著逆转了PSL模型小鼠的机械性异常性疼痛(图2)。静脉注射NNC05-2090在0.01-0.1 mg/kg范围内显示出剂量依赖性反应。i.t.注射BGT-1抑制剂NNC 05-2090也显著逆转了PSL模型小鼠的机械性异常性疼痛,并且通过i.t.向PSL模型鼠注射NNC 05-2009,在15-150pmole范围内也显示出剂量依赖性反应(图3)。除静脉注射0.01mg/kg外,NNC05-2090的抗痛觉过敏作用在注射后1小时内达到峰值(图2和图3)。NNC05-2090给药后,对侧的戒断阈值没有显著差异。静脉注射SKF89976A(0.3mg/kg)时产生微弱的抗痛觉过敏反应(图4A)。如图5A所示,腹腔注射SKF89976A剂量依赖性地改善了PSL模型小鼠戒断阈值的降低。我们还注射了GAT-3抑制剂(S)-SNAP5114,以检测其对PSL小鼠机械性异常性疼痛的抗异常性疼痛作用。静脉注射和腹腔注射(S)-SNAP5114均未对PSL模型小鼠戒断阈值的降低产生显著影响(图4B和5B)[2]。 |
| 细胞实验 |
细胞培养和表达[2]
中国仓鼠卵巢(CHO)细胞在37°C、5%CO2/95%空气的最低必需培养基α(a-MEM)中培养,该培养基补充了10%胎牛血清、100单位/ml青霉素G、100 mg/ml链霉素和0.25 mg/ml真菌酮。稳定表达转运体的细胞系分别被指定为CHO/小鼠GAT-1、CHO/鼠GAT-2、CH0/小鼠GAT-3、CHO/小鼠BGT-1、CHO/-大鼠去甲肾上腺素转运体(NET)、CH0/-大鼠血清素转运体和CHO/大鼠多巴胺转运体,并且之前已被克隆(35-38)。将细胞在培养基中稀释,置于48孔培养板中,培养24小时。 摄取试验[2] 用含氧Krebs-Ringer HEPES缓冲溶液(KRH;125 mM NaCl、5.2 mM KCl、1.2 mM CaCl2、1.4 mM MgSO4、1.2 mmol KH2PO4、5 mM葡萄糖和20 mM HEPES,pH 7.3)洗涤细胞3次,并在37°C下用10 nM[3H]GABA或其他放射性标记配体孵育10分钟,如前所述。在GABA和单胺(5-HT、NA和多巴胺)摄取测定期间,分别向孵育溶液中加入氨基氧乙酸(100 mM)和抗坏血酸(100 mM,加帕吉林(50 mM)。通过抽吸去除多余的放射性配体后,用冰冷的KRH快速洗涤细胞3次,用NaOH(1M)提取细胞中残留的任何放射性物质,并通过液体闪烁光谱法进行测量。在存在10mM冷GABA用于GABA摄取或10mM可卡因用于每种单胺摄取的情况下测定非特异性摄取。使用Prism 5分析GAT抑制剂的抑制效力(IC50值)。 |
| 动物实验 |
Animal/Disease Models: Partial sciatic nerve ligation (PSL) mice with mechanical allodynia[2]
Doses: 0.01, 0.1 and 0.3 mg/kg Route of Administration: intraperitoneal (ip) injection or intrathecal injection; 0.1 mg/kg, once Experimental Results: Dose-dependently reversed mechanical allodynia in PSL model mice by both intraperitoneal (ip) injection and intrathecal injection. GEP rats of either sex were kept in groups of 3–6 in cages (53×35×18 cm) placed in a room maintained at 19–22°C with a relative humidity of 55±3% and a light/dark cycle of 14 h/10 h with ad libitum access to food and water. Male Sprague–Dawley rats for amygdala kindling were held individually in cages (42×26×18 cm) at a reversed light/dark cycle of 12 h/12 h, but otherwise as described for GEP rats. Male NMRI mice for MES test and DBA/2 mice of either sex were housed in groups of 40 in cages (59×38×20 cm) at light/dark cycle of 12 h/12 h, but otherwise as described for GEP rats. All animal experiments were performed between 09:00 and 12:00, except for the study in GEP-rats which was performed between 09:00 and 16:00. Vehicle for NNC 05-2045 and NNC 05-2090 in seizure tests were saline (0.9% w/v NaCl in MiliQ water) with 5% Cremophor® and 10% dimethyl sulfoxide (DMSO), pH adjusted to 7 with NaOH. In NMRI and DBA/2 mice drug or vehicle administration was performed i.p. at 0.5–1 h prior to seizure test. Kindled rats received i.p. drug or vehicle administration 2 h before seizure test.[1] |
| 参考文献 | |
| 其他信息 |
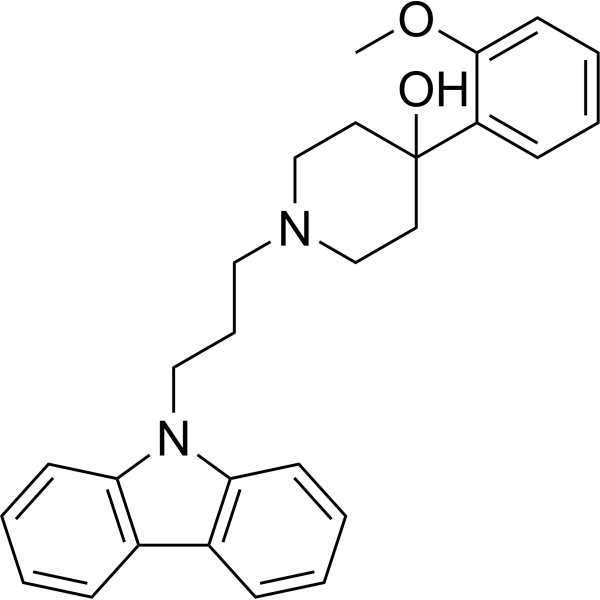
NNC 05-2090 hydrochloride is a GABA uptake inhibitor and inhibitor of the beta-GABA transporter (BGT-1).
A final comment which deserves mention is the fact that NNC 05-2045 is equipotent to lamotrigine in antagonizing MES and audiogenic induced seizures in DBA/2 mice, although it is less potent than lamotrigine in reducing severity of secondarily generalized seizures in amygdala kindled rats and audiogenic seizures in GEP rats. This suggests that drugs potently acting at non-GAT-1 GABA transporters have a significant potential as anticonvulsant drugs, with an in vivo profile differing from selective GAT-1 inhibitors. Taken together, the data obtained in the present study demonstrate anticonvulsant effects of two GABA uptake inhibitors in several animal models. Although we cannot reject the possibility that the observed anticonvulsant effects occur through a synergism of the GABAergic system with other transmitter systems (e.g. adrenergic), we suggest that the anticonvulsant effects of NNC 05-2045 and NNC 05-2090 are due primarily to an inhibition of GAT-3 mediated GABA transport with a possible minor contribution of inhibition of BGT-1 mediated GABA transport.[1] The GABAergic system in the spinal cord has been shown to participate in neuropathic pain in various animal models. GABA transporters (GATs) play a role in controlling the synaptic clearance of GABA; however, their role in neuropathic pain remains unclear. In the present study, we compared the betaine/GABA transporter (BGT-1) with other GAT subtypes to determine its participation in neuropathic pain using a mouse model of sciatic nerve ligation. 1-(3-(9H-Carbazol-9-yl)-1-propyl)-4-(2-methyoxyphenyl)-4-piperidinol (NNC 05-2090), an inhibitor that displays moderate selectivity for BGT-1, had an antiallodynic action on model mice treated through both intrathecally and intravenous administration routes. On the other hand, SKF89976A, a selective GAT-1 inhibitor, had a weak antiallodynic action, and (S)-SNAP5114, an inhibitor that displays selectivity for GAT-3, had no antiallodynic action. Systemic analysis of these compounds on GABA uptake in CHO cells stably expressing BGT-1 revealed that NNC 05-2090 not only inhibited BGT-1, but also serotonin, noradrenaline, and dopamine transporters, using a substrate uptake assay in CHO cells stably expressing each transporter, with IC50: 5.29, 7.91, and 4.08 μM, respectively. These values were similar to the IC50 value at BGT-1 (10.6 μM). These results suggest that the antiallodynic action of NNC05-2090 is due to the inhibition of both BGT-1 and monoamine transporters.[2] |
| 分子式 |
C27H30N2O2
|
|---|---|
| 分子量 |
414.54
|
| 精确质量 |
450.207
|
| 元素分析 |
C, 78.23; H, 7.29; N, 6.76; O, 7.72
|
| CAS号 |
184845-43-0
|
| 相关CAS号 |
NNC05-2090 hydrochloride;184845-18-9
|
| PubChem CID |
18782760
|
| 外观&性状 |
Typically exists as solid at room temperature
|
| 沸点 |
643.1ºC at 760 mmHg
|
| 闪点 |
342.7ºC
|
| 蒸汽压 |
2.04E-17mmHg at 25°C
|
| LogP |
5.916
|
| tPSA |
37.63
|
| 氢键供体(HBD)数目 |
2
|
| 氢键受体(HBA)数目 |
3
|
| 可旋转键数目(RBC) |
6
|
| 重原子数目 |
32
|
| 分子复杂度/Complexity |
554
|
| 定义原子立体中心数目 |
0
|
| SMILES |
Cl[H].O([H])C1(C2=C([H])C([H])=C([H])C([H])=C2OC([H])([H])[H])C([H])([H])C([H])([H])N(C([H])([H])C([H])([H])C([H])([H])N2C3=C([H])C([H])=C([H])C([H])=C3C3=C([H])C([H])=C([H])C([H])=C23)C([H])([H])C1([H])[H]
|
| InChi Key |
WDFXPKKFSNMGOO-UHFFFAOYSA-N
|
| InChi Code |
InChI=1S/C27H30N2O2.ClH/c1-31-26-14-7-4-11-23(26)27(30)15-19-28(20-16-27)17-8-18-29-24-12-5-2-9-21(24)22-10-3-6-13-25(22)29;/h2-7,9-14,30H,8,15-20H2,1H3;1H
|
| 化学名 |
1-(3-carbazol-9-ylpropyl)-4-(2-methoxyphenyl)piperidin-4-ol;hydrochloride
|
| 别名 |
NNC052090; NNC 05-2090; 1-(3-(9H-Carbazol-9-yl)propyl)-4-(2-methoxyphenyl)piperidin-4-ol; 1-[3-(9H-carbazol-9-yl)propyl]-4-(2-methoxyphenyl)piperidin-4-ol; 1-(3-(9H-carbazol-9-yl)-1-propyl)-4-(2-methoxyphenyl)-4-piperidinol; CHEMBL1446457; GTPL4610; SCHEMBL4293184;
|
| HS Tariff Code |
2934.99.9001
|
| 存储方式 |
Powder -20°C 3 years 4°C 2 years In solvent -80°C 6 months -20°C 1 month |
| 运输条件 |
Room temperature (This product is stable at ambient temperature for a few days during ordinary shipping and time spent in Customs)
|
| 溶解度 (体外实验) |
May dissolve in DMSO (in most cases), if not, try other solvents such as H2O, Ethanol, or DMF with a minute amount of products to avoid loss of samples
|
|---|---|
| 溶解度 (体内实验) |
注意: 如下所列的是一些常用的体内动物实验溶解配方,主要用于溶解难溶或不溶于水的产品(水溶度<1 mg/mL)。 建议您先取少量样品进行尝试,如该配方可行,再根据实验需求增加样品量。
注射用配方
注射用配方1: DMSO : Tween 80: Saline = 10 : 5 : 85 (如: 100 μL DMSO → 50 μL Tween 80 → 850 μL Saline)(IP/IV/IM/SC等) *生理盐水/Saline的制备:将0.9g氯化钠/NaCl溶解在100 mL ddH ₂ O中,得到澄清溶液。 注射用配方 2: DMSO : PEG300 :Tween 80 : Saline = 10 : 40 : 5 : 45 (如: 100 μL DMSO → 400 μL PEG300 → 50 μL Tween 80 → 450 μL Saline) 注射用配方 3: DMSO : Corn oil = 10 : 90 (如: 100 μL DMSO → 900 μL Corn oil) 示例: 以注射用配方 3 (DMSO : Corn oil = 10 : 90) 为例说明, 如果要配制 1 mL 2.5 mg/mL的工作液, 您可以取 100 μL 25 mg/mL 澄清的 DMSO 储备液,加到 900 μL Corn oil/玉米油中, 混合均匀。 View More
注射用配方 4: DMSO : 20% SBE-β-CD in Saline = 10 : 90 [如:100 μL DMSO → 900 μL (20% SBE-β-CD in Saline)] 口服配方
口服配方 1: 悬浮于0.5% CMC Na (羧甲基纤维素钠) 口服配方 2: 悬浮于0.5% Carboxymethyl cellulose (羧甲基纤维素) 示例: 以口服配方 1 (悬浮于 0.5% CMC Na)为例说明, 如果要配制 100 mL 2.5 mg/mL 的工作液, 您可以先取0.5g CMC Na并将其溶解于100mL ddH2O中,得到0.5%CMC-Na澄清溶液;然后将250 mg待测化合物加到100 mL前述 0.5%CMC Na溶液中,得到悬浮液。 View More
口服配方 3: 溶解于 PEG400 (聚乙二醇400) 请根据您的实验动物和给药方式选择适当的溶解配方/方案: 1、请先配制澄清的储备液(如:用DMSO配置50 或 100 mg/mL母液(储备液)); 2、取适量母液,按从左到右的顺序依次添加助溶剂,澄清后再加入下一助溶剂。以 下列配方为例说明 (注意此配方只用于说明,并不一定代表此产品 的实际溶解配方): 10% DMSO → 40% PEG300 → 5% Tween-80 → 45% ddH2O (或 saline); 假设最终工作液的体积为 1 mL, 浓度为5 mg/mL: 取 100 μL 50 mg/mL 的澄清 DMSO 储备液加到 400 μL PEG300 中,混合均匀/澄清;向上述体系中加入50 μL Tween-80,混合均匀/澄清;然后继续加入450 μL ddH2O (或 saline)定容至 1 mL; 3、溶剂前显示的百分比是指该溶剂在最终溶液/工作液中的体积所占比例; 4、 如产品在配制过程中出现沉淀/析出,可通过加热(≤50℃)或超声的方式助溶; 5、为保证最佳实验结果,工作液请现配现用! 6、如不确定怎么将母液配置成体内动物实验的工作液,请查看说明书或联系我们; 7、 以上所有助溶剂都可在 Invivochem.cn网站购买。 |
| 制备储备液 | 1 mg | 5 mg | 10 mg | |
| 1 mM | 2.4123 mL | 12.0616 mL | 24.1231 mL | |
| 5 mM | 0.4825 mL | 2.4123 mL | 4.8246 mL | |
| 10 mM | 0.2412 mL | 1.2062 mL | 2.4123 mL |
1、根据实验需要选择合适的溶剂配制储备液 (母液):对于大多数产品,InvivoChem推荐用DMSO配置母液 (比如:5、10、20mM或者10、20、50 mg/mL浓度),个别水溶性高的产品可直接溶于水。产品在DMSO 、水或其他溶剂中的具体溶解度详见上”溶解度 (体外)”部分;
2、如果您找不到您想要的溶解度信息,或者很难将产品溶解在溶液中,请联系我们;
3、建议使用下列计算器进行相关计算(摩尔浓度计算器、稀释计算器、分子量计算器、重组计算器等);
4、母液配好之后,将其分装到常规用量,并储存在-20°C或-80°C,尽量减少反复冻融循环。
计算结果:
工作液浓度: mg/mL;
DMSO母液配制方法: mg 药物溶于 μL DMSO溶液(母液浓度 mg/mL)。如该浓度超过该批次药物DMSO溶解度,请首先与我们联系。
体内配方配制方法:取 μL DMSO母液,加入 μL PEG300,混匀澄清后加入μL Tween 80,混匀澄清后加入 μL ddH2O,混匀澄清。
(1) 请确保溶液澄清之后,再加入下一种溶剂 (助溶剂) 。可利用涡旋、超声或水浴加热等方法助溶;
(2) 一定要按顺序加入溶剂 (助溶剂) 。