| 规格 | 价格 | |
|---|---|---|
| 500mg | ||
| 1g | ||
| Other Sizes |
| 靶点 |
Integrin receptor
|
|---|---|
| 体外研究 (In Vitro) |
使用 Arg-Gly-Asp-Ser 的整个表面修饰过程导致 αvβ3 整合素上调。当磷脂酰肌醇 3 途径被阻断时,Arg-Gly-Asp 依赖的细胞抗氧化能力就会被消除 [1]。来自 procaspase-3、-8 和 -9 的反应。 Arg-Gly-Asp-Ser-肽与survivin结合的激活作用位于survivin的C端,具有高亲和力(Kd 27.5 μM)。生存素反应和 Arg-Gly-Asp-Ser 似乎是重要因素,因为某些 siRNA 导致生存素增殖导致 Arg-Gly-Asp-Ser 失去其在细胞中的抗有丝分裂功能 [4]。
测试了Arg-Gly-Asp-SerRGDS肽调节培养中成骨细胞存活的假设。成骨细胞样MC3T3-E1细胞被允许附着在RGDS肽上,RGDS肽利用之前描述的移植技术被固定在硅胶表面。RGDS修饰的表面导致α(v)β(3)整合素的上调。我们注意到活化的粘着斑激酶和活化的Akt的表达增加。抗凋亡蛋白Bcl-2、促凋亡蛋白Bad或Bad的灭活形式pBad的表达水平没有变化。RGDS处理的膜上的附着完全消除了星孢菌素、钙(2+)诱导的细胞凋亡。P(i)离子对和硝普钠。然而,表面修饰不会干扰游离RGDS肽或无血清培养基介导的细胞凋亡。当磷脂酰肌醇3-激酶途径的活性被抑制时,RGDS依赖性的凋亡抗性被消除。这些结果表明,细胞与RGDS的结合通过线粒体途径消除了凋亡,凋亡的抑制取决于磷脂酰肌醇3-激酶的活性。[1] 在本研究中,我们首次表明RGDS肽以时间依赖的方式内化在黑色素瘤细胞中,并独立于其细胞外抗粘附作用发挥强烈的抗增殖和促凋亡作用。RGES对照肽没有显示出预期的生物效应;然而,它被内化了,尽管动力学较慢。Survivin是一种已知的细胞周期和生存调节因子,在黑色素瘤细胞中高度表达。细胞裂解物中的共免疫沉淀试验和纯化蛋白的覆盖试验表明,Arg-Gly-Asp-Ser与存活素以及前天冬氨酸蛋白酶-3、-8和-9相互作用。发现RGDS肽与存活素结合是特异性的,具有高亲和力(Kd 27.5 muM),位于存活素C末端。RGDS-survivin相互作用似乎起着关键作用,因为RGDS在具有特定siRNA的survivin缺失细胞中失去了抗有丝分裂作用。 结论:Arg-Gly-Asp-Ser/RGDS以非粘附机制抑制黑色素瘤生长;它在黑色素瘤细胞中内化,并与survivin特异性相互作用。目前的数据可能表明,从细胞外基质生理释放的含RGDS肽具有新的作用,并可能表明黑色素瘤中可能存在一种新的抗增殖策略[4]。 |
| 体内研究 (In Vivo) |
LPS 后 4 小时,Arg-Gly-Asp-Ser(2.5 或 5 mg/kg,LPS 前 1 小时)显着降低 BAL 液中 LPS 诱导的 MMP-9 活性。 LPS 给药前 1 小时和给药后 4 小时,腹腔注射 Arg-Gly-Asp-Ser(1、2.5 或 5 mg/kg)可抑制 BAL 液中 TNF-α 和 MIP-2 水平的升高,该升高是由以下原因引起的:脂多糖[2]。 Arg-Gly-Asp-Ser 肽可显着降低肿瘤坏死因子 (TNF)-α 和巨噬细胞刺激蛋白 (MIP)-2 的产生以及髓过氧化物酶 (MPO) 和 NF-κB 活性 [3]。
Arg-Gly-Asp-Ser/RGDS预处理抑制了LPS诱导的中性粒细胞和巨噬细胞数量、总蛋白水平、TNF-α和MIP-2水平以及LPS处理后4或24小时支气管肺泡灌洗液(BAL)中基质金属蛋白酶-9活性的增加。RGDS抑制LPS诱导的肺组织中粘着斑激酶和MAP激酶(包括ERK、JNK和p38 MAP激酶)的磷酸化。重要的是,当在LPS处理后2小时给予该肽时,炎症反应和激酶途径的抑制仍然很明显。同样,在LPS后4或24小时,针对整合素αv的阻断抗体显著抑制了LPS诱导的炎性细胞向肺部的迁移、BAL液中的蛋白质积累和促炎介质的产生。抗β3还抑制了所有LPS诱导的炎症反应,除了LPS后24小时BAL蛋白的积累。 结论:这些结果表明,对α-葡萄糖苷具有高特异性的Arg-Gly-Asp-Ser/RGDS可以减轻LPS诱导的急性肺损伤发展过程中的炎症级联反应。[2] 用合成的Arg-Gly-Asp-Ser/RGDS肽再治疗显著改善了LPS/D-GalN诱导的死亡率,以及丙氨酸氨基转移酶(ALT)和天冬氨酸氨基转移酶的活性以及病理分析所确定的肝损伤。此外,RGDS肽显著降低了肿瘤坏死因子(TNF)-α和巨噬细胞炎性蛋白(MIP)-2的产生,并降低了髓过氧化物酶(MPO)和NF-κB的活性。此外,Western印迹表明,磷酸整合素β3、磷酸粘着斑激酶(FAK)和磷酸p38丝裂原活化蛋白激酶(MAPK)的水平随着RGDS肽预处理而降低。 结论:这些数据共同表明,合成的Arg-Gly-Asp-Ser/RGDS肽通过抑制炎性细胞迁移和阻断整合素αVβ3-FAK-p38 MAPK和NF-κB信号传导来保护LPS/D-GalN诱导的FHF[3]。 |
| 酶活实验 |
RGD处理硅膜的制备[1]
利用先前基于Dee等人最初报道的方法描述的技术将RGD肽接枝到硅酮表面。简而言之,将0.005英寸的硅酮片暴露于紫外光/臭氧下10分钟,以对表面进行官能化和氧化。然后通过用0.2 mm 3-氨基丙基三乙氧基硅烷在己烷中处理45分钟来改性官能化的硅酮表面。3-氨基丙基三乙氧基硅分子与OH基团反应,产生胺化表面。然后在己烷浴中对硅酮膜进行超声处理,以去除多余的反应物。将胺化膜与0.2 mmArg-Gly-Asp-Ser/RGDS或RGES肽在1-乙基-3-(3-二甲基氨基丙基)碳二亚胺和N-乙基吗啉中孵育。肽的羧基末端与硅烷分子的氨基反应,从而形成与生物材料表面的共价连接。用N,N-二甲基甲酰胺和蒸馏水冲洗用结合肽修饰的膜。通过在N,N-二甲基甲酰胺中超声处理15分钟去除未结合的肽。最后,将带有共价连接肽的膜在75%乙醇中灭菌。使用RGES肽,按照与Arg-Gly-Asp-Ser/RGDS相同的程序设计对照表面。研究表明,当Glu替代Asp时,生物活性会严重丧失。 固相分析[4] 如前所述,通过固相分析(SPA)评估Bt-RGDS与重组GST融合蛋白的结合,并进行了修改。简而言之,在室温下,用175 nM(100μl/孔)重组GST融合蛋白在AC7.5缓冲液中稀释4小时,涂覆微量滴定板。将孔在4°C下用30 mg/ml BSA(300μl/孔)封闭过夜,洗涤并在室温下用递增剂量的bt RGDS(1.75至1.75 mM)孵育4小时,无论是否存在过量的非生物素化RGDS/Arg-Gly-Asp-Ser作为特异性竞争对手。用100μl/孔Vectastain ABC试剂洗涤四次并在室温下孵育1小时后,根据制造商的说明用ELISA扩增系统对孔进行染色,并测定495 nm处的吸收(A495)。通过从每种浓度的总结合中减去非特异性来计算特异性结合。根据以下一个位点特异性结合方程进行曲线拟合。 |
| 细胞实验 |
细胞培养[1]
本研究中使用了成骨样MC3T3-E1细胞。我们之前的研究表明,MC3T3-E1细胞的凋亡反应与从骨碎片中分离出的原代人成骨细胞的凋亡响应相同。细胞被保存在10毫升的完全培养基中,该培养基由Dulbecco的最低必需培养基组成,补充了10%的胎牛血清、2毫米l-谷氨酰胺和50μg/ml青霉素/链霉素,pH 7.4。细胞达到融合后,用5ml 0.1%胶原酶在无Ca2+和Mg+的Hanks缓冲盐水溶液中处理后释放。然后将细胞重新接种在100mm培养皿和12孔或24孔板中的改性硅胶膜上。每隔一天给培养物喂食添加了50μg/ml抗坏血酸和5mmβ-甘油磷酸的完全培养基。为了评估细胞死亡,将成骨样细胞分别以50000/孔或25000/孔的密度铺在12孔或24孔板中的实验(Arg-Gly-Asp-Ser/RGDS)和对照(RGES)基质上。在完全培养基中培养3天后,成骨细胞与亚致死剂量的星孢菌素(0.1和0.5μm)、Ca2+(2.4和2.9 mm)和Pi(3 mm)离子对、硝普钠(0.5和0.1 mm)或RGDS(1 mm和5 mm)一起孵育过夜,或者血清饥饿。离子对、硝普钠和星孢菌素都通过内在途径诱导细胞死亡;RGDS和血清饥饿可能通过线粒体非依赖性途径杀死成骨细胞。 整合素的蛋白质印迹分析[1] 在制备的Arg-Gly-Asp-Ser/RGDS或RGES表面上培养0.5、3、24和72小时后,将细胞溶解在1%Nonidet P-40裂解缓冲液中。使用BCA蛋白测定试剂盒测定蛋白质浓度。将100μg蛋白质与1:50稀释的抗β3整合素多克隆IgG免疫复合。在冰上温和混合并孵育1小时后,将20μg蛋白A-Sepharose珠加入裂解液中。将混合物在4°C下以10000×g离心15秒;用裂解缓冲液洗涤沉淀物五次,并重新悬浮在Laemmli样品缓冲液中。蛋白质在3-8%三乙酸甘油酯凝胶(SDS-PAGE)中分离,并转移到硝化纤维膜上。将膜在含有5%脱脂奶粉的Tris缓冲盐水中封闭。在Tris缓冲盐水中洗涤后,将印迹与αv抗体(1:1000)在室温下孵育过夜。洗涤印迹并用辣根过氧化物偶联抗体孵育1小时,使用ECL化学发光试剂盒和柯达X-Omat蓝膜检测阳性条带。GAPDH用作对照来估计凝胶上的蛋白质负载。抗GAPDH抗体的浓度为2.4μg/ml。 增殖试验和细胞凋亡[4] 将SK-MEL-110铺在6孔板(8×104个细胞/孔)上的IV型胶原(50μg/ml)上,并在5%CO2的完全培养基中生长24小时。然后将细胞血清饥饿24小时,随后用溶解在含FGF-2的DMEM中的Arg-Gly-Asp-Ser/RGDS或RGES作为对照(500μg/ml)处理48小时。然后,拍摄细胞照片,用胰蛋白酶-EDTA收获,并用血细胞计数器计数。在其他实验中,细胞在RGDS处理前用通用胱天蛋白酶抑制剂(Z-VAD-FMK)(50μM)预处理2小时。为了分析细胞周期和亚G1期,将细胞固定在冰冷的70%乙醇中,并用终浓度为10μg/ml的碘化丙啶(PI)染色。流式细胞术在Profile I流式细胞仪上进行。 生物素化RGDS(bt-RGDS)内化和与重组蛋白的相互作用[4] 为了研究肽内化,将细胞用生物素化RGDS(bt-RGDS)或生物素化RGES(bt-RGES)作为对照处理不同时间点,用藻红蛋白结合的抗生物素蛋白染色,并通过FACS进行分析。在另外的实验中,在IV型胶原上生长的细胞被血清饥饿48小时,并用单独的生物素或不同剂量的bt RGDS(10-50-100μg/ml)处理24小时。在其他实验中,细胞用50μg/ml的bt RGDS处理,过量1 mg/ml的未标记RGDS作为特异性竞争对手。洗涤细胞以消除结合到膜上的bt RGDS,并如前所述制备细胞质提取物。将细胞质裂解物点样到硝化纤维上,用TPBS中的5%牛奶(PBS中的0.1%吐温20)封闭,用Vectastain ABC过氧化物酶试剂盒在室温下孵育1小时,然后进行化学发光反应并暴露于柯达胶片。通过密度测定法对相互作用进行量化,并使用“Quantity one”软件进行分析。[4] 在其他实验中,将40μg生长细胞细胞质提取物或增加剂量的重组人生存素(0.3-0.9-1.5-3-5μg)或其他重组蛋白(如胱天蛋白酶-1和-9、前胱天蛋白酶-9、纤维连接蛋白(0.9μg)和BSA)点样到硝化纤维上,在有或没有RGDS过量(10mg/ml)的情况下,与bt RGDS(1mg/ml)在室温下孵育4小时,以测量特异性结合。 共聚焦显微镜[4] SK-MEL-110接种在涂有IV型胶原的盖玻片上,用bt-RGDS(500μg/ml)处理24小时,如前所述进行洗涤,以消除结合在膜上的肽。细胞用pH 7.4的PBS中的3%多聚甲醛固定10分钟,在室温下用pH 7.4 PBS中的0.1%Triton X-100透化5分钟,在RT下用pH 7.4PBS中的2%BSA封闭30分钟,然后在室温下与pH 7.4的PBS-中的荧光素抗生物素蛋白孵育1小时。在pH 7.4的PBS-中用0.3%Triton X-100-PBS洗涤后,用终浓度为5μg/ml的PI孵育细胞以观察细胞核,并使用蔡司LSM 510元共聚焦显微镜进行分析。所有检查样品的激光功率、分束器、滤光片设置、针孔直径和扫描模式都是相同的。为了观察活性半胱氨酸天冬氨酸蛋白酶-3的形式,用Arg-Gly-Asp-Ser/RGDS或RGES处理细胞,固定并与兔单克隆抗活性半胱氨酸天冬酶-3(1:150)一起孵育。 |
| 动物实验 |
Mouse pharyngeal aspiration was performed as described by Rao et al. Animals were anesthetized with a mixture of ketamine and xylazine (45 mg/kg and 8 mg/kg, i.p., respectively). Test solution (30 μl) containing LPS (1.5 mg/kg) was placed posterior in the throat and aspirated into the lungs. Control mice were administrated sterile saline (0.9% NaCl). Animals were administered with Arg-Gly-Asp-Ser/RGDS or RGES peptide (1, 2.5 or 5 mg/kg, i.p.) once one hour before LPS treatment and sacrificed 4 h post-LPS Animals were also administered Arg-Gly-Asp-Ser/RGDS or RGES peptide (5 mg/kg, i.p.) once at different time points (1 h before or 2 h after LPS treatment) and sacrificed 24 h post-LPS. In addition, animals were administered with αvβ3-blocking mAbs, anti-αv, or anti-β3 (5 mg/kg, i.p.) once 1 h before and sacrificed 4 h post-LPS. Animals administered with these mAbs 2 h after LPS treatment were sacrificed 24 h post-LPS [2].
To investigate the protection effect of Arg-Gly-Asp-Ser/RGDS peptides, mice were divided into four groups. Group I mice were intraperitoneally (i.p.) injected with normal saline as control. Group II mice were i.p. injected with Arg-Gly-Asp-Ser/RGDS peptide (5 mg/kg, dissolved in normal saline) alone. Group III mice were i.p. injected with LPS (50 μg/kg, dissolved in normal saline)/D-GalN (800 mg/kg, dissolved in saline). Group IV mice were pretreated with Arg-Gly-Asp-Ser/RGDS peptide (5 mg/kg) i.p. 30 min before an injection of LPS (50 μg/kg) and D-GalN (800 mg/kg). In some experiments, recombinant murine TNF-α (5 μg/kg) together with RGDS peptide (5 mg/kg) i.p. 30 min before an injection of LPS (50 μg/kg) and D-GalN (800 mg/kg).[3] Six hours after LPS/D-GalN challenging, blood samples were collected, centrifuged at 3000 r.p.m. for 10 min to collect clear serum, for ALT, AST, and ELISA detection. And then, mice were sacrificed by decapitation. A portion of liver tissue was kept in 4% paraformaldehyde for histologic analysis. The rest of tissues were washed in cold saline and preserved at −80°C for further analysis of MPO, reverse transcription-polymerase chain reaction (RT-PCR), Western blotting and NF-κB activity. The survival rates were observed every 6 h within 48 h after LPS/D-GalN administration.[3] |
| 参考文献 | |
| 其他信息 |
Background: Synthetic peptides containing the RGD sequence inhibit integrin-related functions in different cell systems. Here, we investigated the effects of synthetic Arg-Gly-Asp-Ser (RGDS) peptide on key inflammatory responses to intratracheal (i.t.) lipopolysaccharide (LPS) treatment and on the integrin signaled mitogen-activated protein (MAP) kinase pathway during the development of acute lung injury.
Methods: Saline or LPS (1.5 mg/kg) was administered i.t. with or without a single dose of RGDS (1, 2.5, or 5 mg/kg, i.p.), anti-alphav or anti-beta3 mAb (5 mg/kg, i.p.). Mice were sacrificed 4 or 24 h post-LPS.
The present study suggests that RGDS inhibits integrin (αvβ3)-dependent induction of inflammatory cell migration into the lungs, and proinflammatory mediator production. Our data also suggest that the protective effect of RGDS on pulmonary leakage is αv-dependent, but not β3. Importantly, posttreatment with RGDS was also highly effective at reducing these inflammatory responses correlated with its inhibitory effect on integrin signaled MAP kinase pathways. In addition, blockading the integrin-FAK-MAP kinase pathway with RGDS may reduce lung injury progression. Since RGDS has high specificity for αvintegrins and the in vivo efficacy to access target cells as a small-molecule, it may effectively attenuate inflammatory cascade during LPS-induced development of acute lung injury. [2] RGDS peptide has been reported to possess high efficiency against a series of malignancies such as recurrent glioblastoma, metastatic melanoma, and prostate cancer in clinical developments, it evokes our attentions to RGDS peptide, it evokes our attentions to RGDS peptide. In our study, we found that the synthetic RGDS peptide is a potential agent to protect against LPS/D-GalN-induced FHF. RGDS peptide improved LPS/D-GalN-induced survival rate, the extent of liver jury, inhibited macrophage and neutrophil migration, and TNF-α production by inhibiting the integrin αvβ3-FAK-p38 MAPK signaling and NF-κB signaling. The ability of RGDS to protect from LPS/D-GalN-induced FHF provides a potential therapeutic strategy to intervene in human liver injury diseases. In FHF, integrin signaling may contribute to disease pathogenesis and prognosis, which may become an important molecular target for treating inflammatory related hepatic disease.[3] Background: RGD-motif acts as a specific integrins-ligand and regulates a variety of cell-functions via extracellular action affecting cell-adhesion properties. However, increasing evidence identifies additional RGDS-functions at intracellular level. Previous reports show RGDS-internalization in endothelial cells, cardiomyocytes and lymphocytes, indicating intracellular targets such as caspase-8 and caspase-9, and suggest RGDS specific activity at cytoplasmic level. Given the role RGDS-peptides play in controlling proliferation and apoptosis in several cell types, investigating intracellular targets of RGDS in melanoma cells may un-reveal novel molecular targets and key pathways, potentially useful for a more effective approach to melanoma treatment.[4] |
| 分子式 |
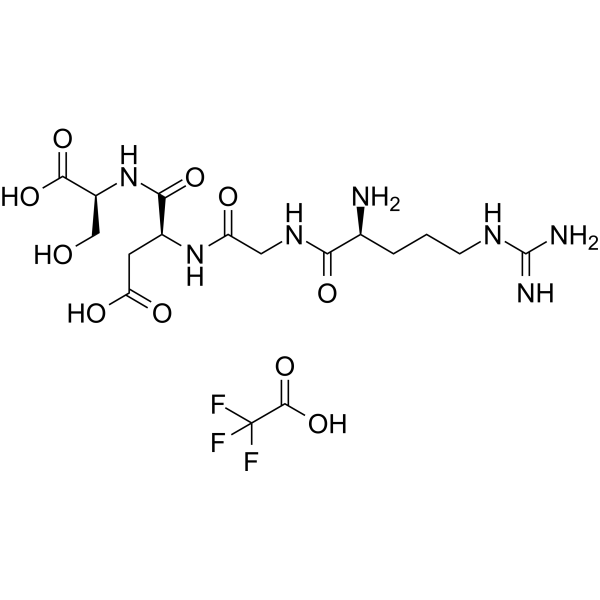
C17H28F3N7O10
|
|---|---|
| 分子量 |
547.44
|
| 精确质量 |
547.1849
|
| 相关CAS号 |
Arg-Gly-Asp-Ser;91037-65-9
|
| PubChem CID |
139035042
|
| 序列 |
H-Arg-Gly-Asp-Ser-OH.TFA; L-arginyl-glycyl-L-alpha-aspartyl-L-serine trifluoroacetic acid
|
| 短序列 |
RGDS
|
| 外观&性状 |
Typically exists as solid at room temperature
|
| tPSA |
310 Ų
|
| 氢键供体(HBD)数目 |
10
|
| 氢键受体(HBA)数目 |
15
|
| 可旋转键数目(RBC) |
14
|
| 重原子数目 |
37
|
| 分子复杂度/Complexity |
749
|
| 定义原子立体中心数目 |
3
|
| SMILES |
C(C[C@@H](C(=O)NCC(=O)N[C@@H](CC(=O)O)C(=O)N[C@@H](CO)C(=O)O)N)CN=C(N)N.C(=O)(C(F)(F)F)O
|
| InChi Key |
UMHUNRXMVGQLTE-YWUTZLAHSA-N
|
| InChi Code |
InChI=1S/C15H27N7O8.C2HF3O2/c16-7(2-1-3-19-15(17)18)12(27)20-5-10(24)21-8(4-11(25)26)13(28)22-9(6-23)14(29)30;3-2(4,5)1(6)7/h7-9,23H,1-6,16H2,(H,20,27)(H,21,24)(H,22,28)(H,25,26)(H,29,30)(H4,17,18,19);(H,6,7)/t7-,8-,9-;/m0./s1
|
| 化学名 |
(3S)-3-[[2-[[(2S)-2-amino-5-(diaminomethylideneamino)pentanoyl]amino]acetyl]amino]-4-[[(1S)-1-carboxy-2-hydroxyethyl]amino]-4-oxobutanoic acid;2,2,2-trifluoroacetic acid
|
| 别名 |
Arg-Gly-Asp-Ser (TFA); Arg-Gly-Asp-Ser TFA;
|
| HS Tariff Code |
2934.99.9001
|
| 存储方式 |
Powder -20°C 3 years 4°C 2 years In solvent -80°C 6 months -20°C 1 month |
| 运输条件 |
Room temperature (This product is stable at ambient temperature for a few days during ordinary shipping and time spent in Customs)
|
| 溶解度 (体外实验) |
May dissolve in DMSO (in most cases), if not, try other solvents such as H2O, Ethanol, or DMF with a minute amount of products to avoid loss of samples
|
|---|---|
| 溶解度 (体内实验) |
注意: 如下所列的是一些常用的体内动物实验溶解配方,主要用于溶解难溶或不溶于水的产品(水溶度<1 mg/mL)。 建议您先取少量样品进行尝试,如该配方可行,再根据实验需求增加样品量。
注射用配方
注射用配方1: DMSO : Tween 80: Saline = 10 : 5 : 85 (如: 100 μL DMSO → 50 μL Tween 80 → 850 μL Saline)(IP/IV/IM/SC等) *生理盐水/Saline的制备:将0.9g氯化钠/NaCl溶解在100 mL ddH ₂ O中,得到澄清溶液。 注射用配方 2: DMSO : PEG300 :Tween 80 : Saline = 10 : 40 : 5 : 45 (如: 100 μL DMSO → 400 μL PEG300 → 50 μL Tween 80 → 450 μL Saline) 注射用配方 3: DMSO : Corn oil = 10 : 90 (如: 100 μL DMSO → 900 μL Corn oil) 示例: 以注射用配方 3 (DMSO : Corn oil = 10 : 90) 为例说明, 如果要配制 1 mL 2.5 mg/mL的工作液, 您可以取 100 μL 25 mg/mL 澄清的 DMSO 储备液,加到 900 μL Corn oil/玉米油中, 混合均匀。 View More
注射用配方 4: DMSO : 20% SBE-β-CD in Saline = 10 : 90 [如:100 μL DMSO → 900 μL (20% SBE-β-CD in Saline)] 口服配方
口服配方 1: 悬浮于0.5% CMC Na (羧甲基纤维素钠) 口服配方 2: 悬浮于0.5% Carboxymethyl cellulose (羧甲基纤维素) 示例: 以口服配方 1 (悬浮于 0.5% CMC Na)为例说明, 如果要配制 100 mL 2.5 mg/mL 的工作液, 您可以先取0.5g CMC Na并将其溶解于100mL ddH2O中,得到0.5%CMC-Na澄清溶液;然后将250 mg待测化合物加到100 mL前述 0.5%CMC Na溶液中,得到悬浮液。 View More
口服配方 3: 溶解于 PEG400 (聚乙二醇400) 请根据您的实验动物和给药方式选择适当的溶解配方/方案: 1、请先配制澄清的储备液(如:用DMSO配置50 或 100 mg/mL母液(储备液)); 2、取适量母液,按从左到右的顺序依次添加助溶剂,澄清后再加入下一助溶剂。以 下列配方为例说明 (注意此配方只用于说明,并不一定代表此产品 的实际溶解配方): 10% DMSO → 40% PEG300 → 5% Tween-80 → 45% ddH2O (或 saline); 假设最终工作液的体积为 1 mL, 浓度为5 mg/mL: 取 100 μL 50 mg/mL 的澄清 DMSO 储备液加到 400 μL PEG300 中,混合均匀/澄清;向上述体系中加入50 μL Tween-80,混合均匀/澄清;然后继续加入450 μL ddH2O (或 saline)定容至 1 mL; 3、溶剂前显示的百分比是指该溶剂在最终溶液/工作液中的体积所占比例; 4、 如产品在配制过程中出现沉淀/析出,可通过加热(≤50℃)或超声的方式助溶; 5、为保证最佳实验结果,工作液请现配现用! 6、如不确定怎么将母液配置成体内动物实验的工作液,请查看说明书或联系我们; 7、 以上所有助溶剂都可在 Invivochem.cn网站购买。 |
| 制备储备液 | 1 mg | 5 mg | 10 mg | |
| 1 mM | 1.8267 mL | 9.1334 mL | 18.2668 mL | |
| 5 mM | 0.3653 mL | 1.8267 mL | 3.6534 mL | |
| 10 mM | 0.1827 mL | 0.9133 mL | 1.8267 mL |
1、根据实验需要选择合适的溶剂配制储备液 (母液):对于大多数产品,InvivoChem推荐用DMSO配置母液 (比如:5、10、20mM或者10、20、50 mg/mL浓度),个别水溶性高的产品可直接溶于水。产品在DMSO 、水或其他溶剂中的具体溶解度详见上”溶解度 (体外)”部分;
2、如果您找不到您想要的溶解度信息,或者很难将产品溶解在溶液中,请联系我们;
3、建议使用下列计算器进行相关计算(摩尔浓度计算器、稀释计算器、分子量计算器、重组计算器等);
4、母液配好之后,将其分装到常规用量,并储存在-20°C或-80°C,尽量减少反复冻融循环。
计算结果:
工作液浓度: mg/mL;
DMSO母液配制方法: mg 药物溶于 μL DMSO溶液(母液浓度 mg/mL)。如该浓度超过该批次药物DMSO溶解度,请首先与我们联系。
体内配方配制方法:取 μL DMSO母液,加入 μL PEG300,混匀澄清后加入μL Tween 80,混匀澄清后加入 μL ddH2O,混匀澄清。
(1) 请确保溶液澄清之后,再加入下一种溶剂 (助溶剂) 。可利用涡旋、超声或水浴加热等方法助溶;
(2) 一定要按顺序加入溶剂 (助溶剂) 。