| 规格 | 价格 | |
|---|---|---|
| 500mg | ||
| 1g | ||
| Other Sizes |
| 靶点 |
Luminescent enzyme substrate
|
|---|---|
| 体外研究 (In Vitro) |
腔肠素h盐酸盐(1-10μM)可作为RLuc8的发光底物[4]。在BRAC的Ca2+结合动力学测量中,将5nM BRAC蛋白与20μM腔肠素h盐酸盐在不同浓度的Ca2+缓冲液中快速混合,在1kHz下监测BRAC的金星(530nm)发射强度[4]。
RLuc8和Venus信号中观察到的漂移可能是由腔肠素-h的摄取和消耗或细胞形状的变化引起的。[4] 然后,我们通过停流光度系统测量了BRAC的Ca2+缔合动力学。然而,我们获得的时间过程数据由至少两个指数衰减分量(ι<0.1秒)组成,这些分量被认为来源于Ca2+和腔肠素-h与BRAC的结合。[4] 高等植物烟草(Nicotiana plumaginifolia)表达载脂蛋白的遗传转化最近被用作测量完整活体植物内细胞质游离钙([Ca2+]i)变化的方法(Knight,M.R.,a.K.Campbell,S.M.Smith和a.J.Trewavas.1991)。自然(伦敦)。352:524-526; 奈特、M.R.、S.M.Smith和A.J.Trewavas。1992.议事录。纳特尔。阿卡德。科学。美国,89:4967-4971)。在用发光体腔肠素处理后,钙激活的光蛋白水母发光蛋白在转化植物细胞的细胞质内形成。水母发光蛋白在结合游离钙(Ca2+)时以剂量依赖的方式发出蓝光。因此,对腔肠杆菌嗪处理的转基因植物细胞的光发射进行定量,可以直接测量[Ca2+]i。在这篇论文中,通过使用连接到光学显微镜的高灵敏度光子计数相机,我们首次成像了转基因烟草植物不同组织在冷休克、触摸和伤害下[Ca2+]i的变化。使用这种方法,我们能够观察到组织特异性[Ca2+]i反应。我们还展示了如何通过使用不同的腔肠杆菌嗪类似物来定制这种方法,这些类似物赋予了所得水母发光蛋白(称为半合成重组水母发光蛋白)不同的性质。通过使用能使重组水母发光蛋白报告蛋白对Ca2+更敏感的腔肠素H,我们能够对接触和伤害引起的[Ca2+]i相对较小的变化进行成像:使用标准腔肠素时无法检测到这些变化。用另一种腔肠素类似物(e-腔肠素)重组水母发光蛋白,产生具有双峰发光光谱的半合成重组水母发光素。两个波长(421和477nm)的发光比提供了一种比以前更简单的体内[Ca2+]i定量方法。这种方法的好处是,不需要关于水母发光蛋白表达、重构或消耗量的信息,而这通常是用水母发光蛋白校准所必需的[2]。 |
| 酶活实验 |
蛋白质表达、纯化和体外Ca2+滴定[4]
在23°C下,在大肠杆菌[JM109(DE3)]中表达具有N-末端聚组氨酸标签的重组BRAC蛋白,使用Ni-NTA柱纯化。使用分光光度计和微孔板读数器测量BRAC的发射光谱。最终浓度为1-10µM腔肠素-h被用作RLuc8的发光基质。Ca2+滴定是通过将使用O,O′-双(2-氨基乙基)乙二醇-N,N,N′,N′-四乙酸(EGTA)、N-(2-羟乙基)乙二胺-N,N',N'-三乙酸(EDTA-OH)或氮基三乙酸(NTA)在100 mM KCl、10 mM MOPS(pH 7.2)中制备的无Ca2+和Ca2+饱和缓冲液相互稀释来进行的。分别使用0.15、4.3和170µM作为EGTA、EDTA-OH和NTA对Ca2+的Kd值来计算游离Ca2+浓度[20]。通过非线性回归分析,使用Ca2+滴定曲线计算表观Kd值。使用Origin7软件将八次独立测量的平均数据拟合到Hill方程中。 Ca2+结合动力学的测量[4] 使用由RX.2000快速混合停流装置和FP-750分光光度计组成的停流光度系统对BRAC的Ca2+结合动力学进行了测量。在不同浓度的Ca2+缓冲液中快速混合5 nm BRAC蛋白和20µM腔肠素-h后,在1 kHz下监测BRAC的Venus(530 nm)发射强度。在这个实验中,我们在测量之前没有将腔肠素-h与BRAC混合,以避免在样品制备过程中BRAC中的Rluc8对腔肠素-h的不必要消耗。因此,在停流实验中,发射强度的时间过程由Ca2+与BRAC结合、腔肠素-h与BRAC的结合以及BRAC对腔肠素-h的催化氧化动力学的三个组成部分组成。为了估算Rluc8在BRAC中对腔肠素-h的催化氧化作用,我们测量了BRAC与20µM腔肠素-h在无Ca2+溶液中混合后的发射强度变化的时间过程,并将获得的数据用作“基线”。然后,我们分别将1体积的BRAC在无Ca2+缓冲液中与25体积的含1.69µM Ca2+的溶液混合,以及1体积的BRAC在1.69µM Ca2+溶液中与25容量的无Ca2+缓冲剂混合,测量了Ca2+与BRAC结合和解离的时间过程。至少5次独立测量的平均数据用于以下分析。用基线减去缔合和解离动力学的平均时间过程数据,以去除由BRAC自主催化氧化腔肠素-h得到的分数。然后,使用0.2秒至2.0秒的数据,通过单指数方程中的曲线拟合计算时间常数(ι),以最小化混合后腔肠素-h与BRAC缔合产生的信号的贡献。如前所示,对YC3.60的Ca2+结合动力学进行了测量。在停流实验中,通过在100 mM KCl、10 mM MOPS(pH 7.2)中用O,O′-双(2-氨基乙基)乙二醇-N,N,N′,N′-四乙酸(EGTA)制备的无Ca2+和Ca2+饱和缓冲液的相互稀释来控制最终的Ca2+浓度。用用CaCl2标准溶液校准的Ca2+敏感电极确认每种溶液中的游离Ca2+浓度。 |
| 细胞实验 |
细胞培养和转染[4]
Hela细胞在自制的35毫米玻璃底皿中在含有10%胎牛血清的DMEM中培养。通过Lipofectamine 2000用质粒转染细胞。转染后1至2天,对表达BRAC或G5A的细胞进行成像。在观察BRAC之前和观察G5A之前1-4小时,将10µM的腔肠素-h加入培养基中。 |
| 参考文献 |
|
| 其他信息 |
Renilla luciferin is a member of phenols and an imidazopyrazine. It has a role as a luciferin. It derives from a hydride of an imidazo[1,2-a]pyrazine.
A series of new coelenterazine analogs with varying substituents at the C-6 position of the imidazopyrazinone core have been designed and synthesized for the extension of bioluminescence substrates. Some of them display excellent bioluminescence properties compared to DeepBlueC™ or native coelenterazine with both in vitro and in vivo biological evaluations, thus placing these derivatives among the most ideal substrates for Renilla bioluminescence applications.[1] Luminescence imaging has gained attention as a promising bio-imaging modality in situations where fluorescence imaging cannot be applied. However, wider application to multicolour and dynamic imaging is limited by the lack of bright luminescent proteins with emissions across the visible spectrum. Here we report five new spectral variants of the bright luminescent protein, enhanced Nano-lantern (eNL), made by concatenation of the brightest luciferase, NanoLuc, with various colour hues of fluorescent proteins. eNLs allow five-colour live-cell imaging, as well as detection of single protein complexes and even single molecules. We also develop an eNL-based Ca2+ indicator with a 500% signal change, which can image spontaneous Ca2+ dynamics in cardiomyocyte and neural cell models. These eNL probes facilitate not only multicolour imaging in living cells but also sensitive imaging of a wide repertoire of proteins, even at very low expression levels.[3] Efficient bioluminescence resonance energy transfer (BRET) from a bioluminescent protein to a fluorescent protein with high fluorescent quantum yield has been utilized to enhance luminescence intensity, allowing single-cell imaging in near real time without external light illumination. Methodology/principal findings: We applied BRET to develop an autoluminescent Ca(2+) indicator, BRAC, which is composed of Ca(2+)-binding protein, calmodulin, and its target peptide, M13, sandwiched between a yellow fluorescent protein variant, Venus, and an enhanced Renilla luciferase, RLuc8. Adjusting the relative dipole orientation of the luminescent protein's chromophores improved the dynamic range of BRET signal change in BRAC up to 60%, which is the largest dynamic range among BRET-based indicators reported so far. Using BRAC, we demonstrated successful visualization of Ca(2+) dynamics at the single-cell level with temporal resolution at 1 Hz. Moreover, BRAC signals were acquired by ratiometric imaging capable of canceling out Ca(2+)-independent signal drifts due to change in cell shape, focus shift, etc. Conclusions/significance: The brightness and large dynamic range of BRAC should facilitate high-sensitive Ca(2+) imaging not only in single live cells but also in small living subjects.[4] |
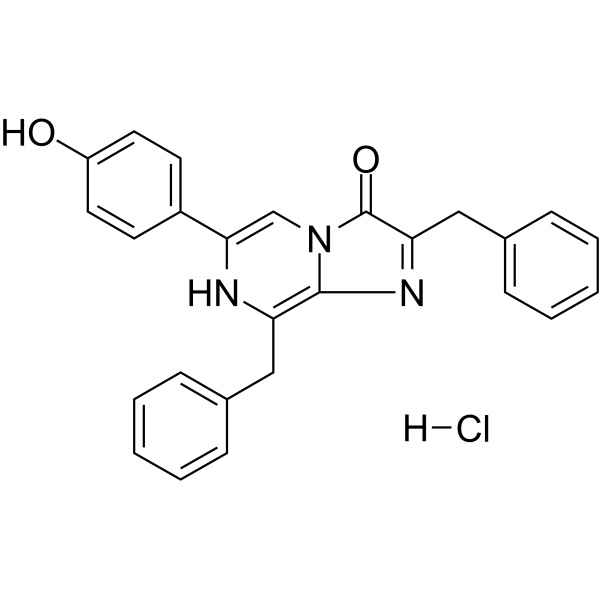
| 分子式 |
C26H22CLN3O2
|
|---|---|
| 分子量 |
443.92
|
| 精确质量 |
443.1400
|
| 相关CAS号 |
50909-86-9
|
| 外观&性状 |
Typically exists as Light yellow to orange solid at room temperature
|
| LogP |
4.6
|
| tPSA |
70.6Ų
|
| InChi Key |
WNNCQCAQZZMPOX-UHFFFAOYSA-N
|
| InChi Code |
InChI=1S/C26H21N3O2.ClH/c30-21-13-11-20(12-14-21)24-17-29-25(22(27-24)15-18-7-3-1-4-8-18)28-23(26(29)31)16-19-9-5-2-6-10-19;/h1-14,17,30-31H,15-16H2;1H
|
| 化学名 |
2,8-dibenzyl-6-(4-hydroxyphenyl)imidazo[1,2-a]pyrazin-3-ol;hydrochloride
|
| 别名 |
Coelenterazine h (hydrochloride); Coelenterazine h hydrochloride;
|
| HS Tariff Code |
2934.99.9001
|
| 存储方式 |
Powder -20°C 3 years 4°C 2 years In solvent -80°C 6 months -20°C 1 month 注意: (1). 本产品在运输和储存过程中需避光。 (2). 请将本产品存放在密封且受保护的环境中(例如氮气保护),避免吸湿/受潮。 |
| 运输条件 |
Room temperature (This product is stable at ambient temperature for a few days during ordinary shipping and time spent in Customs)
|
| 溶解度 (体外实验) |
DMSO :~100 mg/mL (~225.27 mM; with sonication)
|
|---|---|
| 溶解度 (体内实验) |
注意: 如下所列的是一些常用的体内动物实验溶解配方,主要用于溶解难溶或不溶于水的产品(水溶度<1 mg/mL)。 建议您先取少量样品进行尝试,如该配方可行,再根据实验需求增加样品量。
注射用配方
注射用配方1: DMSO : Tween 80: Saline = 10 : 5 : 85 (如: 100 μL DMSO → 50 μL Tween 80 → 850 μL Saline)(IP/IV/IM/SC等) *生理盐水/Saline的制备:将0.9g氯化钠/NaCl溶解在100 mL ddH ₂ O中,得到澄清溶液。 注射用配方 2: DMSO : PEG300 :Tween 80 : Saline = 10 : 40 : 5 : 45 (如: 100 μL DMSO → 400 μL PEG300 → 50 μL Tween 80 → 450 μL Saline) 注射用配方 3: DMSO : Corn oil = 10 : 90 (如: 100 μL DMSO → 900 μL Corn oil) 示例: 以注射用配方 3 (DMSO : Corn oil = 10 : 90) 为例说明, 如果要配制 1 mL 2.5 mg/mL的工作液, 您可以取 100 μL 25 mg/mL 澄清的 DMSO 储备液,加到 900 μL Corn oil/玉米油中, 混合均匀。 View More
注射用配方 4: DMSO : 20% SBE-β-CD in Saline = 10 : 90 [如:100 μL DMSO → 900 μL (20% SBE-β-CD in Saline)] 口服配方
口服配方 1: 悬浮于0.5% CMC Na (羧甲基纤维素钠) 口服配方 2: 悬浮于0.5% Carboxymethyl cellulose (羧甲基纤维素) 示例: 以口服配方 1 (悬浮于 0.5% CMC Na)为例说明, 如果要配制 100 mL 2.5 mg/mL 的工作液, 您可以先取0.5g CMC Na并将其溶解于100mL ddH2O中,得到0.5%CMC-Na澄清溶液;然后将250 mg待测化合物加到100 mL前述 0.5%CMC Na溶液中,得到悬浮液。 View More
口服配方 3: 溶解于 PEG400 (聚乙二醇400) 请根据您的实验动物和给药方式选择适当的溶解配方/方案: 1、请先配制澄清的储备液(如:用DMSO配置50 或 100 mg/mL母液(储备液)); 2、取适量母液,按从左到右的顺序依次添加助溶剂,澄清后再加入下一助溶剂。以 下列配方为例说明 (注意此配方只用于说明,并不一定代表此产品 的实际溶解配方): 10% DMSO → 40% PEG300 → 5% Tween-80 → 45% ddH2O (或 saline); 假设最终工作液的体积为 1 mL, 浓度为5 mg/mL: 取 100 μL 50 mg/mL 的澄清 DMSO 储备液加到 400 μL PEG300 中,混合均匀/澄清;向上述体系中加入50 μL Tween-80,混合均匀/澄清;然后继续加入450 μL ddH2O (或 saline)定容至 1 mL; 3、溶剂前显示的百分比是指该溶剂在最终溶液/工作液中的体积所占比例; 4、 如产品在配制过程中出现沉淀/析出,可通过加热(≤50℃)或超声的方式助溶; 5、为保证最佳实验结果,工作液请现配现用! 6、如不确定怎么将母液配置成体内动物实验的工作液,请查看说明书或联系我们; 7、 以上所有助溶剂都可在 Invivochem.cn网站购买。 |
| 制备储备液 | 1 mg | 5 mg | 10 mg | |
| 1 mM | 2.2527 mL | 11.2633 mL | 22.5266 mL | |
| 5 mM | 0.4505 mL | 2.2527 mL | 4.5053 mL | |
| 10 mM | 0.2253 mL | 1.1263 mL | 2.2527 mL |
1、根据实验需要选择合适的溶剂配制储备液 (母液):对于大多数产品,InvivoChem推荐用DMSO配置母液 (比如:5、10、20mM或者10、20、50 mg/mL浓度),个别水溶性高的产品可直接溶于水。产品在DMSO 、水或其他溶剂中的具体溶解度详见上”溶解度 (体外)”部分;
2、如果您找不到您想要的溶解度信息,或者很难将产品溶解在溶液中,请联系我们;
3、建议使用下列计算器进行相关计算(摩尔浓度计算器、稀释计算器、分子量计算器、重组计算器等);
4、母液配好之后,将其分装到常规用量,并储存在-20°C或-80°C,尽量减少反复冻融循环。
计算结果:
工作液浓度: mg/mL;
DMSO母液配制方法: mg 药物溶于 μL DMSO溶液(母液浓度 mg/mL)。如该浓度超过该批次药物DMSO溶解度,请首先与我们联系。
体内配方配制方法:取 μL DMSO母液,加入 μL PEG300,混匀澄清后加入μL Tween 80,混匀澄清后加入 μL ddH2O,混匀澄清。
(1) 请确保溶液澄清之后,再加入下一种溶剂 (助溶剂) 。可利用涡旋、超声或水浴加热等方法助溶;
(2) 一定要按顺序加入溶剂 (助溶剂) 。