| 规格 | 价格 | ||
|---|---|---|---|
| 500mg | |||
| 1g | |||
| Other Sizes |
| 靶点 |
PKA (EC50 = 360 nM); cAMP analog
|
|---|---|
| 体外研究 (In Vitro) |
Sp-8-Br-cAMPS (0-100 nM) 可抑制嗜线虫病菌 (X. nematophila) 和枯草芽孢杆菌 (B. subtilis) 的吞噬作用,但不影响每种血细胞类型的细菌数量[1]。Sp-8-Br-cAMPS (0-1000 μM) 剂量依赖性地通过激活 PKA 抑制葡萄球菌肠毒素 B (SEB) 诱导的 T 细胞活化和细胞因子 IFN-γ、TNF-α、IL-2 和 IL-4 的表达[2]。
PKA激活剂以浓度依赖的方式严重损害了嗜线虫X.的吞噬作用(图3a),而枯草芽孢杆菌的抑制作用仅在高浓度下发生(图3b)。附着任何一种细菌的颗粒细胞水平也降低了。尽管嗜线虫X.的浆细胞水平下降,但枯草芽孢杆菌的水平没有变化。酶激活剂不影响每种血细胞类型的细菌数量(X.嗜线虫:对照,1.7±0.3个细菌/浆细胞,2.1±0.3个菌/颗粒细胞;100 nmol/LSp-8-Br-cAMPS,1.3±0.2个细菌/血浆细胞,1.9±0.3个杆菌/颗粒细胞[P>0.05];枯草芽孢杆菌:对照,2.0±0.4个细菌/血细胞,1.7±0.3/颗粒细胞,100 nmol/L Sp-8-Br cAMPS,1.4±0.3个菌株/浆细胞、1.2±0.2个菌/粒细胞[P>0.05])。然而,检测到每种血细胞类型的细菌数量持续下降。将血细胞与50 nmol/L PKA激活剂和越来越多的PKA抑制剂共同孵育,可以提高两种细菌的颗粒细胞和浆细胞水平(图4)。[1] PKA调节剂本身会影响血细胞蛋白的释放。酶抑制剂浓度的增加会增加蛋白质的释放,而激活剂浓度的增加则会损害蛋白质的释放(图5b)。Rp-8-Br-cAMPS抵消了PKA激活剂Sp-8-Br-McAMPS对蛋白质释放的抑制。[1] cAMP和PKA I型抑制SEB诱导的T细胞活化和IFN-γ的表达[2] 为了探索cAMP和PKA I型对免疫激活早期功能事件的可能影响,我们在用超抗原SEB激活PBMC 6小时后测量了激活标志物CD69的表达和IFN-γ的产生。在PKA激动剂单独存在或不存在的情况下,通过流式细胞术测量CD69和IFN-α的表达。将细胞与cAMP类似物预孵育1小时,以使化合物扩散,然后用SEB激活。然后在用SEB激活后1小时加入布雷菲尔丁A,并将培养物孵育5小时以积累细胞因子。 与对照组相比,CD3+T细胞中CD69和IFN-γ的表达在与250μMSp-8-Br-cAMPS(激动剂)预孵育后显著降低(图1,a和b)。为了阐明这种抑制的细胞因子产生是通过与TCR/CD3和脂筏相关的PKA I型还是PKA II型介导的,PKA II的定位主要局限于淋巴细胞的核周和高尔基中心体区域(17),我们用250μM Sp-8-Br-cAMPS与1000μM PKA I类选择性拮抗剂Rp-8-Br-cAMPS联合预孵育细胞(图1,c)。拮抗剂几乎完全逆转了激动剂的抑制作用,表明cAMP在早期T细胞活化中的抑制作用主要是由于PKA I型的活化。拮抗剂单独对CD69和IFN-γ的表达没有影响(图1d)。 cAMP和PKA I型的抑制作用不是由于细胞凋亡[2] 为了研究cAMP和PKA I型的抑制作用是否是由于诱导凋亡引起的,我们通过流式细胞术在正向和侧向散射上评估了未刺激和SEB刺激的PBMC在与1000μM Sp-8-Br-cAMPS预孵育和未与布雷菲丁A预孵育的最后5小时的形态。将培养物孵育6至48小时的不同时间段,在cAMP类似物存在的情况下,没有表现出凋亡的形态学变化特征,前向散射减少,侧向散射增加(数据未显示)。此外,在相同的实验条件下,还通过Annexin VFITC标记评估了细胞凋亡(图2显示了培养24小时)。cAMP激动剂在静息(图2,a和b)或活化培养物(图2、c和d)中没有诱导膜联蛋白V结合作为凋亡细胞标志的任何显著增加。相比之下,用作对照的茴香霉素(图2,e和f)在未刺激和活化的培养物中诱导了细胞凋亡并增加了膜联蛋白V的结合。通过碘化丙啶排除法获得了类似的数据(数据未显示)。 cAMP和PKA I型抑制SEB诱导的IFN-γ、TNF-α、IL-2和IL-4[2] 为了检查cAMP和PKA I型对IFN-γ表达的影响是否是特异性的,我们测量了在SEB激活PBMC后,随着Sp-8-Br-cAMPS浓度的增加,各种细胞因子的表达。我们发现,cAMP类似物以浓度依赖的方式降低了所有检测到的细胞因子(IFN-γ、TNF-α、IL-2和IL-4)的表达(图3a),尽管cAMP类似物对抑制的敏感性因细胞因子而异。在所有情况下,cAMP介导的抑制作用可被PKA I型选择性拮抗剂Rp-8-Br-cAMPS逆转。接下来,我们测量了细胞因子积累期较长时细胞因子表达的抑制水平,以观察这种作用是否是短暂的。进行了5、15和25小时的累积期,在所有这些时间点,抑制水平都是持续的,并且具有浓度依赖性(数据未显示)。 cAMP和PKA I型独立于APC抑制CD4和CD8 T细胞活化[2] 为了进一步解决cAMP在抑制免疫激活中影响哪个T细胞室的问题,我们研究了cAMP和PKA I型对CD4和CD8 T细胞的影响。如图5、a和b所示,IFN-γ和TNF-α的表达均以浓度依赖的方式受到抑制。然而,该实验是在含有APC的PBMC的SEB刺激下进行的。为了消除观察到的效应可能是由于cAMP对APC功能的抑制作用造成的可能性,我们通过粘附分离APC,用SEB装载细胞,然后用多聚甲醛固定。然后,我们以1:10的比例建立了与固定的载银APC和APC耗竭的PBMC群体的自体共培养。在加入布雷菲尔丁A之前,将共培养物孵育6小时。允许细胞因子积累14小时。通过细胞内流式细胞术评估CD4和CD8 T细胞中IFN-γ的表达,观察到细胞因子表达的浓度依赖性抑制,随着Sp-8-Br-cAMPS浓度的增加,这表明抑制作用与APC无关(图5c)。 细胞因子表达和增殖的联合抑制[2] 为了进一步确定cAMP介导的免疫功能抑制的程度,我们通过CFSE稀释试验研究了对CD3、CD4和CD8 T细胞增殖的影响。如图6a所示,在所有三个细胞群中,随着Sp-8-Br-cAMPS浓度的增加,SEB诱导的增殖呈浓度依赖性下降。PKA I型选择性拮抗剂Rp-8-Br-cAMPS的抑制是可逆的(数据未显示)。 通过将CFSE稀释试验与细胞内流式细胞术相结合,我们同时测量了cAMP对两种免疫功能的影响。如图6b所示,每个细胞分裂的CFSE荧光强度依次降低,表达IFN-γ的T细胞比例最高的是后代细胞。随着Sp-8-Br-cAMPS浓度的增加,IFN-γ表达显著降低,增殖受到明显抑制,表现为1000μM Sp-8-Br cAMPS的最后两次细胞分裂消失。 cAMP和PKA I型抑制Ag特异性免疫反应[2] 接下来,我们研究了cAMP和PKA I型对Ag特异性免疫反应的影响(图7a)。如SEB诱导的免疫反应所示,我们观察到,通过增加CD4和CD8 T细胞群中Sp-8-Br-cAMPS的浓度,CMV诱导的IFN-γ表达受到浓度依赖性抑制。为了诱导最佳刺激,CD4 T细胞群被CMV感染的细胞提取物刺激,而CD8 T细胞群则被CMVpp65刺激。两种细胞群的抑制范围均为60%至80%。 我们还通过结合CFSE稀释试验和细胞内流式细胞术,研究了PKA I型激活对结核菌素PPD诱导的T细胞增殖和IFN-γ产生的影响(图7b)。正如SEB和CMV诱导的免疫反应所观察到的那样,结核菌素PPD诱导的T细胞增殖和IFN-γ表达以浓度依赖的方式下降,Sp-8-Br-cAMPS。此外,cAMP拮抗剂Rp-8-Br-cAMPS可完全逆转T细胞增殖和IFN-γ表达(数据未显示)。 cAMP激活Csk[2] 为了评估本研究中使用的cAMP激动剂对先前绘制的cAMP-PKA抑制T细胞功能的机制的影响(11),我们检查了Sp-8-Br-cAMPS是否会导致Csk活性的增加。在用cAMP类似物处理浓度增加后,体外评估了Csk磷酸转移酶活性,导致Csk活性呈浓度依赖性增加,使用最高浓度时活性增加了2倍以上(图8)。 |
| 体内研究 (In Vivo) |
Sp-8-Br-cAMPS (50 nM) 可抑制血细胞释放蛋白质,抑制细菌从血淋巴中清除,但不影响 G. mellonella 幼虫的活力 [1]。
单独注射Sp-8-Br-cAMPS后30分钟内,与PBS对照幼虫相比,总血细胞计数增加,而PKA抑制剂降低了血细胞水平(图7)。在含有抑制剂的昆虫中观察到结节(直径1.2±0.1mm)和广泛的血细胞聚集(2×105/mL),但在含有激活剂的组中没有。增加抑制剂的量会降低含有固定量PKA激活剂的幼虫的血细胞计数。 |
| 酶活实验 |
PKA生化测定[1]
为了确定PKA调节剂影响PKA活性以及PKA活性在血细胞粘附过程中发生变化,使用了PKA生化测定。将冷冻幼虫放血,并将180µL血淋巴加入200µL抗凝剂中23。将200微升血细胞悬浮液离心(200 g,2分钟,4°C),通过离心将血细胞沉淀在100µL PBS中洗涤两次。将第一组颗粒重新悬浮在20µL PBS中,PBS中含有选定量的Rp-8-Br-cAMPS和/或Sp-8-Br-cAMPS。孵育30分钟后,在1 mL PBS中离心三次洗涤细胞,通过剧烈移液溶解,并根据制造商的说明测定PKA活性。将第二组血细胞放置在含有玻璃盖玻片(直径5mm)的96孔微量滴定板中。为了防止血细胞粘附引起PKA活性的可能变化,立即裂解血细胞作为非附着血细胞对照组。在室温下孵育30分钟后,其他孔中主要代表粘附血细胞的细胞被裂解。测定两组PKA活性。四个重复中的每一个至少使用两个样品。 Csk活性评估[2] 纯化的外周T细胞(RPMI 1640中为40×106个细胞/ml)在37°C下孵育30分钟,加入或不加入指定浓度的cAMP类似物Sp-8-Br-cAMPS。此后,将细胞在裂解缓冲液(50 mM HEPES(pH 7.4)、100 mM NaCl、5 mM EDTA、1%Triton X-100、50 mM n-β-辛基葡萄糖苷、10 mM NaPPi、1 mM Na3VO4、50 mM NaF和1 mM PMSF)中破碎,并用抗Csk Ab进行免疫沉淀。在4°C下孵育过夜后,加入蛋白A-Sepharose并继续孵育1小时。免疫复合物在裂解缓冲区中洗涤三次,在Csk激酶测定缓冲液(50mM HEPES和5mM MgCl2,pH 7.4)中洗涤三倍,然后进行Csk激酶分析和Western blot分析。人Csk的酪氨酸激酶活性是通过将[32P]磷酸盐掺入合成的聚氨基酸聚(Glu,Tyr)4:1中来测量的。遵循标准方案,反应体积为50μl,含有HEPES缓冲液(pH 7.4)、5 mM MgCl2、200μM[γ-32P]ATP(0.15 Ci/mmol)、200μg/ml聚(Glu,Tyr)和免疫沉淀的Csk。孵育温度为30°C,孵育时间为12分钟。 |
| 细胞实验 |
细菌吞噬作用和血细胞与相关细菌[1]
通过将从总共六只在冰上冷却(15分钟)的幼虫中收集的60µL昆虫血淋巴加入1 mL冰冷的PBS(1.6×106个血细胞/mL)中制备血细胞单层。除非另有说明,否则血细胞不会被洗掉血浆,这样它们更接近体内情况。将15微升悬浮液置于无内毒素载玻片上,在相对湿度>95%的条件下孵育30分钟,使血细胞粘附。通过用2mL PBS冲洗载玻片三次来去除未附着的血细胞。将含有和不含选定浓度PKA调节剂(PKA激活剂Sp-8-Br-cAMPS;PKA I型抑制剂RP-8-Br-cAMPS27)的PBS中的荧光细菌添加到单层中,使细菌与血细胞的比例为10:1。将载玻片在高湿度下摇动(25 r.p.m.)1小时,然后用PBS冲洗三次,去除未附着的细菌。用台盼蓝(0.2%w/v28)淬灭非吞噬细菌的荧光。将带有细菌的血细胞在戊二醛-甲醛蒸汽中固定10分钟,并用PBS中的甘油(20%v/v)固定。必要时,血细胞被鉴定为颗粒细胞或浆细胞29。通过荧光显微镜测定总吞噬血细胞和浆细胞的水平(以总血细胞和总浆细胞的百分比表示)。使用相差显微镜测定每种附着细菌的血细胞类型的数量(附着包括吞噬细菌和血细胞表面的细菌)和每种血细胞类型附着细菌的数量。在包含10个样本的10个重复中,每个重复检查至少150个每种类型的血细胞。 血细胞蛋白排出量[1] 通过在冰上冷却10只幼虫(15分钟)并在1毫升冷冻抗凝剂中收集75µL血淋巴,获得不含血淋巴血浆的血细胞。通过离心洗涤血细胞三次,以去除血浆和抗凝剂(200g,2分钟)。然后将沉淀物重新悬浮在冷PBS(5°C,1 mL)中。将血细胞悬浮液(100µL)加入96孔微量滴定板的孔中,该微量滴定板含有圆形(直径5mm)玻璃盖玻片和PBS,含有和不含有选定浓度的Rp-8-Br-cAMPS和Sp-8-Br-cAMPS,或含有固定水平的激活剂和10和50 nmol/L的抑制剂。其他孔含有缓冲液和PKA调节剂,这两种细菌产生10:1的细菌:血细胞比。含有和不含酶调节剂的细菌作为无血细胞对照。将板在22°C下孵育15-60分钟,在此期间通过移液移取样品并离心(2000 g,2分钟)。测定上清液中的总蛋白。在整个培养过程中使用了10个重复,每个重复包含两个样本。 |
| 动物实验 |
PKA modulators in vivo [1]
Five replicates containing two groups of 10 larvae were injected at the base of the prothoracic leg with 10 µL PBS containing selected levels of Sp-8-Br-cAMPS and/or Rp-8-Br-cAMPS. The insects of one group were bled 30 min after injection, and the total haemocyte counts per individual were determined on a haemocytometer. Gross dissection was done on the remaining group 24 h after injection to detect nodules. The effects of the PKA modulators on the removal of B. subtilis and X. nematophila were similarly assessed with all test solutions containing 1 × 108 bacteria per 10 µL. Both bacterial and haemocyte levels were determined on a haemocytometer. |
| 参考文献 | |
| 其他信息 |
We used the protein kinase A (PKA) specific activator Sp-8-Br-cAMPS and type I inhibitor Rp-8-Br-cAMPS alone and in combination to define the role of PKA in the non-self responses of larval Galleria mellonella haemocytes in vitro and in vivo. Active PKA depressed haemocyte responses whereas PKA inhibition enhanced activities, including bacterial phagocytosis, the number of haemocytes with adherent bacteria, bacterial-induced haemocytic protein release and haemocyte adhesion to slides in vitro, as well as in vivo bacterial removal from the haemolymph. Non-attached haemocytes had more PKA activity than attached haemocytes; therefore, active PKA limited haemocyte response to foreign materials. We found that (i) PKA inhibitor alone induced non-self responses, including haemocyte protein discharge and lowered haemocyte counts in vivo, and induced nodulation; (ii) the enzyme activator produced effects opposite to those of the inhibitor; and (iii) together, the modulators offset each others' effects and influenced haemocyte lysate PKA activity. These findings establish PKA as a mediator of haemocytic non-self responses. [1]
cAMP inhibits biochemical events leading to T cell activation by triggering of an inhibitory protein kinase A (PKA)-C-terminal Src kinase pathway assembled in lipid rafts. In this study, we demonstrate that activation of PKA type I by Sp-8-bromo-cAMPS (a cAMP agonist) has profound inhibitory effects on Ag-specific immune responses in peripheral effector T cells. Activation of PKA type I inhibits both cytokine production and proliferative responses in both CD4(+) and CD8(+) T cells in a concentration-dependent manner. The observed effects of cAMP appeared to occur endogenously in T cells and were not dependent on APC. The inhibition of responses was not due to apoptosis of specific T cells and was reversible by a PKA type I-selective cAMP antagonist. This supports the notion of PKA type I as a key enzyme in the negative regulation of immune responses and a potential target for inhibiting autoreactive T cells. [2] We and others have shown that cAMP and PKA type I act as an acute inhibitor of TCR/CD3 signaling on the molecular level. In this study, we present data showing that cAMP through activation of PKA type I is a universal inhibitor of T cell function. Preincubation with Sp-8-Br-cAMPS inhibited Ag-induced expression of IFN-γ, TNF-α, IL-2, and IL-4 in a dose-dependent manner. The inhibition involved both CD4 and CD8 T cells, and the effect was independent of APC and did not induce apoptosis. Furthermore, the cAMP analog inhibited both SEB-induced proliferation and Ag-specific immune responses to CMV and tuberculin PPD. Coincubation with Rp-8-Br-cAMPS, which is a selective inhibitor of PKA type I, completely reversed the inhibitory effect of the PKA agonist Sp-8-Br-cAMPS. This indicates that the effects observed are due to activation of PKA type I and that inhibition of T cell function following cAMP incubation can be reversed in a timely manner with a cAMP antagonist.[2] |
| 分子式 |
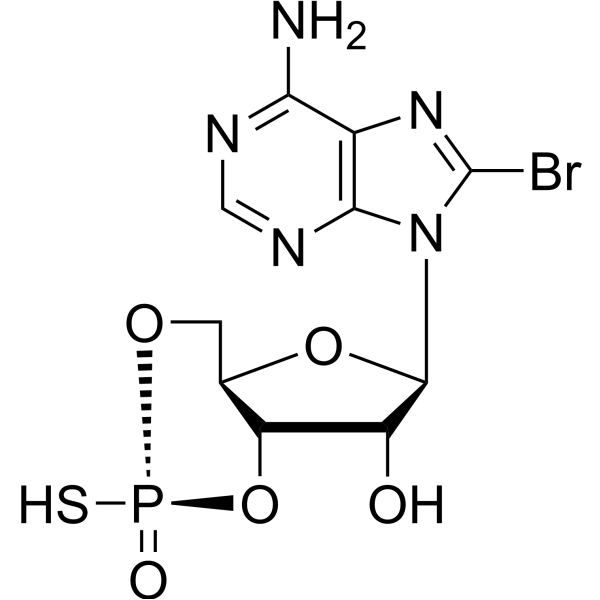
C10H11BRN5O5PS
|
|---|---|
| 分子量 |
424.17
|
| 精确质量 |
444.922
|
| CAS号 |
127634-20-2
|
| PubChem CID |
24757345
|
| 外观&性状 |
Typically exists as solid at room temperature
|
| LogP |
1.731
|
| tPSA |
182.5
|
| 氢键供体(HBD)数目 |
2
|
| 氢键受体(HBA)数目 |
10
|
| 可旋转键数目(RBC) |
1
|
| 重原子数目 |
24
|
| 分子复杂度/Complexity |
542
|
| 定义原子立体中心数目 |
4
|
| SMILES |
C1[C@@H]2[C@H]([C@H]([C@@H](O2)N3C4=NC=NC(=C4N=C3Br)N)O)OP(=S)(O1)[O-].[Na+]
|
| InChi Key |
SKJLJCVVXRNYGJ-QKAIHBBZSA-M
|
| InChi Code |
InChI=1S/C10H11BrN5O5PS.Na/c11-10-15-4-7(12)13-2-14-8(4)16(10)9-5(17)6-3(20-9)1-19-22(18,23)21-6;/h2-3,5-6,9,17H,1H2,(H,18,23)(H2,12,13,14);/q;+1/p-1/t3-,5-,6-,9-,22?;/m1./s1
|
| 化学名 |
sodium;(4aR,6R,7R,7aS)-6-(6-amino-8-bromopurin-9-yl)-2-oxido-2-sulfanylidene-4a,6,7,7a-tetrahydro-4H-furo[3,2-d][1,3,2]dioxaphosphinin-7-ol
|
| 别名 |
129735-00-8; 127634-20-2; 8-Bromoadenosine 3',5'-cyclic monophosphorothioate, Rp-isomer sodium salt; 8-Bromoadenosine 3',5'-cyclic monophosphorothioate, Sp-isomer sodium salt; 8-BROMOADENOSINE-3',5'-CYCLIC MONOPHOSPHOROTHIOATE, SP-ISOMER SODIUM SALT; Sp-8-Br-cAMPS*Na; 8-Br-cAMPS*Na Sp-isomer; YMC11590;
|
| HS Tariff Code |
2934.99.9001
|
| 存储方式 |
Powder -20°C 3 years 4°C 2 years In solvent -80°C 6 months -20°C 1 month |
| 运输条件 |
Room temperature (This product is stable at ambient temperature for a few days during ordinary shipping and time spent in Customs)
|
| 溶解度 (体外实验) |
May dissolve in DMSO (in most cases), if not, try other solvents such as H2O, Ethanol, or DMF with a minute amount of products to avoid loss of samples
|
|---|---|
| 溶解度 (体内实验) |
注意: 如下所列的是一些常用的体内动物实验溶解配方,主要用于溶解难溶或不溶于水的产品(水溶度<1 mg/mL)。 建议您先取少量样品进行尝试,如该配方可行,再根据实验需求增加样品量。
注射用配方
注射用配方1: DMSO : Tween 80: Saline = 10 : 5 : 85 (如: 100 μL DMSO → 50 μL Tween 80 → 850 μL Saline)(IP/IV/IM/SC等) *生理盐水/Saline的制备:将0.9g氯化钠/NaCl溶解在100 mL ddH ₂ O中,得到澄清溶液。 注射用配方 2: DMSO : PEG300 :Tween 80 : Saline = 10 : 40 : 5 : 45 (如: 100 μL DMSO → 400 μL PEG300 → 50 μL Tween 80 → 450 μL Saline) 注射用配方 3: DMSO : Corn oil = 10 : 90 (如: 100 μL DMSO → 900 μL Corn oil) 示例: 以注射用配方 3 (DMSO : Corn oil = 10 : 90) 为例说明, 如果要配制 1 mL 2.5 mg/mL的工作液, 您可以取 100 μL 25 mg/mL 澄清的 DMSO 储备液,加到 900 μL Corn oil/玉米油中, 混合均匀。 View More
注射用配方 4: DMSO : 20% SBE-β-CD in Saline = 10 : 90 [如:100 μL DMSO → 900 μL (20% SBE-β-CD in Saline)] 口服配方
口服配方 1: 悬浮于0.5% CMC Na (羧甲基纤维素钠) 口服配方 2: 悬浮于0.5% Carboxymethyl cellulose (羧甲基纤维素) 示例: 以口服配方 1 (悬浮于 0.5% CMC Na)为例说明, 如果要配制 100 mL 2.5 mg/mL 的工作液, 您可以先取0.5g CMC Na并将其溶解于100mL ddH2O中,得到0.5%CMC-Na澄清溶液;然后将250 mg待测化合物加到100 mL前述 0.5%CMC Na溶液中,得到悬浮液。 View More
口服配方 3: 溶解于 PEG400 (聚乙二醇400) 请根据您的实验动物和给药方式选择适当的溶解配方/方案: 1、请先配制澄清的储备液(如:用DMSO配置50 或 100 mg/mL母液(储备液)); 2、取适量母液,按从左到右的顺序依次添加助溶剂,澄清后再加入下一助溶剂。以 下列配方为例说明 (注意此配方只用于说明,并不一定代表此产品 的实际溶解配方): 10% DMSO → 40% PEG300 → 5% Tween-80 → 45% ddH2O (或 saline); 假设最终工作液的体积为 1 mL, 浓度为5 mg/mL: 取 100 μL 50 mg/mL 的澄清 DMSO 储备液加到 400 μL PEG300 中,混合均匀/澄清;向上述体系中加入50 μL Tween-80,混合均匀/澄清;然后继续加入450 μL ddH2O (或 saline)定容至 1 mL; 3、溶剂前显示的百分比是指该溶剂在最终溶液/工作液中的体积所占比例; 4、 如产品在配制过程中出现沉淀/析出,可通过加热(≤50℃)或超声的方式助溶; 5、为保证最佳实验结果,工作液请现配现用! 6、如不确定怎么将母液配置成体内动物实验的工作液,请查看说明书或联系我们; 7、 以上所有助溶剂都可在 Invivochem.cn网站购买。 |
| 制备储备液 | 1 mg | 5 mg | 10 mg | |
| 1 mM | 2.3575 mL | 11.7877 mL | 23.5755 mL | |
| 5 mM | 0.4715 mL | 2.3575 mL | 4.7151 mL | |
| 10 mM | 0.2358 mL | 1.1788 mL | 2.3575 mL |
1、根据实验需要选择合适的溶剂配制储备液 (母液):对于大多数产品,InvivoChem推荐用DMSO配置母液 (比如:5、10、20mM或者10、20、50 mg/mL浓度),个别水溶性高的产品可直接溶于水。产品在DMSO 、水或其他溶剂中的具体溶解度详见上”溶解度 (体外)”部分;
2、如果您找不到您想要的溶解度信息,或者很难将产品溶解在溶液中,请联系我们;
3、建议使用下列计算器进行相关计算(摩尔浓度计算器、稀释计算器、分子量计算器、重组计算器等);
4、母液配好之后,将其分装到常规用量,并储存在-20°C或-80°C,尽量减少反复冻融循环。
计算结果:
工作液浓度: mg/mL;
DMSO母液配制方法: mg 药物溶于 μL DMSO溶液(母液浓度 mg/mL)。如该浓度超过该批次药物DMSO溶解度,请首先与我们联系。
体内配方配制方法:取 μL DMSO母液,加入 μL PEG300,混匀澄清后加入μL Tween 80,混匀澄清后加入 μL ddH2O,混匀澄清。
(1) 请确保溶液澄清之后,再加入下一种溶剂 (助溶剂) 。可利用涡旋、超声或水浴加热等方法助溶;
(2) 一定要按顺序加入溶剂 (助溶剂) 。