| 规格 | 价格 | 库存 | 数量 |
|---|---|---|---|
| 10 mM * 1 mL in DMSO |
|
||
| 1mg |
|
||
| 2mg |
|
||
| 5mg |
|
||
| 10mg |
|
||
| 25mg |
|
||
| 50mg |
|
||
| 100mg |
|
||
| 250mg |
|
||
| 500mg |
|
||
| 1g | |||
| Other Sizes |
| 靶点 |
JAK2; STAT3
|
||
|---|---|---|---|
| 体外研究 (In Vitro) |
WP10666 以剂量依赖性方式极大地抑制了 HEL 细胞的增殖。 2.3 μM 是抑制 HEL 细胞生长的 IC50 值。当 WP1066 存在时,具有 JAK2 V617F 突变同工型的人类 HEL 细胞无法增殖 [1]。当WP1066用于阻断p-STAT3时,CTX对肿瘤的细胞毒作用增强。在 B16 细胞上,WP1066 的 IC50 剂量为 2.43 μM (0.865 μg/mL)[2]。在高浓度下,WP1066 抑制正常 BM 祖细胞的生长,抑制 AML 母细胞集落形成细胞的增殖,并抑制 AML 集落形成细胞的增殖 [3]。
WP1066显著抑制JAK2及其下游转录-3信号转导和激活因子、转录-5信号转导和激活因子以及细胞外信号调节的激酶-1/2通路,并呈剂量和时间依赖性。结果表明,低微摩尔浓度的WP1066对HEL细胞具有时间和剂量依赖性的抗增殖和促凋亡作用。正如预期的那样,WP1066以剂量依赖的方式抑制携带JAK2 V617F突变的真性红细胞增多症患者外周血造血祖细胞的增殖。 结论:我们的数据表明,WP1066在体外和离体均具有活性,应进一步开发用于治疗表达JAK2 V617F突变的肿瘤。[1] WP1066阻断p-STAT3可增强CTX对肿瘤的细胞毒作用[2] 为了确定CTX和WP1066是否对肿瘤的直接细胞毒性有累加作用,我们分别和联合对黑色素瘤细胞系B16进行了IC50评估。WP1066和CTX对B16细胞的IC50剂量分别为2.43µM(0.865µg/ml)和4.04 mM (1.128 mg/ml)。使用IC50剂量的WP1066(2µM),添加CTX增强肿瘤细胞毒性(图1A)。B16具有p-STAT3的组成激活(图1B)和诱导活性36。为了确定CTX是否与WP1066对p-STAT3的抑制产生叠加效应,我们将B16细胞培养在WP1066、CTX或两者均存在或不存在的情况下,并通过Western blot分析评估p-STAT3、总STAT3和β-actin的水平。在B16细胞中,WP1066对p-STAT3的抑制作用在CTX的作用下呈剂量依赖性增强。具体来说,0.75或2.5 mg/ml的CTX与2.5µM的WP1066联合使用对pSTAT3的抑制作用与单独使用5µM的WP1066相似。这表明CTX可以与WP1066联合增强对p-STAT3的抑制,但在这些剂量下不能直接抑制p-STAT3(图1B)。 由于(E)-3(6-溴吡啶-2-基)-2-氰- n- ((s0 -1-苯乙基)丙烯酰胺)(WP1066)是JAK2抑制剂AG490的新型类似物,我们测试了其在AML细胞中的活性并研究了其作用机制。通过克隆实验,我们发现尽管WP1066对正常骨髓祖细胞有边际作用,但它抑制了从新诊断的AML患者获得的AML集落形成细胞以及AML细胞系OCIM2和K562的增殖。WP1066通过诱导细胞在细胞周期的G0-G1期积累来抑制OCIM2细胞的增殖。与亲本化合物AG490相似,WP1066抑制JAK2的磷酸化,但与AG490不同的是,WP1066也降解JAK2蛋白,从而阻断其下游信号转导和转录激活因子(STAT)和磷酸肌醇-3激酶途径。这些作用导致了半胱天冬酶途径的激活。WP1066在OCIM2和K562细胞中激活caspase-3,诱导聚adp -核糖聚合酶裂解,引起caspase依赖性凋亡细胞死亡。因此,WP1066是一种有效的JAK2抑制剂,其在AML和其他血液系统恶性肿瘤中的作用值得进一步研究。[3] |
||
| 体内研究 (In Vivo) |
在肿瘤微环境中,WP1066 (30 mg/kg, og) 对 CTX 诱导的 p-STAT3 通路抑制具有累加效应 [2]。
WP1066不能进一步增强环磷酰胺对肺黑色素瘤病变的治疗作用[2] 为了确定CTX和WP1066是否对肺内黑色素瘤具有累加性疗效,在患有肺黑色素瘤的C57BL/6J小鼠中单独或联合使用节律性CTX (o.g)、细胞毒性CTX (i.p)或WP1066 (o.g)。为了观察STAT3抑制和CTX的叠加效应,使用了亚治疗剂量(30 mg/kg)的WP1066。未处理荷瘤小鼠黑色素瘤病变数为26.8±11.3个。虽然经WP1066亚治疗剂量处理的小鼠肺部病变的发展与未处理的小鼠之间没有统计学差异(33±16.1)(P> 0.05),但以节拍器和细胞毒方法给药的CTX与对照组相比减少了肺病变的数量(7±3.5 P= 0.049和0.7±0.6;P= 0.01)。使用细胞毒性CTX剂量比使用节拍性CTX剂量对黑色素瘤病变数量的减少更为显著(P= 0.03)。然而,与单独使用节拍(7.8±3.6)或细胞毒性(0.5±0.6)CTX剂量的组相比,联合治疗组没有观察到加性效应(图2)。 WP1066确实增强了环磷酰胺对中枢神经系统黑色素瘤的治疗效果[2] 为了确定节拍器CTX剂量和WP1066联合治疗是否对已建立的中枢神经系统肿瘤产生附加益处,采用先前描述的方法治疗脑内B16的C57BL/6J小鼠。用WP1066对照或PBS治疗的荷瘤小鼠的中位总生存时间为16天(范围:13-21天;n = 10)。单独使用亚治疗性WP1066剂量未观察到中位生存时间(15天;范围:10-18天;n = 7;P= 0.29)或单独给药(18天;范围17-36天;n = 10;P= 0.1)。中位总生存期21天(范围17-75天;n=10),与对照组小鼠(P=0.004)和单独使用WP1066治疗的小鼠(P<0.0001)相比,与单独使用节拍器CTX治疗的小鼠(P= 0.13)相比,这一差异具有统计学意义(图3A)。 接下来,我们确定了细胞毒性CTX剂量与WP1066联合使用的效果。用WP1066对照或PBS治疗的荷瘤小鼠的中位总生存时间为17天(范围:13-17天;n = 9)。单独使用亚治疗性WP1066剂量未观察到中位生存时间的改善(17.5天;范围:14-21天;n = 8;P = 0.10)。与对照相比,细胞毒性CTX单药治疗显著提高了生存期(32天;范围:24-108天;P < 0.0001)。用亚治疗性WP1066剂量和细胞毒性CTX剂量治疗脑内黑色素瘤小鼠的中位生存时间为120天(范围:26-127天;n=7),明显长于单独使用细胞毒性CTX剂量(P= 0.03)、WP1066 (P=0.0001)和对照组(P=0.0002)的小鼠(图3B)。在WP1066和细胞毒性CTX联合治疗的小鼠中,57%的小鼠长期存活,当实验终止进行肿瘤再攻毒实验时,与单独使用细胞毒性CTX组相比,中位生存时间至少增加了375%。在死亡时,中枢神经系统尸检显示,治疗组之间的肿瘤负荷没有显著差异。死亡通常继发于B16肿瘤的脑膜外扩散和继发脑积水。这将阻止测量肿瘤大小和收集Western Blot分析。 为了确定WP1066和细胞毒性或定时剂量的CTX治疗的小鼠脑肿瘤是否能够产生持久的保护性免疫记忆,将B16细胞植入小鼠的对侧半球。再攻毒后,将亚治疗性WP1066剂量与节律性或细胞毒性CTX剂量联合治疗的小鼠的中位生存时间分别为17天和21天,与naïve对照组小鼠的中位生存时间没有显著差异。各治疗组脑内再挑战实验后均未见持久免疫。 WP1066不能进一步增强CTX 免疫介导的细胞毒作用[2] 为了确定是否存在与联合治疗的体内疗效相关的免疫肿瘤细胞毒性增强,我们评估了针对B16黑色素瘤细胞的免疫细胞毒性反应。用WP1066处理的非荷瘤小鼠和荷瘤小鼠的脾细胞,节律性(g。)CTX剂量,细胞毒性(p)给CTX或WP1066与CTX联合分离,与cfse标记的B16靶细胞共培养48小时,以评估对B16细胞的免疫细胞毒性。与非荷瘤对照组相比,荷瘤小鼠免疫介导的细胞毒性降低了37% (P =0.008)。WP1066、定时CTX和细胞毒性CTX分别使荷瘤小鼠的CD3+ T细胞、自然杀伤细胞(NK)细胞和NKT细胞(脾细胞)的细胞毒清除率比荷瘤小鼠分别提高30%、77%和69% (P = 0.05、P= 0.001和P= 0.006)。然而,与单药治疗相比,WP1066与节拍剂或细胞毒性CTX联合治疗并没有显著增强免疫介导的B16靶细胞的细胞毒性清除(图4A)。 WP1066不能进一步调节CTX对免疫细胞群的影响[2] 测定节拍器(ogg)在体内的作用。CTX剂量,细胞毒性(p)CTX给药、WP1066给药以及联合治疗对荷瘤小鼠CD8+、CD4+和CD4+Foxp3+ treg数量的影响,按上述方法治疗14天。与对照荷瘤小鼠相比,节拍CTX剂量增加了CD8+ (P= 0.007)(图4B)和CD4+ T细胞(P= 0.04)(图4C)的数量,抑制了CD4细胞室内treg的数量(P<0.05)(图4D)。节律给药CTX和亚治疗性WP1066联合给药并没有进一步增加CD8+(图4B)或CD4+ T细胞(图4C)的数量,也没有进一步抑制外周血中CD4+FoxP3+ Tregs的数量(P >.05)(图4D)。相比之下,与荷瘤小鼠相比,细胞毒性CTX剂量显著抑制CD8+ T细胞(P< 0.0001)(图4B), CD4+ T细胞(P= 0.0005)(图4C)和CD4+FoxP3+ Tregs (P=0.0004)(数据未显示),并且WP1066没有进一步调节(P> 0.05)。 WP1066对肿瘤微环境中CTX抑制p-STAT3通路具有加性作用[2] 为了阐明为什么CTX与WP1066在中枢神经系统黑色素瘤的疗效实验中存在叠加效应,但其程度远低于肺部,我们研究了局部肿瘤微环境中pSTAT3的水平及其在联合治疗中的调节。采用免疫组织化学方法检测各组黑色素瘤核内p-STAT3的表达,并以p-STAT3阳性细胞的百分比表示。细胞质黑色素的存在不包括在分析中。在对照小鼠的中枢神经系统黑色素瘤中,p-STAT3的表达量为12.7±2.3%(范围2.8-21.8%;N = 8)。这一比例降至9.2±2.8%(范围2.3-18.7%;N = 9;P=0.170)。节拍器CTX不影响p-STAT3表达12.7±3.7%(范围4.6-37.2%;n = 8) p-STAT3表达。在细胞毒性CTX治疗的CNS肿瘤小鼠中,p-STAT3水平为4.5±1.2%(范围1.9-10.7%;N = 7;P=0.011),联合WP1066进一步降低至2.3±0.8%(范围0-6.5%;N = 7;P=0.001)(图5A)。与此形成鲜明对比的是,在对照组,已建立的肺黑色素瘤中,p-STAT3的表达较低,为2.4±0.6%(范围0-3.7%;N = 5)。亚治疗性WP1066和节律性CTX治疗小鼠为2.0±0.4%(范围1.4-2.7%;N = 4)和1.7±0.7%(范围0.8-3%;n =5) p-STAT3表达。在肺肿瘤模型中,除了p-STAT3已经处于低水平之外,WP1066的加入并未对CTX在调节p-STAT3抑制方面提供任何进一步的加性作用(图5B)。虽然在节律CTX治疗的动物中,肿瘤中p-STAT3的表达在脑和肺之间存在显著差异,但由于肺肿瘤发病率低(即细胞毒性CTX在肺中的疗效显著),细胞毒性CTX组中p-STAT3水平的测定不能用于提供二次验证。两组间肿瘤微环境中肿瘤浸润的巨噬细胞/小胶质细胞和CD8 T细胞数量无显著性差异(数据未显示)。 |
||
| 细胞实验 |
生长抑制试验。[1]
3,[4,5-二甲基噻唑-2-基]-5-[3-羧基甲氧基苯基]-2-[4-巯基]- 2h -四氮唑(MTT)检测采用基于MTT的细胞增殖/细胞毒性检测系统。简单地说,在含有10% FCS的RPMI 1640中洗涤新鲜的低密度外周血细胞和处于对数生长期的各种细胞系两次,并在血细胞计中计数。采用台盼蓝(0.1%)染色法测定细胞活力。在100 μL RPMI 1640培养液中分别添加10% FCS或添加WP1066培养液,培养等量活细胞(5 × 104个/孔);96孔平板,37°C, 5% CO2加湿,持续孵育72小时。每种条件下的实验都做了三次。孵育后,每孔加入20 μL CellTiter96 One Solution Reagent。然后在加湿的5% CO2气氛中,在37°C下再孵育60分钟。孵育后,立即使用96孔板阅读器在490 nm波长下读取吸光度。 膜联蛋白V和碘化丙啶染色。[1] 用v处理24、48和72 h后,用PBS洗涤细胞,用100 μL的结合缓冲液[10 mmol/L 4-(2-羟乙基)-1-哌嗪乙烷磺酸(pH 7.4), 0.15 mol/L NaCl, 5 mmol/L KCl, 1 mmol/L MgCl2和1.8 mmol/L CaCl2]重悬,其中加入Annexin v -氟异硫氰酸酯。细胞在室温下黑暗孵育15分钟。孵育后,洗涤细胞,再用0.2 mL结合缓冲液重悬。 线粒体跨膜电位测定。[1] 在WP1066处理72小时后,用亚微摩尔浓度的MitoTracker探针孵育细胞,以评估线粒体膜电位的变化。MitoTracker探针被动地扩散穿过质膜并积聚在线粒体中。细胞用MitoTracker Red CMXRos和MTGreen FM染色。简单地说,细胞在无Ca2+的PBS中洗涤,用MitoTracker染料染色,在37°C的黑暗中孵育1小时。CMXRos和MTGreen通过线粒体膜电位的作用进入线粒体,并与硫醇残基反应形成共价硫醇酯键。 细胞周期分析。[3] 按标准方案进行细胞周期分析。简单地说,在WP1066孵育后,5 × 106个细胞成球。细胞微球洗涤后用2ml 1%多聚甲醛PBS重悬。在4°C条件下,用或不加WP1066孵育细胞15分钟,然后用PBS洗涤,用2ml无水乙醇重悬,在- 20°C条件下保存,直到需要染色。将保存的细胞在PBS中洗涤2次,重悬于0.5 mL碘化丙啶染色缓冲液中(50 μg/mL碘化丙啶和10 μg/mL RNase在PBS中),室温下全黑暗孵育1 h。流式细胞术分析使用FACSCalibur流式细胞仪和CellQuest软件程序。使用CellQuest和ModFit LT软件程序进行数据分析。 Annexin V法检测细胞凋亡。[3] 如前所述,采用annexin V-FITC测定法 定量细胞凋亡。简单地说,WP1066处理的OCIM2和K562细胞用冷PBS洗涤两次,然后在结合缓冲液[10 nmol/L N-(2-羟乙基哌嗪)-N ' -2-乙磺酸,140 nmol/L NaCl和5 nmol/L CaCl2 (pH, 7.4)]中重悬,浓度为1 × 106个细胞/mL。孵育后,各取100 μL转入5 ml培养管中,加入5 μL膜联蛋白V-FITC。将试管轻轻旋转,在室温下完全黑暗中孵育15分钟。在孵育结束时,每个试管中加入400 mL结合缓冲液,并立即使用FACSCalibur流式细胞仪和CellQuest软件进行流式细胞术分析细胞。使用CellQuest和ModFit LT(2.0)软件程序进行数据分析。为了确定WP1066-诱导的凋亡是否依赖于caspase,将OCIM2细胞与20 μL泛caspase抑制剂Z-VAD-FMK预孵育,并采用上述annexin V法检测凋亡细胞。 细胞存活试验[2] 将B16细胞以每孔2000个细胞的密度接种于96孔培养板中,在0、0.156、0.313、0.625、1.25、2.5和5.0µM的浓度下用WP1066处理,或在CTX浓度为0、0.156 mg/ml (0.559 mM)、0.313 mg/ml (1.121 mM)、0.625mg/ml (2.239 mM)和1.25 mg/ml (4.478 mM)的浓度下处理。WP1066稀释剂DMSO在终浓度为0.05%时使用,包括与CTX作为对照。处理72 h后,每孔加入25µl 5 mg/ml二甲基噻唑基二苯基四氮唑盐溶液,在5% CO2和95%空气的37℃湿化气氛中培养3 h。用100µl/孔裂解缓冲液(50%二甲基甲酰胺,20%十二烷基硫酸钠[SDS], pH 5.6)裂解细胞,室温孵育过夜。在570 nm处读取od值评估细胞活力,计算IC50。 免疫印迹分析[2] 将B16细胞以2 × 106个/孔的密度接种于6孔培养板中,在含5% CO2的环境中,37℃RPMI培养基中孵育过夜。之后,将B16细胞分别在WP1066(2.5µM、5µM)、CTX [0.75 mg/ml(低于IC50)、1.5 mg/ml(高于IC50)]、或2.5µM WP1066与CTX (0.75 mg/ml、1.5 mg/ml)联合培养2小时。之后,将B16细胞制成颗粒,用1500 rpm的冷冻PBS冲洗5分钟,然后在含有1% Triton-X-100加磷酸酶和蛋白酶抑制剂 的冷冻裂解缓冲液(50 mM Tris-HCl [pH 8.0], 150 mM NaCl, 1 mM EDTA)中放置30分钟。裂解液在4℃下14000 rpm离心10分钟,收集上清液并定量其蛋白质含量。等量的蛋白质(65µg)在含有SDS的8%聚丙烯酰胺凝胶中电泳分离,转移到硝化纤维素膜上,用针对p-STAT3 (Tyr705)、STAT3和β-actin的特异性抗体进行免疫印迹分析。 |
||
| 动物实验 |
|
||
| 参考文献 |
|
||
| 其他信息 |
WP1066 has been used in trials studying the treatment of Melanoma, Brain Cancer, Solid Tumors, and Central Nervous System Neoplasms.
STAT3 Inhibitor WP1066 is an orally bioavailable, small molecule inhibitor of signaling transducer and activator 3 (STAT3), with potential antineoplastic and immunomodulatory activities. Upon administration, STAT3 inhibitor WP1066 blocks the intranuclear translocation of p-STAT, thereby suppressing STAT3 signaling and decreasing the levels of downstream products including c-Myc. Additionally, WP1066 may upregulate costimulatory molecules including CD80 and CD86 on human microglia, and reverse glioma cancer stem cell (gCSC)-mediated innate and adaptive immune suppression allowing for the restoration of antitumor effector immune responses. The STAT3 pathway is overly active in many cancer types and is implicated in CSC-mediated growth, recurrence and resistance to conventional chemotherapies. Purpose: The discovery of an activating somatic mutation in codon 617 of the gene encoding the Janus kinase (JAK)-2 (JAK2 V617F) in patients with myeloproliferative disorders has opened new avenues for the development of targeted therapies for these malignancies. However, no effective JAK2 inhibitors are currently available for clinical use. Experimental design: We investigated the activity of (E)-3(6-bromopyridin-2-yl)-2-cyano-N-(S0-1phenylethyl)acrylamide (WP1066), a novel analogue of the JAK2 inhibitor AG490, in JAK2 V617F-positive erythroleukemia HEL cells and in blood cells from patients with polycythemia vera. Results: We found that WP1066 significantly inhibited JAK2 and its downstream signal transducer and activator of transcription-3, signal transducer and activator of transcription-5, and extracellular signal-regulated kinase-1/2 pathways in a dose- and time-dependent manner. As a result, WP1066 concentrations in the low micromolar range induced time- and dose-dependent antiproliferative and proapoptotic effects in HEL cells. As expected, WP1066 inhibited the proliferation of peripheral blood hematopoietic progenitors of patients with polycythemia vera carrying the JAK2 V617F mutation in a dose-dependent manner. Conclusions: Our data suggest that WP1066 is active both in vitro and ex vivo and should be further developed for the treatment of neoplasms expressing the JAK2 V617F mutation.[1] Melanoma is a common and deadly tumor that upon metastasis to the central nervous system (CNS) has median survival duration of less than 5 months. Activation of the signal transducer and activator of transcription 3 (STAT3) has been identified as a key mediator that drives the fundamental components of melanoma. We hypothesized that WP1066, a novel inhibitor of STAT3 signaling, would enhance the antitumor activity of cyclophosphamide (CTX) against melanoma, including disease within the CNS. The mechanisms of efficacy were investigated by tumor- and immune-mediated cytotoxic assays, in vivo evaluation of the reduction of regulatory T cells (Tregs) and by determining intratumoral p-STAT3 expression by immunohistochemistry. Combinational therapy of WP1066, with both metronomic and cytotoxic dosing of CTX, was investigated in a model system of systemic and intracerebral melanoma in syngeneic mice. Inhibition of p-STAT3 by WP1066 was enhanced with CTX in a dose-dependent manner. However, in mice with intracerebral melanoma, the greatest therapeutic benefit was seen in animals treated with cytotoxic CTX dosing and WP1066, whose median survival time was 120 days, an increase of 375%, with 57% long-term survivors. This treatment efficacy correlated with p-STAT3 expression levels within the tumor microenvironment. The efficacy of the combination of cytotoxic dosing of CTX with WP1066 is attributed to the direct tumor cytotoxic effects of the agents and has the greatest therapeutic potential for the treatment of CNS melanoma. [2] Several cytokines and growth factors that stimulate the proliferation of acute myelogenous leukemia (AML) cells transduce their signals by activating the transcription factor Janus-activated kinase 2 (JAK2). Accordingly, the inhibition of JAK2 or of its downstream signaling pathways suppresses the proliferation of AML cells. Because (E)-3(6-bromopyridin-2-yl)-2-cyano-N-((S0-1-phenylethyl)acrylamide) (WP1066) is a novel analogue of the JAK2 inhibitor AG490, we tested its activity in AML cells and investigated its mechanism of action. Using clonogenic assays, we found that although WP1066 had a marginal effect on normal marrow progenitors, it inhibited the proliferation of AML colony-forming cells obtained from patients with newly diagnosed AML and that of the AML cell lines OCIM2 and K562. WP1066 inhibited OCIM2 cell multiplication by inducing accumulation of cells at the G(0)-G(1) phase of the cell cycle. Similar to its parent compound AG490, WP1066 inhibited the phosphorylation of JAK2, but unlike AG490, WP1066 also degraded JAK2 protein, thereby blocking its downstream signal transducer and activator of transcription (STAT) and phosphoinositide-3-kinase pathways. These effects resulted in the activation of the caspase pathway. Incubation of both OCIM2 and K562 cells with WP1066 activated caspase-3, induced cleavage of poly(ADP-ribose) polymerase, and caused caspase-dependent apoptotic cell death. Thus, WP1066 is a potent JAK2 inhibitor whose effects in AML and other hematologic malignancies merit further investigation. [3] |
| 分子式 |
C17H14BRN3O
|
|
|---|---|---|
| 分子量 |
356.22
|
|
| 精确质量 |
355.032
|
|
| 元素分析 |
C, 57.32; H, 3.96; Br, 22.43; N, 11.80; O, 4.49
|
|
| CAS号 |
857064-38-1
|
|
| 相关CAS号 |
|
|
| PubChem CID |
11210478
|
|
| 外观&性状 |
Off-white to light yellow solid powder
|
|
| 密度 |
1.4±0.1 g/cm3
|
|
| 沸点 |
569.9±50.0 °C at 760 mmHg
|
|
| 闪点 |
298.5±30.1 °C
|
|
| 蒸汽压 |
0.0±1.6 mmHg at 25°C
|
|
| 折射率 |
1.637
|
|
| LogP |
2.95
|
|
| tPSA |
65.78
|
|
| 氢键供体(HBD)数目 |
1
|
|
| 氢键受体(HBA)数目 |
3
|
|
| 可旋转键数目(RBC) |
4
|
|
| 重原子数目 |
22
|
|
| 分子复杂度/Complexity |
462
|
|
| 定义原子立体中心数目 |
1
|
|
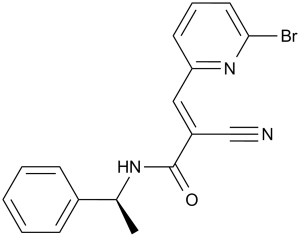
| SMILES |
C[C@@H](C1=CC=CC=C1)NC(=O)/C(=C/C2=NC(=CC=C2)Br)/C#N
|
|
| InChi Key |
VFUAJMPDXIRPKO-LQELWAHVSA-N
|
|
| InChi Code |
InChI=1S/C17H14BrN3O/c1-12(13-6-3-2-4-7-13)20-17(22)14(11-19)10-15-8-5-9-16(18)21-15/h2-10,12H,1H3,(H,20,22)/b14-10+/t12-/m0/s1
|
|
| 化学名 |
(S,E)-3-(6-bromopyridin-2-yl)-2-cyano-N-(1-phenylethyl)acrylamide
|
|
| 别名 |
WP-1066; WP 1066; WP1066; (S,E)-3-(6-Bromopyridin-2-yl)-2-cyano-N-(1-phenylethyl)acrylamide; (E)-3-(6-bromopyridin-2-yl)-2-cyano-N-[(1S)-1-phenylethyl]prop-2-enamide; UNII-63V8AIE65T; DTXSID50235007; ...; 857064-38-1; WP1066
|
|
| HS Tariff Code |
2934.99.9001
|
|
| 存储方式 |
Powder -20°C 3 years 4°C 2 years In solvent -80°C 6 months -20°C 1 month |
|
| 运输条件 |
Room temperature (This product is stable at ambient temperature for a few days during ordinary shipping and time spent in Customs)
|
| 溶解度 (体外实验) |
|
|||
|---|---|---|---|---|
| 溶解度 (体内实验) |
注意: 如下所列的是一些常用的体内动物实验溶解配方,主要用于溶解难溶或不溶于水的产品(水溶度<1 mg/mL)。 建议您先取少量样品进行尝试,如该配方可行,再根据实验需求增加样品量。
注射用配方
注射用配方1: DMSO : Tween 80: Saline = 10 : 5 : 85 (如: 100 μL DMSO → 50 μL Tween 80 → 850 μL Saline)(IP/IV/IM/SC等) *生理盐水/Saline的制备:将0.9g氯化钠/NaCl溶解在100 mL ddH ₂ O中,得到澄清溶液。 注射用配方 2: DMSO : PEG300 :Tween 80 : Saline = 10 : 40 : 5 : 45 (如: 100 μL DMSO → 400 μL PEG300 → 50 μL Tween 80 → 450 μL Saline) 注射用配方 3: DMSO : Corn oil = 10 : 90 (如: 100 μL DMSO → 900 μL Corn oil) 示例: 以注射用配方 3 (DMSO : Corn oil = 10 : 90) 为例说明, 如果要配制 1 mL 2.5 mg/mL的工作液, 您可以取 100 μL 25 mg/mL 澄清的 DMSO 储备液,加到 900 μL Corn oil/玉米油中, 混合均匀。 View More
注射用配方 4: DMSO : 20% SBE-β-CD in Saline = 10 : 90 [如:100 μL DMSO → 900 μL (20% SBE-β-CD in Saline)] 口服配方
口服配方 1: 悬浮于0.5% CMC Na (羧甲基纤维素钠) 口服配方 2: 悬浮于0.5% Carboxymethyl cellulose (羧甲基纤维素) 示例: 以口服配方 1 (悬浮于 0.5% CMC Na)为例说明, 如果要配制 100 mL 2.5 mg/mL 的工作液, 您可以先取0.5g CMC Na并将其溶解于100mL ddH2O中,得到0.5%CMC-Na澄清溶液;然后将250 mg待测化合物加到100 mL前述 0.5%CMC Na溶液中,得到悬浮液。 View More
口服配方 3: 溶解于 PEG400 (聚乙二醇400) 请根据您的实验动物和给药方式选择适当的溶解配方/方案: 1、请先配制澄清的储备液(如:用DMSO配置50 或 100 mg/mL母液(储备液)); 2、取适量母液,按从左到右的顺序依次添加助溶剂,澄清后再加入下一助溶剂。以 下列配方为例说明 (注意此配方只用于说明,并不一定代表此产品 的实际溶解配方): 10% DMSO → 40% PEG300 → 5% Tween-80 → 45% ddH2O (或 saline); 假设最终工作液的体积为 1 mL, 浓度为5 mg/mL: 取 100 μL 50 mg/mL 的澄清 DMSO 储备液加到 400 μL PEG300 中,混合均匀/澄清;向上述体系中加入50 μL Tween-80,混合均匀/澄清;然后继续加入450 μL ddH2O (或 saline)定容至 1 mL; 3、溶剂前显示的百分比是指该溶剂在最终溶液/工作液中的体积所占比例; 4、 如产品在配制过程中出现沉淀/析出,可通过加热(≤50℃)或超声的方式助溶; 5、为保证最佳实验结果,工作液请现配现用! 6、如不确定怎么将母液配置成体内动物实验的工作液,请查看说明书或联系我们; 7、 以上所有助溶剂都可在 Invivochem.cn网站购买。 |
| 制备储备液 | 1 mg | 5 mg | 10 mg | |
| 1 mM | 2.8073 mL | 14.0363 mL | 28.0725 mL | |
| 5 mM | 0.5615 mL | 2.8073 mL | 5.6145 mL | |
| 10 mM | 0.2807 mL | 1.4036 mL | 2.8073 mL |
1、根据实验需要选择合适的溶剂配制储备液 (母液):对于大多数产品,InvivoChem推荐用DMSO配置母液 (比如:5、10、20mM或者10、20、50 mg/mL浓度),个别水溶性高的产品可直接溶于水。产品在DMSO 、水或其他溶剂中的具体溶解度详见上”溶解度 (体外)”部分;
2、如果您找不到您想要的溶解度信息,或者很难将产品溶解在溶液中,请联系我们;
3、建议使用下列计算器进行相关计算(摩尔浓度计算器、稀释计算器、分子量计算器、重组计算器等);
4、母液配好之后,将其分装到常规用量,并储存在-20°C或-80°C,尽量减少反复冻融循环。
计算结果:
工作液浓度: mg/mL;
DMSO母液配制方法: mg 药物溶于 μL DMSO溶液(母液浓度 mg/mL)。如该浓度超过该批次药物DMSO溶解度,请首先与我们联系。
体内配方配制方法:取 μL DMSO母液,加入 μL PEG300,混匀澄清后加入μL Tween 80,混匀澄清后加入 μL ddH2O,混匀澄清。
(1) 请确保溶液澄清之后,再加入下一种溶剂 (助溶剂) 。可利用涡旋、超声或水浴加热等方法助溶;
(2) 一定要按顺序加入溶剂 (助溶剂) 。
| NCT Number | Recruitment | interventions | Conditions | Sponsor/Collaborators | Start Date | Phases |
| NCT04334863 | Completed | Drug: WP1066 | Brain Tumor Medulloblastoma |
Emory University | May 4, 2020 | Phase 1 |
| NCT01904123 | Completed | Other: Pharmacological Study Drug: STAT3 Inhibitor WP1066 |
Metastatic Melanoma Recurrent Brain Neoplasm |
M.D. Anderson Cancer Center | July 13, 2018 | Phase 1 |
| NCT05879250 | Not yet recruiting | Procedure: Biospecimen Collection Procedure: Magnetic Resonance Imaging |
Glioblastoma, IDH-Wildtype MGMT-Unmethylated Glioblastoma |
Northwestern University | December 27, 2024 | Phase 2 |
|
WP1066 downregulates HIF1α and HIF2α expression and reduces VEGF production in renal cancer cells.Br J Cancer.2010 May 25;102(11):1592-9. |
WP1066 inhibits tumour growth in the murine xenograft model of Caki-1 cells.Br J Cancer.2010 May 25;102(11):1592-9. |