| 规格 | 价格 | ||
|---|---|---|---|
| 500mg | |||
| 1g | |||
| Other Sizes |
| 靶点 |
TLR4
|
|---|---|
| 体外研究 (In Vitro) |
CRX-526在体外抑制LPS对人单核细胞的激活[1]>
我们之前已经确定,CRX-526虽然在结构上与脂质A相似(图1),但本身并不能诱导人单核细胞产生促炎细胞因子。为了确定CRX-526是否与TLR4R复合物相互作用,我们测试了CRX-526能否拮抗已知TLR4配体LPS的促炎特性。将人单核细胞衍生的巨噬细胞与越来越高浓度的CRX-526预孵育,然后暴露于不同浓度的LPS。巨噬细胞与CRX-526预孵育导致暴露于LPS后TNF-α的产生受到抑制(图2,A)。与我们之前的研究一致,CRX-526单独与巨噬细胞一起孵育不会导致任何TNF-α的产生。CRX-526:LPS的最小w/w比为5:1是必要的,可以清楚地检测到对TNF-α产生的抑制作用;需要50:1的w/w比才能完全消除LPS对TNF-α的反应。人单核细胞与CRX-526的预孵育也导致IL-6、MIP-1α的抑制,以及暴露于LPS后的产生(图2,B)。由于单核细胞的IFN-γ活化不仅能增强TNF-α的分泌,而且是产生生物活性IL-12p70以响应LPS所必需的,因此我们确定了CRX-526对IFN-γ激活的单核细胞中LPS诱导的细胞因子分泌的抑制作用(图2,C)。与IL-6和TNF-α的分泌在相似水平上受到抑制的静息单核细胞相比(图2,B),CRX-526对IFN-γ激活的单核细胞对LPS的细胞因子分泌具有不同的抑制作用(图2C)。CRX-526与LPS的10:1 w/w比例分别抑制了IL-12p70和TNF-α的产生79%和57%,但对LPS诱导的IL-6产生没有影响。在小鼠系统中,CRX-526抑制了LPS诱导的小鼠脾脏树突状细胞产生IL-6、IL-12p70和TNF-α(数据未显示),表明CRX-526通过人或小鼠TLR4R复合物抑制LPS信号传导。CRX-526对人树突状细胞中LPS信号传导的拮抗作用也已得到证实(P.Probst,未发表的观察结果) 为了确认CRX-526是一种纯拮抗剂,不会通过TLR4R复合物发出信号诱导任何基因转录,我们使用了一种定制的微阵列,其中含有约300个炎性基因靶标,排列成三份,以观察单独暴露于CRX-526和/或在LPS存在下的人单核细胞中的mRNA表达。单核细胞单独暴露于LPS(图2,D,左)刺激了>60个阵列元件的表达>2倍,而单独暴露于CRX-526(图2、D,右)没有诱导微阵列上发现的任何基因的表达。此外,在暴露于LPS之前,用越来越多的CRX-526预处理单核细胞完全抑制了所有LPS诱导的基因转录(图2,D)。已知NF-κB参与该微阵列上许多元件的转录调控(22)。表I总结了CRX-526对代表性NF-κB调节基因的抑制水平。因此,CRX-526可以作为TLR4R复合物的拮抗剂,并可以抑制LPS通过TLR4R复合物质发出信号的能力。 CRX-526的拮抗活性取决于SAC的长度[1] CRX-526的结构在SAC的长度上与单磷酰脂质A(MPL)和其他TLR4激动剂AGP有显著不同:CRX-526含有3个长度为6个碳的SAC,而MPL和其他通过TLR4R复合物发出信号的AGP含有长度≥10个碳的SAC(图1)。为了确认己酸SAC是否是CRX-526拮抗活性的必要条件,我们合成了CRX-526的变体分子,在三个不同位置含有己酸或癸酸SAC(图3)。CRX-567与CRX-526的不同之处仅在于右侧位置有癸酸SAC,而CRX-568在中间位置有癸醇SAC,CRX-570在左侧位置有癸醛SAC(比较图1与图3)。然后测试这些分子通过TLR4R复合物抑制LPS信号传导的能力。使用之前描述的模型系统,将编码TLR4、MD-2和CD14的DNA与人IL-8启动子驱动荧光素酶报告质粒和β-半乳糖苷酶载体一起瞬时转染HeLa细胞。这些转染的细胞用浓度增加的单独AGP(8900)或AGP+100 ng/ml LPS刺激(▪), 并监测萤光素酶活性(图3)。CRX-526以剂量依赖的方式抑制LPS通过TLR4/MD2/CD14复合物发出信号的能力。LPS不能刺激用对照载体转染的HeLa细胞,单独使用CRX-526也不能在TLR4/MD2/CD14转染的细胞中诱导信号(图3)。CRX-567对TLR4/MD2/CD14R复合物具有拮抗活性,与CRX-526相似(图3)。然而,与CRX-526或CRX-567相比,CRX-568的拮抗活性较低,甚至具有一些部分激动剂活性。CRX-570几乎没有拮抗活性,但具有显著的激动活性。这些发现表明,CRX-526通过TLR4/MD2/CD14复合物抑制LPS信号传导需要分子左侧和中间位置的缩短(己酸)SAC。 |
| 体内研究 (In Vivo) |
CRX-526可抑制LPS诱导的体内TNF-α释放[1]
我们的数据清楚地表明,CRX-526可以在体外通过TLR4R复合物抑制LPS信号传导。为了测试CRX-526是否也能在体内抑制LPS活性,我们在CRX-526存在或不存在的情况下将LPS静脉注射到小鼠体内,1小时后测量血清中的TNF-α。我们能够在只给予5ng LPS的小鼠血清中检测到大量的TNF-α(数据未显示)。因此,我们单独给小鼠注射5ng LPS或增加CRX-526的量。低至80 ng的CRX-526即可显著抑制TNF-α的释放(数据未显示),10μg的CRX-524可达到TNF-α的背景水平(图4)。这些数据证实,CRX-526在体内和体外都是LPS的拮抗剂。 CRX-526可以抑制两种不同结肠炎小鼠模型的疾病发展[1] 由于LPS是革兰氏阴性菌细胞膜的主要炎症部分,我们假设CRX-526可能能够抑制革兰氏阴性菌引起或实施IBD炎症的能力。因此,我们测试了CRX-526在两种不同的结肠炎小鼠模型中抑制疾病发展的能力:右旋糖酐硫酸钠诱导的结肠炎和MDR1a缺陷小鼠。 暴露于饮用水中的DSS会导致小鼠急性结肠炎,因为上皮层受损。接触DSS的动物表现出明显的临床症状,包括体重减轻、粪便稠度变化、粪便中有血和/或大出血,这些症状与大肠的组织学变化直接相关)。TLR4表达不足的小鼠在暴露于DSS时确实会发生急性结肠炎。然而,Lange等人观察到,与菌株匹配的TLR4野生型小鼠相比,TLR4突变小鼠菌株,如C3H/HeJ和C57BL/10ScN,显示出肠出血的延迟发作,并在暴露于DSS≥10天后显示出存活率的提高。他们的数据表明,TLR4在DSS诱导的结肠炎中可能起着轻微但可检测的作用。因此,我们将BALB/c雌性小鼠暴露于DSS 7天,同时用CRX-526治疗小鼠。在第7天评估小鼠结肠炎(DAI)的临床症状和大肠的组织学变化。如图5所示,暴露于DSS会导致这些小鼠出现显著的临床和组织学变化。此外,与之前的研究一致,DAI与组织学评分相关。与CRX-526的联合治疗显著降低了所有测试剂量的组织学评分,但仅在10和50μg剂量下降低了DAI(实验1,图5,A)。这些数据表明,阻断TLR4R复合物信号传导可以降低结肠炎急性模型中的疾病严重程度,DAI的降低是我们模型系统中疾病严重程度降低的严格衡量标准。重复实验证实,50μg CRX-526能够显著降低DSS暴露小鼠的DAI评分(实验2,图5,B)。为了证实我们的结果是由于抑制了通过TLR4R复合物的信号传导,我们比较了CRX-526影响TLR4野生型(BALB/cJ)和TLR4突变型(C.C3H.Tlr4Lps-d)小鼠疾病严重程度的能力。当暴露于DSS时,TLR4野生型和TLR4突变型小鼠都会出现急性疾病,尽管TLR4突变小鼠的DAI明显较低(TLR4野生类型和TLR4突变体小鼠的平均DAI分别为1.9±0.4和1.4±0.2;p=0.004;图6)。皮下注射50μg CRX-526可显著降低TLR4野生型小鼠的DAI评分,但不降低TLR4突变小鼠(图6)。这些数据证实,CRX-526治疗动物的疾病严重程度降低是由于TLR4R复合物信号传导的阻断。有趣的是,用CRX-526治疗TLR4野生型小鼠使DAI评分达到与TLR4突变型小鼠相似的水平(TLR4突变小鼠的平均DAI为1.4±0.3,CRX-526处理的TLR4野生类型小鼠为1.3±0.8),这表明在50-μg剂量下,我们几乎完全抑制了TLR4R复合物信号传导(图6) 目前的证据表明,炎症性肠病患者肠道中观察到的慢性炎症是由于对肠道菌群的异常免疫反应引起的。研究人员开发了一种脂质a模拟物CRX-526,它对TLR4具有拮抗活性,可以阻断LPS与免疫系统的相互作用。CRX-526可以在体外阻止LPS刺激的促炎基因的表达。CRX-526的这种拮抗活性与其结构,特别是仲脂肪酰基链长直接相关。在体内,CRX-526治疗阻断了LPS诱导TNF-α释放的能力。重要的是,CRX-526治疗抑制了两种结肠炎小鼠模型中中度至重度疾病的发展:右旋糖酐硫酸钠模型和多药耐药基因1a缺陷小鼠。通过阻断肠道细菌和先天免疫系统之间的相互作用,CRX-526可能是治疗炎症性肠病的有效分子[1]。 |
| 酶活实验 |
LPS刺激人单核细胞来源的巨噬细胞[1]
在等分和冷冻之前,通过Ficoll-Hypaque 1.077 离心白细胞分离产品分离人PBMC。如前所述,通过粘附步骤制备单核细胞和单核细胞衍生的巨噬细胞。细胞的表型分析显示,>95%的细胞是CD14阳性的。先前已经详细描述了在LPS和/或AGP存在下刺激人单核细胞来源的巨噬细胞。简而言之,单核细胞来源的巨噬细胞暴露于不同浓度的CRX-526。30分钟后,向培养物中加入LPS。刺激6小时后,取出上清液,通过ELISA分析TNF-α的存在。如前所述,从贴壁细胞中分离RNA,以产生用于微阵列分析的cDNA。 抑制LPS诱导的单核细胞产生细胞因子[1] 通过贴壁步骤从4×106个PBMC中产生人单核细胞,并在含有2%人AB血清的RPMI 1640培养基中培养48小时。对于测定IL-12p70产生的实验,培养基在最后24小时内补充IFN-γ(1000 U/ml)。在用CRX-526孵育30分钟后,用100 ng/ml大肠杆菌LPS刺激单核细胞。在18小时后采集的上清液中测定细胞因子和MIP-1α。如前所述,通过细胞因子特异性ELISA对IL-6、IL-12p70和TNF-α的产生进行定量。所有ELISA的工作灵敏度均为约10 pg/ml。根据制造商的方案,使用ELISA试剂盒测定MIP-1α和小鼠TNF-α水平。在没有刺激的情况下,无法检测到细胞因子。 HeLa细胞转染和报告基因检测[1] 之前描述的HeLa瞬时转染系统用于测试CRX-526、CRX-567、CRX-568和CRX-570作为TLR4-MD2-CD14R复合物拮抗剂/激动剂的能力。简而言之,HeLa细胞用50 ng IL-8启动子衍生的萤光素酶报告子和10 ng TLR4、MD-2和CD14质粒转染。转染18小时后,在载体或100ng/ml LPS存在下,用不同浓度的AGP刺激细胞6小时,裂解,然后分析萤光素酶和β-半乳糖苷酶活性。 |
| 动物实验 |
DSS model of intestinal inflammation [1]
Two separate protocols were used to cause DSS-induced intestinal inflammation, depending on the strain of mice and the lot of DSS used. For experiment no. 1 (see Fig. 1), BALB/cAnN females were given 4.0% DSS in their water ad libitum starting on day 0, with all mice sacrificed on day 7. Negative control animals remained on standard facility water. Starting on day 0, mice were given s.c. injections of either AF vehicle or varying doses of CRX-526-AF every other day for a total of four doses (n = 5/group). For experiment no. 2 and Fig. 5, BALB/cJ females and C.C3H Tlr4Lps-d/J mice were given 3.0% DSS in their drinking water from days 0 to 7 and were s.c. injected daily with either AF-vehicle or 50 μg of CRX-526-AF from days −3 through 6 for a total of nine doses (n = 10/group). Disease activity index (DAI), a clinical score that factors in weight loss, changes in stool consistency, and the presence of blood in the stool was assessed by a previously published method. Paraffin-embedded sections of the large intestines, prepared as “Swiss rolls”, were stained with H&E, and histological scoring of disease in the cecums and colons was determined in a blinded fashion by a certified veterinary pathologist (H. Bielefeldt-Ohmann). Briefly, the cecum, proximal colon, mid-colon, distal colon, and rectum were assessed for loss of mucosal architecture (0–4), the presence of mucoid crypt cysts (0–4), goblet cell depletion (0–4), erosion (0–4), edema (0–4), mononuclear cell infiltration (0–4), polymorphonucleocyte and/or eosinophil infiltration (0–4), and transmural inflammation (0–4). To obtain a total score for each mouse, the total scores for each segment were added together; the maximal possible score is 160. Treatment and assessment of colitis in MDR1a-deficient mice [1] Starting at 5–6 wk of age, MDR1a-deficient female mice were injected s.c. on a weekly basis with 50 μg (experiment no. 1) or 100 μg of CRX-526-TeoA or with an equal volume of TeoA alone (vehicle treated). Treatment continued for 5–6 wk, and then, mice were sacrificed and the tissues prepared as described above. Histological scoring of disease in the large intestine was performed in a blinded fashion by Dr. H. Bielefeldt-Ohmann, using a previously described scoring system. Briefly, the cecum, proximal colon, distal colon, and rectum from each mouse were scored on severity of mucosal epithelial changes (0–4), degree of inflammation (0–4), the percentage of intestinal segment affected in any manner (extent score A), and the percentage of intestinal segment affected by the most severe score (≥2) given for inflammation or mucosa (extent score B). The segment score was determined by summing the severity scores (mucosal score + inflammation score + extent score A + extent score B), and then, the segment scores were added together to reach a total score for each mouse, with a maximum possible score of 64. |
| 参考文献 |
[1]. Anti-inflammatory effect of miltirone on inflammatory bowel disease via TLR4/NF-κB/IQGAP2 signaling pathway. Biomed Pharmacother. 2017 Jan;85:531-540.
|
| 其他信息 |
Although the exact mechanism of action of CRX-526 is still under investigation, we hypothesize that CRX-526 binds directly to the TLR4R complex and sterically inhibits the ability of LPS and, perhaps, other ligands to bind. We have demonstrated previously that MPL and other AGP molecules do not induce cytokine production from cells lacking TLR4 expression, suggesting these lipid A-derived molecules are strictly ligands for TLR4. Recently, it has been shown by Akashi et al. that LPS binds directly to the TLR4-MD-2 complex, while CD14 can augment this binding. They also tested a TLR4R complex antagonist, E5531, and showed it also bound directly to TLR4-MD-2. As E5531 has very similar LPS-antagonist activity compared with CRX-526 it is possible that CRX-526 also binds directly to a TLR4-MD-2 complex. [1]
|
| 分子式 |
C69H127N2O19P
|
|---|---|
| 分子量 |
1319.7438
|
| 精确质量 |
1318.88
|
| 元素分析 |
C, 62.80; H, 9.70; N, 2.12; O, 23.03; P, 2.35
|
| CAS号 |
245515-64-4
|
| 相关CAS号 |
245515-64-4;
|
| PubChem CID |
24849153
|
| 外观&性状 |
Typically exists as solid at room temperature
|
| LogP |
16.254
|
| tPSA |
322.94
|
| 氢键供体(HBD)数目 |
6
|
| 氢键受体(HBA)数目 |
19
|
| 可旋转键数目(RBC) |
65
|
| 重原子数目 |
91
|
| 分子复杂度/Complexity |
1960
|
| 定义原子立体中心数目 |
9
|
| SMILES |
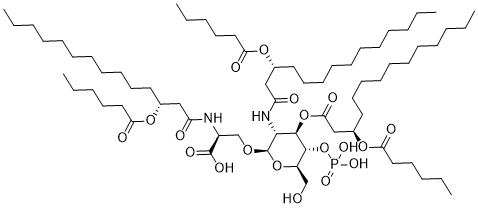
P(=O)(O)(O)O[C@@H]1[C@@H](CO)O[C@H]([C@@H]([C@H]1OC(C[C@@H](CCCCCCCCCCC)OC(CCCCC)=O)=O)NC(C[C@@H](CCCCCCCCCCC)OC(CCCCC)=O)=O)OC[C@@H](C(=O)O)NC(C[C@@H](CCCCCCCCCCC)OC(CCCCC)=O)=O
|
| InChi Key |
PRIXXGNJDNLMBH-DPGPRPECSA-N
|
| InChi Code |
InChI=1S/C69H127N2O19P/c1-7-13-19-22-25-28-31-34-40-43-54(85-61(75)46-37-16-10-4)49-59(73)70-57(68(79)80)53-84-69-65(71-60(74)50-55(86-62(76)47-38-17-11-5)44-41-35-32-29-26-23-20-14-8-2)67(66(58(52-72)88-69)90-91(81,82)83)89-64(78)51-56(87-63(77)48-39-18-12-6)45-42-36-33-30-27-24-21-15-9-3/h54-58,65-67,69,72H,7-53H2,1-6H3,(H,70,73)(H,71,74)(H,79,80)(H2,81,82,83)/t54-,55-,56-,57+,58-,65-,66-,67-,69-/m1/s1
|
| 化学名 |
(2S)-2-[[(3R)-3-hexanoyloxytetradecanoyl]amino]-3-[(2R,3R,4R,5S,6R)-3-[[(3R)-3-hexanoyloxytetradecanoyl]amino]-4-[(3R)-3-hexanoyloxytetradecanoyl]oxy-6-(hydroxymethyl)-5-phosphonooxyoxan-2-yl]oxypropanoic acid
|
| 别名 |
CRX 526; CRX-526; 245515-64-4; UNII-8NLO017HHA; 8NLO017HHA; CHEMBL505526; (2S)-2-[[(3R)-3-hexanoyloxytetradecanoyl]amino]-3-[(2R,3R,4R,5S,6R)-3-[[(3R)-3-hexanoyloxytetradecanoyl]amino]-4-[(3R)-3-hexanoyloxytetradecanoyl]oxy-6-(hydroxymethyl)-5-phosphonooxyoxan-2-yl]oxypropanoic acid; Hexanoic acid, (1R)-1-(2-(((1S)-1-carboxy-2-((2-deoxy-3-O-((3R)-1-oxo-3-((1-oxohexyl)oxy)tetradecyl)-2-(((3R)-1-oxo-3-((1-oxohexyl)oxy)tetradecyl)amino)-4-O-phosphono-beta-D-glucopyranosyl)oxy)ethyl)amino)-2-oxoethyl)dodecyl ester; HEXANOIC ACID, (1R)-1-(2-(((1S)-1-CARBOXY-2-((2-DEOXY-3-O-((3R)-1-OXO-3-((1-OXOHEXYL)OXY)TETRADECYL)-2-(((3R)-1-OXO-3-((1-OXOHEXYL)OXY)TETRADECYL)AMINO)-4-O-PHOSPHONO-.BETA.-D-GLUCOPYRANOSYL)OXY)ETHYL)AMINO)-2-OXOETHYL)DODECYL ESTER; CRX-526; CRX526
|
| HS Tariff Code |
2934.99.9001
|
| 存储方式 |
Powder -20°C 3 years 4°C 2 years In solvent -80°C 6 months -20°C 1 month |
| 运输条件 |
Room temperature (This product is stable at ambient temperature for a few days during ordinary shipping and time spent in Customs)
|
| 溶解度 (体外实验) |
May dissolve in DMSO (in most cases), if not, try other solvents such as H2O, Ethanol, or DMF with a minute amount of products to avoid loss of samples
|
|---|---|
| 溶解度 (体内实验) |
注意: 如下所列的是一些常用的体内动物实验溶解配方,主要用于溶解难溶或不溶于水的产品(水溶度<1 mg/mL)。 建议您先取少量样品进行尝试,如该配方可行,再根据实验需求增加样品量。
注射用配方
注射用配方1: DMSO : Tween 80: Saline = 10 : 5 : 85 (如: 100 μL DMSO → 50 μL Tween 80 → 850 μL Saline)(IP/IV/IM/SC等) *生理盐水/Saline的制备:将0.9g氯化钠/NaCl溶解在100 mL ddH ₂ O中,得到澄清溶液。 注射用配方 2: DMSO : PEG300 :Tween 80 : Saline = 10 : 40 : 5 : 45 (如: 100 μL DMSO → 400 μL PEG300 → 50 μL Tween 80 → 450 μL Saline) 注射用配方 3: DMSO : Corn oil = 10 : 90 (如: 100 μL DMSO → 900 μL Corn oil) 示例: 以注射用配方 3 (DMSO : Corn oil = 10 : 90) 为例说明, 如果要配制 1 mL 2.5 mg/mL的工作液, 您可以取 100 μL 25 mg/mL 澄清的 DMSO 储备液,加到 900 μL Corn oil/玉米油中, 混合均匀。 View More
注射用配方 4: DMSO : 20% SBE-β-CD in Saline = 10 : 90 [如:100 μL DMSO → 900 μL (20% SBE-β-CD in Saline)] 口服配方
口服配方 1: 悬浮于0.5% CMC Na (羧甲基纤维素钠) 口服配方 2: 悬浮于0.5% Carboxymethyl cellulose (羧甲基纤维素) 示例: 以口服配方 1 (悬浮于 0.5% CMC Na)为例说明, 如果要配制 100 mL 2.5 mg/mL 的工作液, 您可以先取0.5g CMC Na并将其溶解于100mL ddH2O中,得到0.5%CMC-Na澄清溶液;然后将250 mg待测化合物加到100 mL前述 0.5%CMC Na溶液中,得到悬浮液。 View More
口服配方 3: 溶解于 PEG400 (聚乙二醇400) 请根据您的实验动物和给药方式选择适当的溶解配方/方案: 1、请先配制澄清的储备液(如:用DMSO配置50 或 100 mg/mL母液(储备液)); 2、取适量母液,按从左到右的顺序依次添加助溶剂,澄清后再加入下一助溶剂。以 下列配方为例说明 (注意此配方只用于说明,并不一定代表此产品 的实际溶解配方): 10% DMSO → 40% PEG300 → 5% Tween-80 → 45% ddH2O (或 saline); 假设最终工作液的体积为 1 mL, 浓度为5 mg/mL: 取 100 μL 50 mg/mL 的澄清 DMSO 储备液加到 400 μL PEG300 中,混合均匀/澄清;向上述体系中加入50 μL Tween-80,混合均匀/澄清;然后继续加入450 μL ddH2O (或 saline)定容至 1 mL; 3、溶剂前显示的百分比是指该溶剂在最终溶液/工作液中的体积所占比例; 4、 如产品在配制过程中出现沉淀/析出,可通过加热(≤50℃)或超声的方式助溶; 5、为保证最佳实验结果,工作液请现配现用! 6、如不确定怎么将母液配置成体内动物实验的工作液,请查看说明书或联系我们; 7、 以上所有助溶剂都可在 Invivochem.cn网站购买。 |
| 制备储备液 | 1 mg | 5 mg | 10 mg | |
| 1 mM | 0.7577 mL | 3.7886 mL | 7.5773 mL | |
| 5 mM | 0.1515 mL | 0.7577 mL | 1.5155 mL | |
| 10 mM | 0.0758 mL | 0.3789 mL | 0.7577 mL |
1、根据实验需要选择合适的溶剂配制储备液 (母液):对于大多数产品,InvivoChem推荐用DMSO配置母液 (比如:5、10、20mM或者10、20、50 mg/mL浓度),个别水溶性高的产品可直接溶于水。产品在DMSO 、水或其他溶剂中的具体溶解度详见上”溶解度 (体外)”部分;
2、如果您找不到您想要的溶解度信息,或者很难将产品溶解在溶液中,请联系我们;
3、建议使用下列计算器进行相关计算(摩尔浓度计算器、稀释计算器、分子量计算器、重组计算器等);
4、母液配好之后,将其分装到常规用量,并储存在-20°C或-80°C,尽量减少反复冻融循环。
计算结果:
工作液浓度: mg/mL;
DMSO母液配制方法: mg 药物溶于 μL DMSO溶液(母液浓度 mg/mL)。如该浓度超过该批次药物DMSO溶解度,请首先与我们联系。
体内配方配制方法:取 μL DMSO母液,加入 μL PEG300,混匀澄清后加入μL Tween 80,混匀澄清后加入 μL ddH2O,混匀澄清。
(1) 请确保溶液澄清之后,再加入下一种溶剂 (助溶剂) 。可利用涡旋、超声或水浴加热等方法助溶;
(2) 一定要按顺序加入溶剂 (助溶剂) 。