| 规格 | 价格 | 库存 | 数量 |
|---|---|---|---|
| 1mg |
|
||
| 5mg |
|
||
| 10mg |
|
||
| 25mg |
|
||
| 50mg | |||
| Other Sizes |
| 靶点 |
β-catenin-regulated transcription (CRT)
|
|---|---|
| 体外研究 (In Vitro) |
iCRT-5和PNU-75654对受刺激dc的免疫表型无不良影响。因此,在刺激过程中,iCRT5处理的dc与对照dc一样,具有相对较强的T细胞增殖。相比之下,在PNU-75654存在下刺激的DCs诱导的T细胞增殖比对照人群少,尽管OVA的摄取和加工增强。我们的研究结果表明,β-catenin抑制剂对受刺激的DCs的不同作用反映了脱靶效应。关于β-catenin抑制剂在肿瘤治疗中的潜在应用,iCRT-5可能是最有益的,因为它对受刺激的dc没有不利影响。[1]
研究人员证实,iCRTs(如iCRT5)以剂量依赖性的方式阻断Wnt/β-cat报告细胞活性,下调β-cat表达,抑制细胞增殖,最佳剂量接近15 μM。我们的数据进一步表明,在最佳剂量下,iCRTs不会影响Wnt通路上游组分DKK1的表达,这表明iCRTs可能特异性靶向MM细胞中的β-cat。此外,icrt处理MM细胞,与BMSC共培养,显示出对VEGF和细胞迁移的抑制作用。 结论:本研究首次提供了对新描述的iCRTs作为多发性骨髓瘤潜在Wnt-β-cat/VEGF通路拮抗剂的体外数据评估。[2] |
| 酶活实验 |
酶联免疫吸附法(ELISA)检测VEGF [2]
MM细胞(U266)按照前面章节的描述进行培养。本研究中使用的原代骨髓间充质干细胞是从患者身上获得的,并在Iscove改良的Dulbecco培养基中培养,培养基中含有20% FBS、2mm l -谷氨酰胺和5mg/ml青霉素/链霉素。从U266细胞中收集细胞培养基,与粘附的BMSCs(生长在6个孔板中)共培养,用iCRT-5处理,用于VEGF分析。ELISA检测采用Human VEGF Quantikine ELISA试剂盒,按照制造商的方案进行。这些检测采用定量夹心酶免疫分析技术。所得颜色在450nm处用酶联免疫吸附测定试剂盒Max-M2-读取。样品中VEGF的浓度通过插值由制造商提供的标准曲线来确定。实验一式三次,至少重复两次。 RNA分离与实时荧光定量PCR[2] 用Trizol试剂从iCRT-5(15µM)处理的MM细胞中提取总RNA,如前所述(20,)。一个两步rt - pcr进行总RNA(5µg)提取U266 BMSC处理50µMiCRT-5用于初始变性2分钟在95°C,继续放大一个扩展在72°C, 7分钟33周期使用VEGF gene-specific引物序列上5 'atttacaacgtctgc gcatctt 3“低,5 'ctcgccttgctgctctacctc3”的放大glyceraldehyde-3-phosphate脱氢酶(GAPDH),上部5 ' ggatgaccttgcccacagcct 3 '低,5 ‘ ’捕获ccccctctgctga ‘ ’作为内部控制(IDT)。实时定量PCR用智能循环器进行三次,使用SYBR-Green混合物,如我们之前所述。将结果归一化为GAPDH扩增,并根据2ΔΔCt确定折叠变化。 |
| 细胞实验 |
细胞增殖分析[2]< >
将活跃生长的细胞以5×105 /孔的密度在含有5-50µM iCRT-3或iCRT-5的100µl培养基中接种于96孔板中,一式三次,并用1% DMSO处理的细胞作为对照。处理48h后,使用MTS试剂盒进行细胞增殖分析。在490nm处使用96孔板读取吸光度。用GSK3β抑制剂LiCl(20µM)预处理细胞,作为Wnt激活的对照。与DMSO处理的细胞相比,通过490 nm处光密度的平均相对减少或增加来计算细胞生长;根据三次重复实验的平均值计算细胞增殖抑制率。
跨界迁移试验[2] 使用孔径为8µM的24孔BD FluoroBlok Transwell Inserts评估MM细胞的迁移率。简单地说,用icrt -3和iCRT-5(15µM)预处理的MM细胞(50,000个),用含有0.25%血清的RPMI培养基(200µl)播种到插入物中。底部井含有含有10% FBS的RPMI。孵育48 h后,在底孔中填入500µl按厂家说明配制的钙黄蛋白荧光染料。钙黄蛋白AM具有较低的细胞毒性,是最适合用于活细胞染色的指示剂。利用Max-M2-平板阅读器测量迁移细胞在540nm处发出的荧光强度。实验重复了三次。 Western blot分析[2] 未加或加iCRT-5(15µM)处理48h的MM细胞总蛋白裂解液(30µg/lane)在含有前面描述的蛋白酶抑制剂鸡尾酒的RIPA缓冲液(50 MM Tris, pH 7.4, 150 MM NaCl, 1 MM EDTA, 1% Triton X-100, 1%脱氧胆酸钠和0.1% SDS)中制备。使用抗β-catenin和DKK1的抗体,采用标准SDS-PAGE(12%)进行免疫印迹。此外,HEK 293细胞的蛋白样本被用来证实β-cat在非骨髓瘤细胞中的作用。使用增强型ECL化学发光检测试剂盒开发β-cat的反应蛋白条带。所有的印迹都被剥离,用α-微管蛋白重新探针,使蛋白负载正常化。每个实验使用同一组样品重复三次。用密度分析定量反应蛋白条带,用α-微管蛋白归一化计算折叠变化。 |
| 参考文献 | |
| 其他信息 |
Many tumors are characterized by mutation-induced constitutive activation of β-catenin which promotes tumor growth and survival. Consequently, the development of specific β-catenin inhibitors for tumor therapy has come into the focus of drug development. β-Catenin was also shown to contribute to the tolerance-promoting function of unstimulated dendritic cells (DCs). In response to activation, DCs acquire potent T cell stimulatory capacity and induce profound tumor antigen-specific immune responses. Here we asked for effects of pre-clinically established β-catenin inhibitors (CCT-031374, iCRT-5, PNU-75654) on mouse bone marrow-derived (BM)DCs. All three inhibitors moderately increased surface expression of MHCII, CD80, and CD86 on unstimulated DCs, but had no enhancing effect on their capacity to stimulate the proliferation of ovalbumin (OVA) specific CD4(+) T cells. CCT-031374 interfered with upregulation of costimulators (CD40, CD86) and cytokines (IL-1β, TNF-α, IL-6, IL-10, IL-12) by LPS-stimulated DCs. Accordingly, this DC population displayed an impaired CD4(+) T cell stimulatory activity. iCRT-5 and PNU-75654 had no detrimental effects on the immuno-phenotype of stimulated DCs. Hence, DCs treated with iCRT-5 in the course of stimulation exerted comparably strong T cell proliferation as did control DCs. In contrast, DCs stimulated in the presence of PNU-75654 induced less T cell proliferation than the control population despite enhanced uptake and processing of OVA. Our findings suggest that the differential effects of β-catenin inhibitors on stimulated DCs reflect off target effects. Concerning potential application of β-catenin inhibitors for tumor therapy, iCRT-5 may be most beneficial, since it did not exert detrimental effects on stimulated DCs.[1]
Background: Development and progression of multiple myeloma is dependent on the bone marrow (BM) microenvironment, and within the BM, a number of factors are secreted, including the Wnt ligands. Bone marrow stromal cells (BMSC) secrete Wnt ligands that activate Wnt signaling in multiple myeloma. The canonical Wnt pathway which is mediated through the transcriptional effector β-catenin (β-cat) is commonly de-regulated in many cancers. Cells with active β-cat-regulated transcription (CRT) are protected against apoptosis; conversely, inhibition of CRT may prevent cell proliferation. Materials and methods: In this study, we tested the efficacy of recently described inhibitors of CRT (iCRTs; oxazole and thiazole) for their selective antagonistic effect on Wnt-β-cat response in MM cells MM.1, U266, BMSC and primary BMMC obtained from patient samples (n=16). Results: We demonstrated that iCRTs we used, block Wnt/β-cat reporter activity, down regulate β-cat expression and inhibit cell proliferation in a dose-dependent manner with an optimal dose closer to 15 μM. Our data further indicate that iCRTs do not influence the expression of the upstream components of the Wnt pathway DKK1 at the optimal dose, suggesting that iCRTs may specifically target β-cat in MM cells. Additionally, iCRT-treatment of MM cells, co-cultured with BMSC, showed an inhibitory effect on VEGF and cell migration. Conclusion: This study provides the first in vitro data evaluation of newly-described iCRTs as potential Wnt-β-cat/VEGF pathway antagonists in multiple myeloma.[2] |
| 分子式 |
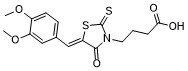
C16H17NO5S2
|
|---|---|
| 分子量 |
367.43
|
| 精确质量 |
367.055
|
| 元素分析 |
C, 52.30; H, 4.66; N, 3.81; O, 21.77; S, 17.45
|
| CAS号 |
18623-44-4
|
| PubChem CID |
1416325
|
| 外观&性状 |
Light yellow to yellow solid powder
|
| LogP |
2.707
|
| tPSA |
133.46
|
| 氢键供体(HBD)数目 |
1
|
| 氢键受体(HBA)数目 |
7
|
| 可旋转键数目(RBC) |
7
|
| 重原子数目 |
24
|
| 分子复杂度/Complexity |
537
|
| 定义原子立体中心数目 |
0
|
| SMILES |
COC1=C(C=C(C=C1)/C=C\2/C(=O)N(C(=S)S2)CCCC(=O)O)OC
|
| InChi Key |
IJWKSBPTJQMUHJ-LCYFTJDESA-N
|
| InChi Code |
InChI=1S/C16H17NO5S2/c1-21-11-6-5-10(8-12(11)22-2)9-13-15(20)17(16(23)24-13)7-3-4-14(18)19/h5-6,8-9H,3-4,7H2,1-2H3,(H,18,19)/b13-9-
|
| 化学名 |
4-[(5Z)-5-[(3,4-dimethoxyphenyl)methylidene]-4-oxo-2-sulfanylidene-1,3-thiazolidin-3-yl]butanoic acid
|
| 别名 |
iCRT 5; iCRT-5; iCRT5; 18623-44-4; iCRT-5; 4-[5-(3,4-Dimethoxy-benzylidene)-4-oxo-2-thioxo-thiazolidin-3-yl]-butyric acid; 4-(5-(3,4-Dimethoxybenzylidene)-4-oxo-2-thioxothiazolidin-3-yl)butanoic acid; 4-[(5Z)-5-[(3,4-dimethoxyphenyl)methylidene]-4-oxo-2-sulfanylidene-1,3-thiazolidin-3-yl]butanoic acid; (Z)-4-(5-(3,4-dimethoxybenzylidene)-4-oxo-2-thioxothiazolidin-3-yl)butanoic acid; CRT Inhibitor iCRT5; iCRT5
|
| HS Tariff Code |
2934.99.9001
|
| 存储方式 |
Powder -20°C 3 years 4°C 2 years In solvent -80°C 6 months -20°C 1 month |
| 运输条件 |
Room temperature (This product is stable at ambient temperature for a few days during ordinary shipping and time spent in Customs)
|
| 溶解度 (体外实验) |
DMSO : ~36 mg/mL (~97.98 mM)
|
|---|---|
| 溶解度 (体内实验) |
注意: 如下所列的是一些常用的体内动物实验溶解配方,主要用于溶解难溶或不溶于水的产品(水溶度<1 mg/mL)。 建议您先取少量样品进行尝试,如该配方可行,再根据实验需求增加样品量。
注射用配方
注射用配方1: DMSO : Tween 80: Saline = 10 : 5 : 85 (如: 100 μL DMSO → 50 μL Tween 80 → 850 μL Saline)(IP/IV/IM/SC等) *生理盐水/Saline的制备:将0.9g氯化钠/NaCl溶解在100 mL ddH ₂ O中,得到澄清溶液。 注射用配方 2: DMSO : PEG300 :Tween 80 : Saline = 10 : 40 : 5 : 45 (如: 100 μL DMSO → 400 μL PEG300 → 50 μL Tween 80 → 450 μL Saline) 注射用配方 3: DMSO : Corn oil = 10 : 90 (如: 100 μL DMSO → 900 μL Corn oil) 示例: 以注射用配方 3 (DMSO : Corn oil = 10 : 90) 为例说明, 如果要配制 1 mL 2.5 mg/mL的工作液, 您可以取 100 μL 25 mg/mL 澄清的 DMSO 储备液,加到 900 μL Corn oil/玉米油中, 混合均匀。 View More
注射用配方 4: DMSO : 20% SBE-β-CD in Saline = 10 : 90 [如:100 μL DMSO → 900 μL (20% SBE-β-CD in Saline)] 口服配方
口服配方 1: 悬浮于0.5% CMC Na (羧甲基纤维素钠) 口服配方 2: 悬浮于0.5% Carboxymethyl cellulose (羧甲基纤维素) 示例: 以口服配方 1 (悬浮于 0.5% CMC Na)为例说明, 如果要配制 100 mL 2.5 mg/mL 的工作液, 您可以先取0.5g CMC Na并将其溶解于100mL ddH2O中,得到0.5%CMC-Na澄清溶液;然后将250 mg待测化合物加到100 mL前述 0.5%CMC Na溶液中,得到悬浮液。 View More
口服配方 3: 溶解于 PEG400 (聚乙二醇400) 请根据您的实验动物和给药方式选择适当的溶解配方/方案: 1、请先配制澄清的储备液(如:用DMSO配置50 或 100 mg/mL母液(储备液)); 2、取适量母液,按从左到右的顺序依次添加助溶剂,澄清后再加入下一助溶剂。以 下列配方为例说明 (注意此配方只用于说明,并不一定代表此产品 的实际溶解配方): 10% DMSO → 40% PEG300 → 5% Tween-80 → 45% ddH2O (或 saline); 假设最终工作液的体积为 1 mL, 浓度为5 mg/mL: 取 100 μL 50 mg/mL 的澄清 DMSO 储备液加到 400 μL PEG300 中,混合均匀/澄清;向上述体系中加入50 μL Tween-80,混合均匀/澄清;然后继续加入450 μL ddH2O (或 saline)定容至 1 mL; 3、溶剂前显示的百分比是指该溶剂在最终溶液/工作液中的体积所占比例; 4、 如产品在配制过程中出现沉淀/析出,可通过加热(≤50℃)或超声的方式助溶; 5、为保证最佳实验结果,工作液请现配现用! 6、如不确定怎么将母液配置成体内动物实验的工作液,请查看说明书或联系我们; 7、 以上所有助溶剂都可在 Invivochem.cn网站购买。 |
| 制备储备液 | 1 mg | 5 mg | 10 mg | |
| 1 mM | 2.7216 mL | 13.6080 mL | 27.2161 mL | |
| 5 mM | 0.5443 mL | 2.7216 mL | 5.4432 mL | |
| 10 mM | 0.2722 mL | 1.3608 mL | 2.7216 mL |
1、根据实验需要选择合适的溶剂配制储备液 (母液):对于大多数产品,InvivoChem推荐用DMSO配置母液 (比如:5、10、20mM或者10、20、50 mg/mL浓度),个别水溶性高的产品可直接溶于水。产品在DMSO 、水或其他溶剂中的具体溶解度详见上”溶解度 (体外)”部分;
2、如果您找不到您想要的溶解度信息,或者很难将产品溶解在溶液中,请联系我们;
3、建议使用下列计算器进行相关计算(摩尔浓度计算器、稀释计算器、分子量计算器、重组计算器等);
4、母液配好之后,将其分装到常规用量,并储存在-20°C或-80°C,尽量减少反复冻融循环。
计算结果:
工作液浓度: mg/mL;
DMSO母液配制方法: mg 药物溶于 μL DMSO溶液(母液浓度 mg/mL)。如该浓度超过该批次药物DMSO溶解度,请首先与我们联系。
体内配方配制方法:取 μL DMSO母液,加入 μL PEG300,混匀澄清后加入μL Tween 80,混匀澄清后加入 μL ddH2O,混匀澄清。
(1) 请确保溶液澄清之后,再加入下一种溶剂 (助溶剂) 。可利用涡旋、超声或水浴加热等方法助溶;
(2) 一定要按顺序加入溶剂 (助溶剂) 。