| 规格 | 价格 | |
|---|---|---|
| 500mg | ||
| 1g | ||
| Other Sizes |
| 靶点 |
Calpain
|
|---|---|
| 酶活实验 |
蛋白酶活性测定[1]
使用标准的蛋白水解荧光活性测定法评估肽结合和随后抑制半胱氨酸蛋白酶的能力。使用先前发表的肽底物使用标准供体-猝灭策略测定抑制作用。 Calpain-1酶浓度为25 nM。木瓜蛋白酶酶浓度为25 nM。组织蛋白酶B和组织蛋白酶L的酶浓度为3 nM。Calpain和木瓜蛋白酶缓冲液含有10 mM二硫代糖醇(DTT)、100 mM KCl、2 mM EGTA、50 mM Tris-HCl (pH 7.5)和0.015% Brij-35。钙蛋白酶和木瓜蛋白酶的底物浓度为0.25µM H-Glu(Edans)- pro - leu - phe - Ala-Glu-Arg-Lys(Dabcyl)- oh (Km计算见辅助信息,图S8和S10)。组织蛋白酶缓冲液含有10 mM DTT, 500 mM醋酸钠(pH 5.5)和4 mM EGTA。组织蛋白酶的底物浓度为0.25µM Z-FR-Amc。Calpain通过注射终浓度为5mm的CaCl2来激活。木瓜蛋白酶和组织蛋白酶通过多通道移液管加入底物来激活。每次检测使用不同浓度的抑制剂(1-100µM)。所有检测均在96孔板中总孔体积为100µL的条件下进行,每孔含有单独的抑制剂浓度。荧光在Berthold三星荧光仪上读取。H-Glu(Edans)- pro - leu - phee - ala - glu - arg - lys (Dabcyl)-OH的激发波长为380 nm,发射波长为500 nm。Z-FR-Amc的激发波长为351 nm,发射波长为430 nm。 3c 对Calpain-1的动力学分析[1] 为了确定抑制类型,我们采用标准的Michaelis-Menten治疗。初始速度(从过程曲线的线性段得到)与底物浓度对应。由于进展曲线第一段的线性,我们认为前500秒的自蛋白水解不足以阻止简单的Michaelis-Menten动力学的使用,即酶的损失不会改变速度到足以使其偏离线性,并且加入这个额外的复合物会使动力学严重复杂化。以RFU/秒为单位确定速度,然后使用转换因子1386 RFU/µM转换为µM/秒。转化因子由底物H-Glu(Edans)- pro - leu - ph - ala - glu - arg - lys (Dabcyl)- OH在已知浓度下被木瓜蛋白酶全水解得到。为了避免加权误差,我们使用了Kmapp和Vmaxapp的值,这些值直接由未转换数据的非线性最小二乘最佳拟合确定,并将这些值放入倒数方程中: 酶IC50的测定[1] 生成IC50曲线,从各自的进程曲线中确定每种抑制剂浓度下酶的初始速率。以已知浓度的木瓜蛋白酶对底物H-E(Edans)-PLFAER-K(Dabcyl)-OH进行全水解,得到转化因子(1386 RFU/µM)。初始速度由RFU/sec转换为µM/sec。通过将每个抑制剂浓度下的初始速度除以未抑制酶的初始速度来计算分数活性。在500秒之前获得的数据用于初始速率计算。然后根据抑制剂浓度的对数绘制初始速率,并通过GraphPad Prism计算IC50。 基于活动的探针连接器实验[1] 实验条件为10 mM二硫代糖醇(DTT), 1.5µg calpain, 100 mM KCl, 2 mM EGTA, 50 mM Tris-HCl (pH 7.5), 0.015% Brij-35, 1µM或10µM生物素化探针(DCG-04, NM-01, NM-02, NM-03)。在含有1µM ABP或10µM ABP的试管中加入3.33µM的50 mM CaCl2,最终浓度为8.3 mM的钙来激活Calpain。作为阴性对照,在含有10µM探针的Calpain溶液中加入水而不是CaCl2。在室温下,让探针与钙蛋白酶结合20分钟。加入10µL NuPage®LDS运行缓冲液(Life Technologies, Grand Island, NY)停止反应。每种标记酶10µL上载于10% Bis-Tris NuPAGE®凝胶上,140 V凝胶电泳1.5 h。然后将条带在30 V下转移到PVDF膜上70分钟。使用Vectastain®Elite®ABC试剂盒阻断并印迹膜。柯达胶卷暴露在膜上显影。 |
| 参考文献 | |
| 其他信息 |
We have designed a highly specific inhibitor of calpain by mimicking a natural protein-protein interaction between calpain and its endogenous inhibitor calpastatin. To enable this goal we established a new method of stabilizing an α-helix in a small peptide by screening 24 commercially available cross-linkers for successful cysteine alkylation in a model peptide sequence. The effects of cross-linking on the α-helicity of selected peptides were examined by CD and NMR spectroscopy, and revealed structurally rigid cross-linkers to be the best at stabilizing α-helices. We applied this strategy to the design of inhibitors of calpain that are based on calpastatin, an intrinsically unstable polypeptide that becomes structured upon binding to the enzyme. A two-turn α-helix that binds proximal to the active site cleft was stabilized, resulting in a potent and selective inhibitor for calpain. We further expanded the utility of this inhibitor by developing irreversible calpain family activity-based probes (ABPs), which retained the specificity of the stabilized helical inhibitor. We believe the inhibitor and ABPs will be useful for future investigation of calpains, while the cross-linking technique will enable exploration of other protein-protein interactions. [1]
|
| 分子式 |
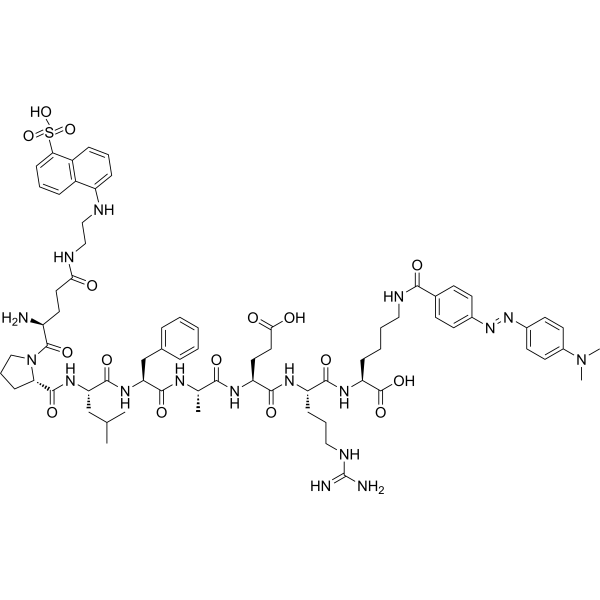
C72H97N17O16S
|
|---|---|
| 分子量 |
1488.71
|
| 精确质量 |
1487.702
|
| CAS号 |
1914987-47-5
|
| PubChem CID |
131698206
|
| 序列 |
{Glu(EDANS)}-Pro-Leu-Phe-Ala-Glu-Arg-{Lys(DABCYL)}
|
| 短序列 |
EPLFAERX; {Glu(EDANS)}-PLFAER-{Lys(DABCYL)}
|
| 外观&性状 |
Typically exists as solid at room temperature
|
| 密度 |
1.4±0.1 g/cm3
|
| 折射率 |
1.658
|
| LogP |
4.59
|
| tPSA |
521
|
| 氢键供体(HBD)数目 |
15
|
| 氢键受体(HBA)数目 |
23
|
| 可旋转键数目(RBC) |
43
|
| 重原子数目 |
106
|
| 分子复杂度/Complexity |
3080
|
| 定义原子立体中心数目 |
8
|
| SMILES |
S(C1C=CC=C2C=1C=CC=C2NCCN[C@H](C(N1CCC[C@H]1C(N[C@H](C(N[C@H](C(N[C@H](C(N[C@H](C(N[C@H](C(N[C@H](C(O)=O)CCCCNC(=O)C1C=CC(N=NC2C=CC(N(C)C)=CC=2)=CC=1)=O)CCCNC(=N)N)=O)CCC(=O)O)=O)C)=O)CC1C=CC=CC=1)=O)CC(C)C)=O)=O)CCC(=O)N)(O)(=O)=O
|
| InChi Key |
ZBTCIQPDYVIPOU-DAPRKCRDSA-N
|
| InChi Code |
InChI=1S/C72H97N17O16S/c1-43(2)41-57(84-69(100)59-22-14-40-89(59)70(101)55(33-35-62(92)93)87-106(104,105)60-23-12-17-50-51(60)18-11-20-52(50)76-39-36-73)68(99)83-58(42-45-15-7-6-8-16-45)67(98)79-44(3)63(94)80-54(32-34-61(90)91)66(97)81-53(21-13-38-78-72(74)75)65(96)82-56(71(102)103)19-9-10-37-77-64(95)46-24-26-47(27-25-46)85-86-48-28-30-49(31-29-48)88(4)5/h6-8,11-12,15-18,20,23-31,43-44,53-59,76,87H,9-10,13-14,19,21-22,32-42,73H2,1-5H3,(H,77,95)(H,79,98)(H,80,94)(H,81,97)(H,82,96)(H,83,99)(H,84,100)(H,90,91)(H,92,93)(H,102,103)(H4,74,75,78)/t44-,53-,54-,55-,56-,57-,58-,59-/m0/s1
|
| 化学名 |
(2S)-2-[[(2S)-2-[[(2S)-2-[[(2S)-2-[[(2S)-2-[[(2S)-2-[[(2S)-1-[(2S)-2-[[5-(2-aminoethylamino)naphthalen-1-yl]sulfonylamino]-4-carboxybutanoyl]pyrrolidine-2-carbonyl]amino]-4-methylpentanoyl]amino]-3-phenylpropanoyl]amino]propanoyl]amino]-4-carboxybutanoyl]amino]-5-(diaminomethylideneamino)pentanoyl]amino]-6-[[4-[[4-(dimethylamino)phenyl]diazenyl]benzoyl]amino]hexanoic acid
|
| 别名 |
H-Glu(EDANS)-Pro-Leu-Phe-Ala-Glu-Arg-Lys(DABCYL)-OH; 1914987-47-5;
|
| HS Tariff Code |
2934.99.9001
|
| 存储方式 |
Powder -20°C 3 years 4°C 2 years In solvent -80°C 6 months -20°C 1 month |
| 运输条件 |
Room temperature (This product is stable at ambient temperature for a few days during ordinary shipping and time spent in Customs)
|
| 溶解度 (体内实验) |
注意: 如下所列的是一些常用的体内动物实验溶解配方,主要用于溶解难溶或不溶于水的产品(水溶度<1 mg/mL)。 建议您先取少量样品进行尝试,如该配方可行,再根据实验需求增加样品量。
注射用配方
注射用配方1: DMSO : Tween 80: Saline = 10 : 5 : 85 (如: 100 μL DMSO → 50 μL Tween 80 → 850 μL Saline)(IP/IV/IM/SC等) *生理盐水/Saline的制备:将0.9g氯化钠/NaCl溶解在100 mL ddH ₂ O中,得到澄清溶液。 注射用配方 2: DMSO : PEG300 :Tween 80 : Saline = 10 : 40 : 5 : 45 (如: 100 μL DMSO → 400 μL PEG300 → 50 μL Tween 80 → 450 μL Saline) 注射用配方 3: DMSO : Corn oil = 10 : 90 (如: 100 μL DMSO → 900 μL Corn oil) 示例: 以注射用配方 3 (DMSO : Corn oil = 10 : 90) 为例说明, 如果要配制 1 mL 2.5 mg/mL的工作液, 您可以取 100 μL 25 mg/mL 澄清的 DMSO 储备液,加到 900 μL Corn oil/玉米油中, 混合均匀。 View More
注射用配方 4: DMSO : 20% SBE-β-CD in Saline = 10 : 90 [如:100 μL DMSO → 900 μL (20% SBE-β-CD in Saline)] 口服配方
口服配方 1: 悬浮于0.5% CMC Na (羧甲基纤维素钠) 口服配方 2: 悬浮于0.5% Carboxymethyl cellulose (羧甲基纤维素) 示例: 以口服配方 1 (悬浮于 0.5% CMC Na)为例说明, 如果要配制 100 mL 2.5 mg/mL 的工作液, 您可以先取0.5g CMC Na并将其溶解于100mL ddH2O中,得到0.5%CMC-Na澄清溶液;然后将250 mg待测化合物加到100 mL前述 0.5%CMC Na溶液中,得到悬浮液。 View More
口服配方 3: 溶解于 PEG400 (聚乙二醇400) 请根据您的实验动物和给药方式选择适当的溶解配方/方案: 1、请先配制澄清的储备液(如:用DMSO配置50 或 100 mg/mL母液(储备液)); 2、取适量母液,按从左到右的顺序依次添加助溶剂,澄清后再加入下一助溶剂。以 下列配方为例说明 (注意此配方只用于说明,并不一定代表此产品 的实际溶解配方): 10% DMSO → 40% PEG300 → 5% Tween-80 → 45% ddH2O (或 saline); 假设最终工作液的体积为 1 mL, 浓度为5 mg/mL: 取 100 μL 50 mg/mL 的澄清 DMSO 储备液加到 400 μL PEG300 中,混合均匀/澄清;向上述体系中加入50 μL Tween-80,混合均匀/澄清;然后继续加入450 μL ddH2O (或 saline)定容至 1 mL; 3、溶剂前显示的百分比是指该溶剂在最终溶液/工作液中的体积所占比例; 4、 如产品在配制过程中出现沉淀/析出,可通过加热(≤50℃)或超声的方式助溶; 5、为保证最佳实验结果,工作液请现配现用! 6、如不确定怎么将母液配置成体内动物实验的工作液,请查看说明书或联系我们; 7、 以上所有助溶剂都可在 Invivochem.cn网站购买。 |
|---|
| 制备储备液 | 1 mg | 5 mg | 10 mg | |
| 1 mM | 0.6717 mL | 3.3586 mL | 6.7172 mL | |
| 5 mM | 0.1343 mL | 0.6717 mL | 1.3434 mL | |
| 10 mM | 0.0672 mL | 0.3359 mL | 0.6717 mL |
1、根据实验需要选择合适的溶剂配制储备液 (母液):对于大多数产品,InvivoChem推荐用DMSO配置母液 (比如:5、10、20mM或者10、20、50 mg/mL浓度),个别水溶性高的产品可直接溶于水。产品在DMSO 、水或其他溶剂中的具体溶解度详见上”溶解度 (体外)”部分;
2、如果您找不到您想要的溶解度信息,或者很难将产品溶解在溶液中,请联系我们;
3、建议使用下列计算器进行相关计算(摩尔浓度计算器、稀释计算器、分子量计算器、重组计算器等);
4、母液配好之后,将其分装到常规用量,并储存在-20°C或-80°C,尽量减少反复冻融循环。
计算结果:
工作液浓度: mg/mL;
DMSO母液配制方法: mg 药物溶于 μL DMSO溶液(母液浓度 mg/mL)。如该浓度超过该批次药物DMSO溶解度,请首先与我们联系。
体内配方配制方法:取 μL DMSO母液,加入 μL PEG300,混匀澄清后加入μL Tween 80,混匀澄清后加入 μL ddH2O,混匀澄清。
(1) 请确保溶液澄清之后,再加入下一种溶剂 (助溶剂) 。可利用涡旋、超声或水浴加热等方法助溶;
(2) 一定要按顺序加入溶剂 (助溶剂) 。