| 规格 | 价格 | 库存 | 数量 |
|---|---|---|---|
| 5mg |
|
||
| 10mg |
|
||
| Other Sizes |
|
| 靶点 |
SST2 (IC50 = 0.26 nM); SST5 (IC50 = 6.92 nM)
|
|---|---|
| 体外研究 (In Vitro) |
当氚在 CHO hsst2 细胞上释放时,血管肽素(0.1 nM–10 μM;持续 1 小时)TFA 作为部分激动剂 (pEC50=6.57),在 3 μM 时最大响应为 423%[2]。
1.检测了生长抑素和稳定的八肽类似物奥曲肽和Angiopepsin刺激表达人重组sst(2)、sst(3)或sst(5)受体的[(3)H]-花生四烯酸预加载CHO-K1细胞释放氚的能力。2.生长抑素通过sst(2)(7.8+/-0.1)和sst(5)(7.3+/-0.2)刺激氚释放(pEC(50)),但不刺激sst(3)受体。奥曲肽表现为完全激动剂(sst(2)受体)或部分激动剂(sst(5)受体),而Angiopepsin在这两种受体类型上表现为弱部分激动剂。3.百日咳毒素显著降低了通过两种受体类型对生长抑素的最大反应,而pEC(50)估计值不受影响。4.据报道,选择性抑制剂抑制MEK1或Src,但不抑制PKA、PI 3激酶或酪氨酸激酶,可以降低生长抑素介导的sst(2)反应,但不能降低Angiopepsin/血管肽。PKC的选择性抑制剂(Ro-31-8220)降低了生长抑素和血管肽的反应。5.这些数据为生长抑素合成肽的部分激动剂活性提供了进一步的证据。此外,介导花生四烯酸动员的生长抑素受体信号机制似乎是多种复杂的[2]。 生长抑素肽类似物对[3H]-花生四烯酸预载CHO-K1细胞氚释放的影响[2] 在CHO h sst2细胞中,生长抑素以浓度依赖的方式刺激氚的释放,pEC50为7.8±0.13,最大刺激比基础水平高985±91%(图1A)。奥曲肽在1时未达到最大反应 μM,尽管在该浓度下的反应(827±25%;估计的pEC50值为6.33±0.23)与生长抑素的反应没有显著差异(P>0.05)。相比之下,Angiopepsin(pEC50,6.57±0.15)作为部分激动剂,在3℃时的最大反应为423±111% μM(图1A)。生长抑素(31±13%)、Angiopepsin/血管肽(13±22%)或奥曲肽(22±41%)在浓度高达10 μM(图1B)。在CHO h sst5细胞中,生长抑素刺激氚释放(pEC50,7.29±0.17;最大反应221±8%)。奥曲肽也刺激氚的释放(pEC50,7.44±0.29),但产生的最大刺激作用低于生长抑素(123±44%)(P<0.05)。Angiopeptin对氚的释放没有显著刺激作用(10℃时为42±27%) μM;图1C)。表1总结了CHO h sst2或CHO h sst5细胞获得的估计pEC50值、最大刺激和Hill斜率。 为了确定CHO h sst2细胞中血管肽的部分激动作用是否是由于其无法刺激与特定G蛋白的偶联,我们研究了百日咳毒素对血管肽释放氚能力的影响。百日咳毒素治疗前后血管肽的效力(pEC50值)相似(分别为6.40±0.18和6.01±0.36),但最大反应显著降低(分别为474±104%和230±26%;P<0.05;图2A)。 通过sst2受体释放氚的机制[2] 进一步研究了生长抑素通过sst2受体刺激氚释放的机制。奎纳克林(1或10 μM),PLA2或PGE2的非选择性抑制剂(1 nM至10 μM)对基础或生长抑素(1μM)刺激的氚释放没有影响(值见表2)。选择性MEK1抑制剂PD 98059(40μM)对基础氚释放没有影响(分别为8.5±1.1%和9.3±1.2%;值表示为1 μM生长抑素反应),但将生长抑素(1μM)刺激的氚释放降低到61.9±3.0%(图3A)。更高浓度的PD 98059(60μM)没有进一步的影响(数据未显示)。令人惊讶的是,PD 98059不影响CHO h sst2细胞对部分激动剂Angiopepsin的反应(分别为42.5±10.4%和50.1±3.4%)。用百日咳毒素预处理CHO h sst2细胞后,生长抑素(34.1±2.5%)或血管肽(20.4±1.9%)刺激氚释放的能力不受PD 98059化合物的影响(分别为33.1±1.0%和25.2±0.8%;图3A)。 与PD 98059类似,Src的选择性抑制剂PP1(200 nM)对氚的基础释放没有影响(PP1前后分别为7.1±0.9%和11.0±3.7%),但抑制了生长抑素(1μM)刺激的释放(分别为100%和64.0±1.7%;图3B)。相比之下,PP1对Angiopepsin(1μM)的反应不受影响(分别为42.5±10.4%和51.7±10.8%)。在百日咳毒素存在的情况下,生长抑素和血管肽刺激的氚释放(分别为26.8±3.7%和17.7±2.2%)不受PP1的影响(分别为34.0±1.7%和18.4±0.8%;图3B)。 在PD 98059和PP1联合存在的情况下,生长抑素刺激的氚释放减少到65.6±3.4%,与单独使用任何一种抑制剂对生长抑素反应的影响没有区别(见上文)。正如预期的那样,百日咳毒素预处理后,两种抑制剂联合对生长抑素的抑制作用被消除(数据未显示)。 染料木素(10μM),一种蛋白酪氨酸激酶的非选择性抑制剂,LY 294004(1μM)是一种选择性PI 3-激酶抑制剂,腺苷酸环化酶激活剂,福司克林(10μM)和PKA抑制剂酰胺14 – 22 (1 μM),对生长抑素或血管内皮素的反应均无影响(值如表2所示)。 百日咳毒素预处理前(5.6±0.4%)或后(6.8±0.2%)的基础氚释放不受蛋白激酶C(PKC)抑制剂Ro-31-8220(1μM;分别为5.1±0.1%和4.3±0.2%)。在百日咳毒素预处理存在和不存在的情况下,Ro-31-8220均降低了对生长抑素(分别为100%和28.3±0.6)或血管肽(分别为43.2±1.0%和17.1±1.3)的反应(生长抑素分别为65.9±1.3%和13.8±0.5%;血管肽分别为31.6±1.0%和9.5±1.1%;图4)。 |
| 体内研究 (In Vivo) |
血管肽素(20 和 50μg/kg;ih)TFA 会极大地抑制新内膜发育[1]。在同种异体心脏移植物中,血管肽素(20 μg/kg;每日)TFA 可显着降低冠状动脉肌内膜细胞的增殖约 50%[1]。
血管平滑肌细胞增生是各种动物模型动脉粥样硬化的主要组成部分。Angiopsin是生长抑素的环八肽类似物,可显著抑制大鼠颈动脉、兔主动脉和髂动脉以及移植兔心脏冠状动脉内皮细胞损伤后的肌内膜增殖。Angiopepsin不影响非人灵长类动物的血脂谱。因此,其抗增殖作用不太可能是由胆固醇代谢的改变介导的。血管肽和生长抑素的其他肽类似物是生长激素释放和胰岛素样生长因子-1产生的强效抑制剂。然而,体内抑制平滑肌细胞增殖并不是所有生长抑素类似物的共同特性。这表明血浆生长激素和生长激素依赖性胰岛素样生长因子-1的产生不是体内肌内膜增殖的生理刺激。Angiopeptin抑制3H-胸苷掺入大鼠颈动脉外植体,表明其对调节细胞生长的自分泌或旁分泌机制具有局部作用。鉴于其对平滑肌细胞复制的强效抑制作用,血管肽可能在预防经皮冠状动脉腔内成形术后再狭窄和预防心脏移植后冠状动脉粥样硬化加速方面具有临床应用价值。 |
| 细胞实验 |
[3H]-花生四烯酸测定[2]
将细胞以5×104的密度接种到24孔板中,并用0.5 μCi 在正常细胞培养基中加入[5,6,8,9,11,12,14-15-3H]-花生四烯酸(215 Ci mmol−1)的ml−1 18 h实验使用前。花生四烯酸被迅速吸收并几乎完全储存在磷脂中(见Washizaki等人,1994)。然后用20毫升洗涤细胞四次 mM HEPES缓冲克雷布斯(mM : 氯化钠125;氯化钾5.4;碳酸氢钠16.2;D-葡萄糖5.5;肝炎20;NaH2PO4 1和CaCl2 1.3,pH 7.4),补充0.1%无蛋白酶BSA,在37°C下平衡10分钟 min。去除洗涤缓冲液,用含有不同激动剂浓度的新鲜缓冲液(1ml)代替。然后取出一份(600μl)缓冲液,在加入2 毫升Ultima Gold XR闪烁剂。在测定百日咳毒素作用的实验中,毒素与[3H]-花生四烯酸同时加入。对研究氚释放对各种酶抑制剂敏感性的实验进行了修改,包括120 在37°C下,在相关酶抑制剂存在或不存在(对照)的情况下,对细胞进行最小预孵育。预孵育后,移除缓冲液,用含有酶抑制剂±1的新鲜缓冲液替换 μM生长抑素(每种酶浓度的基础和激动剂刺激的氚释放)。
|
| 参考文献 | |
| 其他信息 |
Although animal models of myointimal proliferation, such as balloon-induced endotheliat injury of normat arterial segments. are “artitkiat” by definition and do not exactly reproduce the clinical situation present at the time of angioplasty or atherectomy. they do provide valuable insights into potential mechanisms of cell gmwlh regulation. We have demonstrated that angiqeptin is a potent inhibitor of myw intimal proliferation in response to two extremely di&xent types of injury in viva (namely. balloon-induced eodothetial cell denudation in the rat and rabbit models and immune injury in the rabbit transplant model of atherosclerosis). Whether this success in the animal laboratory will translate into clinical success, preventing restenosis atIer ansioplarty or atherectomy. needs to be determined in a controlled clinical trial. A multicenter double-blind controlled clinical trial that will examine the e&t of angiopeptin on restenosis after coronary angioplasty has recently begun in the United States. It is hoped that the results of this trial will provide further insight into the phenomenon of myointimal proliieration. [1]
|
| 分子式 |
C59H74F6N10O14S2
|
|---|---|
| 分子量 |
1325.40
|
| 精确质量 |
1325.468
|
| CAS号 |
2478421-60-0
|
| 相关CAS号 |
Angiopeptin;113294-82-9
|
| PubChem CID |
162678807
|
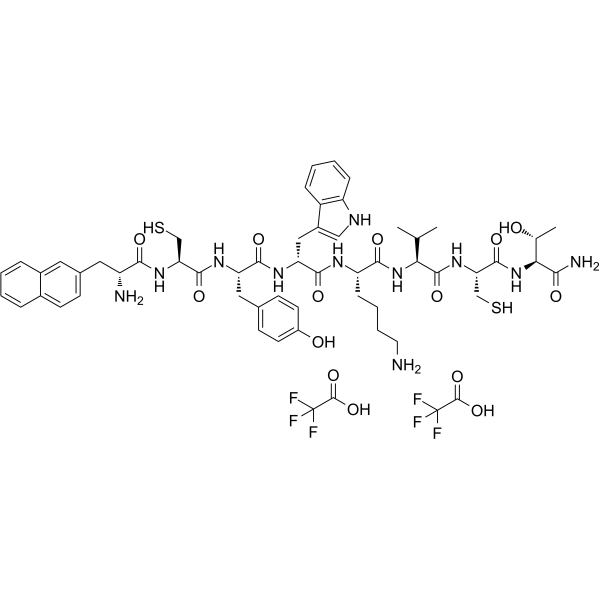
| 序列 |
H-D-2Nal-Cys-Tyr-D-Trp-Lys-Val-Cys-Thr-NH2.2TFA; 3-(2-naphthyl)-D-alanyl-L-cysteinyl-L-tyrosyl-D-tryptophyl-L-lysyl-L-valyl-L-cysteinyl-L-threoninamide trifluoroacetic acid;
|
| 短序列 |
{Nal}CYWKVCT-NH2; XCYWKVCT
|
| 外观&性状 |
White to off-white solid powder
|
| tPSA |
432
|
| 氢键供体(HBD)数目 |
17
|
| 氢键受体(HBA)数目 |
24
|
| 可旋转键数目(RBC) |
29
|
| 重原子数目 |
91
|
| 分子复杂度/Complexity |
2050
|
| 定义原子立体中心数目 |
9
|
| SMILES |
C1C=C(O)C=CC=1C[C@H](NC([C@@H](NC(=O)[C@H](N)CC1=CC2C=CC=CC=2C=C1)CS)=O)C(=O)N[C@@H](C(N[C@H](C(=O)N[C@H](C(N[C@@H](CS)C(=O)N[C@@H]([C@@H](C)O)C(N)=O)=O)C(C)C)CCCCC)=O)CC1C2=CC=CC=C2NC=1.OC(=O)C(F)(F)F.OC(=O)C(F)(F)F
|
| InChi Key |
PLVCOVWXYIMTNV-XCNZXRHRSA-N
|
| InChi Code |
InChI=1S/C54H71N11O10S2.2C2HF3O2/c1-29(2)45(54(75)63-44(28-77)53(74)65-46(30(3)66)47(57)68)64-49(70)40(14-8-9-21-55)59-51(72)42(25-35-26-58-39-13-7-6-12-37(35)39)61-50(71)41(24-31-16-19-36(67)20-17-31)60-52(73)43(27-76)62-48(69)38(56)23-32-15-18-33-10-4-5-11-34(33)22-32;2*3-2(4,5)1(6)7/h4-7,10-13,15-20,22,26,29-30,38,40-46,58,66-67,76-77H,8-9,14,21,23-25,27-28,55-56H2,1-3H3,(H2,57,68)(H,59,72)(H,60,73)(H,61,71)(H,62,69)(H,63,75)(H,64,70)(H,65,74);2*(H,6,7)/t30-,38-,40+,41+,42-,43+,44+,45+,46+;;/m1../s1
|
| 化学名 |
(2S)-6-amino-N-[(2S)-1-[[(2R)-1-[[(2S,3R)-1-amino-3-hydroxy-1-oxobutan-2-yl]amino]-1-oxo-3-sulfanylpropan-2-yl]amino]-3-methyl-1-oxobutan-2-yl]-2-[[(2R)-2-[[(2S)-2-[[(2R)-2-[[(2R)-2-amino-3-naphthalen-2-ylpropanoyl]amino]-3-sulfanylpropanoyl]amino]-3-(4-hydroxyphenyl)propanoyl]amino]-3-(1H-indol-3-yl)propanoyl]amino]hexanamide;2,2,2-trifluoroacetic acid
|
| 别名 |
Angiopeptin TFA; Angiopeptin (TFA); 2478421-60-0;
|
| HS Tariff Code |
2934.99.9001
|
| 存储方式 |
Powder -20°C 3 years 4°C 2 years In solvent -80°C 6 months -20°C 1 month 注意: 请将本产品存放在密封且受保护的环境中,避免吸湿/受潮。 |
| 运输条件 |
Room temperature (This product is stable at ambient temperature for a few days during ordinary shipping and time spent in Customs)
|
| 溶解度 (体外实验) |
H2O: 10 mg/mL (7.54 mM)
|
|---|---|
| 溶解度 (体内实验) |
注意: 如下所列的是一些常用的体内动物实验溶解配方,主要用于溶解难溶或不溶于水的产品(水溶度<1 mg/mL)。 建议您先取少量样品进行尝试,如该配方可行,再根据实验需求增加样品量。
注射用配方
注射用配方1: DMSO : Tween 80: Saline = 10 : 5 : 85 (如: 100 μL DMSO → 50 μL Tween 80 → 850 μL Saline)(IP/IV/IM/SC等) *生理盐水/Saline的制备:将0.9g氯化钠/NaCl溶解在100 mL ddH ₂ O中,得到澄清溶液。 注射用配方 2: DMSO : PEG300 :Tween 80 : Saline = 10 : 40 : 5 : 45 (如: 100 μL DMSO → 400 μL PEG300 → 50 μL Tween 80 → 450 μL Saline) 注射用配方 3: DMSO : Corn oil = 10 : 90 (如: 100 μL DMSO → 900 μL Corn oil) 示例: 以注射用配方 3 (DMSO : Corn oil = 10 : 90) 为例说明, 如果要配制 1 mL 2.5 mg/mL的工作液, 您可以取 100 μL 25 mg/mL 澄清的 DMSO 储备液,加到 900 μL Corn oil/玉米油中, 混合均匀。 View More
注射用配方 4: DMSO : 20% SBE-β-CD in Saline = 10 : 90 [如:100 μL DMSO → 900 μL (20% SBE-β-CD in Saline)] 口服配方
口服配方 1: 悬浮于0.5% CMC Na (羧甲基纤维素钠) 口服配方 2: 悬浮于0.5% Carboxymethyl cellulose (羧甲基纤维素) 示例: 以口服配方 1 (悬浮于 0.5% CMC Na)为例说明, 如果要配制 100 mL 2.5 mg/mL 的工作液, 您可以先取0.5g CMC Na并将其溶解于100mL ddH2O中,得到0.5%CMC-Na澄清溶液;然后将250 mg待测化合物加到100 mL前述 0.5%CMC Na溶液中,得到悬浮液。 View More
口服配方 3: 溶解于 PEG400 (聚乙二醇400) 请根据您的实验动物和给药方式选择适当的溶解配方/方案: 1、请先配制澄清的储备液(如:用DMSO配置50 或 100 mg/mL母液(储备液)); 2、取适量母液,按从左到右的顺序依次添加助溶剂,澄清后再加入下一助溶剂。以 下列配方为例说明 (注意此配方只用于说明,并不一定代表此产品 的实际溶解配方): 10% DMSO → 40% PEG300 → 5% Tween-80 → 45% ddH2O (或 saline); 假设最终工作液的体积为 1 mL, 浓度为5 mg/mL: 取 100 μL 50 mg/mL 的澄清 DMSO 储备液加到 400 μL PEG300 中,混合均匀/澄清;向上述体系中加入50 μL Tween-80,混合均匀/澄清;然后继续加入450 μL ddH2O (或 saline)定容至 1 mL; 3、溶剂前显示的百分比是指该溶剂在最终溶液/工作液中的体积所占比例; 4、 如产品在配制过程中出现沉淀/析出,可通过加热(≤50℃)或超声的方式助溶; 5、为保证最佳实验结果,工作液请现配现用! 6、如不确定怎么将母液配置成体内动物实验的工作液,请查看说明书或联系我们; 7、 以上所有助溶剂都可在 Invivochem.cn网站购买。 |
| 制备储备液 | 1 mg | 5 mg | 10 mg | |
| 1 mM | 0.7545 mL | 3.7724 mL | 7.5449 mL | |
| 5 mM | 0.1509 mL | 0.7545 mL | 1.5090 mL | |
| 10 mM | 0.0754 mL | 0.3772 mL | 0.7545 mL |
1、根据实验需要选择合适的溶剂配制储备液 (母液):对于大多数产品,InvivoChem推荐用DMSO配置母液 (比如:5、10、20mM或者10、20、50 mg/mL浓度),个别水溶性高的产品可直接溶于水。产品在DMSO 、水或其他溶剂中的具体溶解度详见上”溶解度 (体外)”部分;
2、如果您找不到您想要的溶解度信息,或者很难将产品溶解在溶液中,请联系我们;
3、建议使用下列计算器进行相关计算(摩尔浓度计算器、稀释计算器、分子量计算器、重组计算器等);
4、母液配好之后,将其分装到常规用量,并储存在-20°C或-80°C,尽量减少反复冻融循环。
计算结果:
工作液浓度: mg/mL;
DMSO母液配制方法: mg 药物溶于 μL DMSO溶液(母液浓度 mg/mL)。如该浓度超过该批次药物DMSO溶解度,请首先与我们联系。
体内配方配制方法:取 μL DMSO母液,加入 μL PEG300,混匀澄清后加入μL Tween 80,混匀澄清后加入 μL ddH2O,混匀澄清。
(1) 请确保溶液澄清之后,再加入下一种溶剂 (助溶剂) 。可利用涡旋、超声或水浴加热等方法助溶;
(2) 一定要按顺序加入溶剂 (助溶剂) 。