| 规格 | 价格 | |
|---|---|---|
| 500mg | ||
| 1g | ||
| Other Sizes |
| 靶点 |
CYP2C8 (IC50 = 1.4 μM); CYP2B6 (IC50 = 2.0 μM); CYP3A (IC50 = 2.3 μM); CYP2C19 (IC50 = 2.5 μM); CYP2D6 (IC50 = 2.5 μM); CYP2E1 (IC50 = 2.7 μM); CYP2C9 (IC50 = 3.3 μM); CYP2J2 (IC50 = 3.3 μM); CYP2A6 (IC50 = 3.8 μM (IC50); CYP1A2 (IC50 = 4.0 μM)
|
|---|---|
| 体外研究 (In Vitro) |
DL-乙酰紫草素的 IC50 值分别为 5.2 μM 和 3.0 μM,抑制 CYP3A 介导的睾酮(睾酮)和硝苯地平的代谢,表明它以不依赖于底物的方式抑制 CYP3A 活性 [1]。 DL-乙酰紫草素没有观察到时间依赖性抑制作用[1]。
乙酰紫草素是一种从紫草根中分离出来的具有抗癌和抗炎活性的生物活性化合物。最近发现乙酰紫草素对CYP2J2活性有抑制作用。基于这一结果,本研究扩展到使用底物鸡尾酒孵育试验评估乙酰紫草素对人肝微粒体(HLMs)中九种不同细胞色素P450(P450)亚型的抑制作用。乙酰紫草素对所有P450均有很强的抑制作用,IC50值为1.4-4.0μm。乙酰紫草素与HLMs和NADPH预孵育不会改变抑制效力,表明乙酰紫草素不是一种基于机制的抑制剂。SKF-525A是一种广泛使用的非特异性P450抑制剂,对CYP1A2、2A6、2E1和2J2没有抑制活性,但对CYP2B6、CYP2C19和2D6有抑制作用,IC50值分别为2.5、3.6和0.5μm。我们的研究结果表明,乙酰紫草素可能是一种新型的P450抑制剂,可以取代SKF-525A[1]。 |
| 酶活实验 |
可逆抑制研究[1]
所有孵育均进行三次,数据以平均值表示。使用合并的HLM评估了Acetylshikonin/乙酰紫草素、紫草素和SKF-525A对CYP2J2介导的阿司咪唑O-脱甲基酶活性的抑制作用。简而言之,孵育反应混合物在0.1 m m磷酸盐缓冲液(pH 7.4)中含有0.25 mg/ml HLMs、阿司咪唑(1μm)和抑制剂(0.5-50μm),并在37°C下预孵育5分钟。通过加入NADPH生成系统(含有1.3 m m NADP+、3.3 m m G6P、3.3μm MgCl2和500单位/ml G6PDH)引发反应。培养混合物的最终体积为100μl。在15分钟的孵育期后,通过加入含有15ng/ml特非那定的冰冷乙腈作为内标(IS)来停止反应。离心后,将等分试样(1μl)注入液相色谱-串联质谱系统(LC-MS/MS),如前所述(Lee,Wu,&Liu,2014)。 为了评估乙酰紫草素、紫草素和SKF-525A对其他九种P450亚型(即CYP1A2、2A6、2B6、2C8、2C9、2C19、2D6、2E1和3A)的抑制活性,使用了之前开发的底物鸡尾酒法(Joo&Liu,2013;Kim等人,2005)。表1列出了每种代谢物的底物浓度、选定的反应监测(SRM)转变和确定的碰撞能量。在抑制剂存在或不存在的情况下,将HLMs(0.25mg/ml)温育15分钟后,终止反应并离心混合物。如前所述(Joo&Liu,2013;Kim等人,2005),通过LC-MS/MS分析上清液的等分试样,并进行了一些修改。如前所述,还评估了乙酰紫草素对CYP3A介导的睾酮和硝苯地平代谢的抑制作用(Lee,Shon,&Liu,2016)。 时间依赖性抑制研究[1] 使用IC50偏移法测量时间依赖性抑制(TDI)。在NADPH生成系统的存在下,将HLM(0.25 mg/ml)与五种不同浓度(0.5-50μm)的抑制剂(乙酰紫草素或麻风酸)预孵育30分钟。使用已知的非特异性和时间依赖性P450抑制剂(Song等人,2014)作为阳性对照。通过加入P450底物引发反应,进一步孵育样品15分钟,然后通过加入100l含有IS的冰冷乙腈。离心后,用LC-MS/MS分析上清液的等分试样。 |
| 参考文献 | |
| 其他信息 |
Acetylshikonin is an acetate ester and a hydroxy-1,4-naphthoquinone.
Acetylshikonin has been reported in Arnebia decumbens, Arnebia euchroma, and other organisms with data available. However, acetylshikonin exhibited strong inhibitory activities against all P450 enzymes tested, with IC50 values < 5.0 μ m. These findings showed that the compound had similar inhibitory potential against all ten P450 enzymes in the range 1.4–4.0 μ m (Table 2), and its inhibitory effects were stronger than those of thelephoric acid, a well-documented non-specific P450 inhibitor (2.0 μ m ≤ IC50 ≤ 11.4 μ m), and the commonly used SKF-525A. Acetylshikonin also inhibited CYP3A-mediated testosterone and nifedipine metabolism with IC50 values of 5.2 and 3.0 μ m, respectively, indicating that it inhibits CYP3A activity in a substrate-independent manner. These experiments demonstrated that acetylshikonin is a more potent non-specific inhibitor of these ten P450 isoforms than are SKF-525A and thelephoric acid in HLMs. Similar to acetylshikonin, shikonin, a structural analogue of acetylshikonin, showed strong inhibitory effects against ten P450 isoforms (IC50 < 5.2 μ m, Table 2). The study next investigated whether the presence of NADPH led to shifts in the IC50 (Table 2). The inhibitory potential of acetylshikonin against the ten P450 isoforms in the presence of an NADPH-generating system (0.7 μ m ≤ IC50 ≤ 1.8 μ m) was similar to that in untreated HLMs (0.9 μ m ≤ IC50 ≤ 3.3 μ m), suggesting that acetylshikonin is not a time-dependent inhibitor. Acetylshikonin (at 5 μ m) inhibited all P450 isoforms tested by more than 60% (Figure 1), whereas SKF-525A did not inhibit any of its target isoforms (CYP1A2, CYP2A6, CYP2C9 and CYP2E1) by more than 10%. In a previous study, acetylshikonin inhibited CYP2J2-mediated astemizole O-demethylase activity in a noncompetitive manner (Park et al., 2017). Therefore, acetylshikonin is speculated to inhibit noncompetitively nine other P450 enzymes. In conclusion, the inhibitory potential of acetylshikonin against P450 isoforms was evaluated. Acetylshikonin strongly inhibited the activities of ten P450 isoforms in a NADPH-independent manner. The results suggest that acetylshikonin can be used instead of SKF-525A or thelephoric acid as a novel non-specific P450 inhibitor in reaction phenotyping studies using HLMs.[1] |
| 分子式 |
C18H18O6
|
|---|---|
| 分子量 |
330.331925868988
|
| 精确质量 |
330.11
|
| CAS号 |
54984-93-9
|
| 相关CAS号 |
Acetylshikonin;24502-78-1
|
| PubChem CID |
32464
|
| 外观&性状 |
Typically exists as solid at room temperature
|
| LogP |
2.691
|
| tPSA |
100.9
|
| 氢键供体(HBD)数目 |
2
|
| 氢键受体(HBA)数目 |
6
|
| 可旋转键数目(RBC) |
5
|
| 重原子数目 |
24
|
| 分子复杂度/Complexity |
599
|
| 定义原子立体中心数目 |
0
|
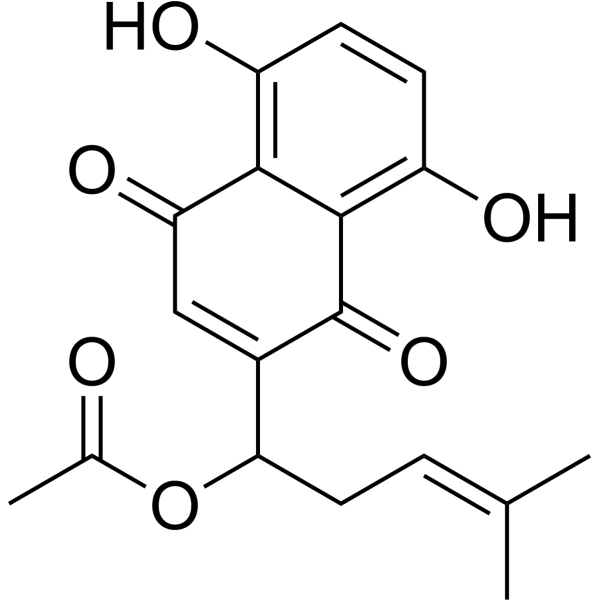
| SMILES |
O(C(C)=O)C(C/C=C(\C)/C)C1=CC(C2C(=CC=C(C=2C1=O)O)O)=O
|
| InChi Key |
WNFXUXZJJKTDOZ-UHFFFAOYSA-N
|
| InChi Code |
InChI=1S/C18H18O6/c1-9(2)4-7-15(24-10(3)19)11-8-14(22)16-12(20)5-6-13(21)17(16)18(11)23/h4-6,8,15,20-21H,7H2,1-3H3
|
| 化学名 |
[1-(5,8-dihydroxy-1,4-dioxonaphthalen-2-yl)-4-methylpent-3-enyl] acetate
|
| 别名 |
Acetylshikonin; 54984-93-9; DL-Acetylshikonin; 24502-78-1; [1-(5,8-dihydroxy-1,4-dioxonaphthalen-2-yl)-4-methylpent-3-enyl] acetate; Shikonin, acetyl; CHEBI:81069; 1-(5,8-dihydroxy-1,4-dioxo-1,4-dihydronaphthalen-2-yl)-4-methylpent-3-en-1-yl acetate;
|
| HS Tariff Code |
2934.99.9001
|
| 存储方式 |
Powder -20°C 3 years 4°C 2 years In solvent -80°C 6 months -20°C 1 month |
| 运输条件 |
Room temperature (This product is stable at ambient temperature for a few days during ordinary shipping and time spent in Customs)
|
| 溶解度 (体外实验) |
May dissolve in DMSO (in most cases), if not, try other solvents such as H2O, Ethanol, or DMF with a minute amount of products to avoid loss of samples
|
|---|---|
| 溶解度 (体内实验) |
注意: 如下所列的是一些常用的体内动物实验溶解配方,主要用于溶解难溶或不溶于水的产品(水溶度<1 mg/mL)。 建议您先取少量样品进行尝试,如该配方可行,再根据实验需求增加样品量。
注射用配方
注射用配方1: DMSO : Tween 80: Saline = 10 : 5 : 85 (如: 100 μL DMSO → 50 μL Tween 80 → 850 μL Saline)(IP/IV/IM/SC等) *生理盐水/Saline的制备:将0.9g氯化钠/NaCl溶解在100 mL ddH ₂ O中,得到澄清溶液。 注射用配方 2: DMSO : PEG300 :Tween 80 : Saline = 10 : 40 : 5 : 45 (如: 100 μL DMSO → 400 μL PEG300 → 50 μL Tween 80 → 450 μL Saline) 注射用配方 3: DMSO : Corn oil = 10 : 90 (如: 100 μL DMSO → 900 μL Corn oil) 示例: 以注射用配方 3 (DMSO : Corn oil = 10 : 90) 为例说明, 如果要配制 1 mL 2.5 mg/mL的工作液, 您可以取 100 μL 25 mg/mL 澄清的 DMSO 储备液,加到 900 μL Corn oil/玉米油中, 混合均匀。 View More
注射用配方 4: DMSO : 20% SBE-β-CD in Saline = 10 : 90 [如:100 μL DMSO → 900 μL (20% SBE-β-CD in Saline)] 口服配方
口服配方 1: 悬浮于0.5% CMC Na (羧甲基纤维素钠) 口服配方 2: 悬浮于0.5% Carboxymethyl cellulose (羧甲基纤维素) 示例: 以口服配方 1 (悬浮于 0.5% CMC Na)为例说明, 如果要配制 100 mL 2.5 mg/mL 的工作液, 您可以先取0.5g CMC Na并将其溶解于100mL ddH2O中,得到0.5%CMC-Na澄清溶液;然后将250 mg待测化合物加到100 mL前述 0.5%CMC Na溶液中,得到悬浮液。 View More
口服配方 3: 溶解于 PEG400 (聚乙二醇400) 请根据您的实验动物和给药方式选择适当的溶解配方/方案: 1、请先配制澄清的储备液(如:用DMSO配置50 或 100 mg/mL母液(储备液)); 2、取适量母液,按从左到右的顺序依次添加助溶剂,澄清后再加入下一助溶剂。以 下列配方为例说明 (注意此配方只用于说明,并不一定代表此产品 的实际溶解配方): 10% DMSO → 40% PEG300 → 5% Tween-80 → 45% ddH2O (或 saline); 假设最终工作液的体积为 1 mL, 浓度为5 mg/mL: 取 100 μL 50 mg/mL 的澄清 DMSO 储备液加到 400 μL PEG300 中,混合均匀/澄清;向上述体系中加入50 μL Tween-80,混合均匀/澄清;然后继续加入450 μL ddH2O (或 saline)定容至 1 mL; 3、溶剂前显示的百分比是指该溶剂在最终溶液/工作液中的体积所占比例; 4、 如产品在配制过程中出现沉淀/析出,可通过加热(≤50℃)或超声的方式助溶; 5、为保证最佳实验结果,工作液请现配现用! 6、如不确定怎么将母液配置成体内动物实验的工作液,请查看说明书或联系我们; 7、 以上所有助溶剂都可在 Invivochem.cn网站购买。 |
| 制备储备液 | 1 mg | 5 mg | 10 mg | |
| 1 mM | 3.0273 mL | 15.1364 mL | 30.2728 mL | |
| 5 mM | 0.6055 mL | 3.0273 mL | 6.0546 mL | |
| 10 mM | 0.3027 mL | 1.5136 mL | 3.0273 mL |
1、根据实验需要选择合适的溶剂配制储备液 (母液):对于大多数产品,InvivoChem推荐用DMSO配置母液 (比如:5、10、20mM或者10、20、50 mg/mL浓度),个别水溶性高的产品可直接溶于水。产品在DMSO 、水或其他溶剂中的具体溶解度详见上”溶解度 (体外)”部分;
2、如果您找不到您想要的溶解度信息,或者很难将产品溶解在溶液中,请联系我们;
3、建议使用下列计算器进行相关计算(摩尔浓度计算器、稀释计算器、分子量计算器、重组计算器等);
4、母液配好之后,将其分装到常规用量,并储存在-20°C或-80°C,尽量减少反复冻融循环。
计算结果:
工作液浓度: mg/mL;
DMSO母液配制方法: mg 药物溶于 μL DMSO溶液(母液浓度 mg/mL)。如该浓度超过该批次药物DMSO溶解度,请首先与我们联系。
体内配方配制方法:取 μL DMSO母液,加入 μL PEG300,混匀澄清后加入μL Tween 80,混匀澄清后加入 μL ddH2O,混匀澄清。
(1) 请确保溶液澄清之后,再加入下一种溶剂 (助溶剂) 。可利用涡旋、超声或水浴加热等方法助溶;
(2) 一定要按顺序加入溶剂 (助溶剂) 。