| 规格 | 价格 | 库存 | 数量 |
|---|---|---|---|
| 5mg |
|
||
| 10mg |
|
||
| 25mg |
|
||
| 50mg |
|
||
| 100mg |
|
||
| Other Sizes |
|
| 靶点 |
- CD36/FAT translocase (inhibited by Succinimidyl oleate, a structural analog of Sulfosuccinimidyl oleate sodium)
- Mitochondrial respiratory chain Complex III (inhibited by Succinimidyl oleate, a structural analog of Sulfosuccinimidyl oleate sodium) [2] |
|---|---|
| 体外研究 (In Vitro) |
细胞活力不受磺基琥珀酰亚胺油酸酯(20 μM 和 50 μM,24 小时)的影响。适度暴露于 5 ng/mL IFNγ 加 100 ng/ml LPS 会显着降低 BV2 细胞的活力。磺基琥珀酰亚胺油酸酯联合治疗可阻止 LPS+IFNγ 引起的细胞活力降低 [1]。在 BV2 细胞中,与 50 μM 磺基琥珀酰亚胺油酸酯共处理 24 小时可显着降低由 LPS+IFNγ 产生的 NOS2 和 COX-2 的产生。 Western blot 分析表明,LPS/IFNγ 产生的 p38 磷酸化形式显着上调。通过将样品与 50 μM 磺基琥珀酰亚胺油酸酯共处理 24 小时,可以抑制这种过度表达。 [1]。
磺基琥珀酰亚胺油酸(SSO)在炎症刺激下维持BV2小胶质细胞的存活率[1] SSO改变细胞存活率的能力首先用幼稚的BV2细胞或用100 ng/ml LPS和5 ng/ml IFNγ刺激的BV2电池进行评估。使用两种浓度的SSO(20μM和50μM)。单独使用SSO不会改变雷苏林测定法测量的细胞存活率(图1a)。暴露于100 ng/ml LPS+5 ng/ml IFNγ适度,但显著降低了BV2细胞的存活率。与SSO共同处理可防止LPS+IFNγ诱导的细胞存活率降低(图1a)。此外,LPS+IFNγ暴露诱导BV2细胞大量产生NO,这被两种浓度的SSO共同处理所阻断(图1b)。 磺基琥珀酰亚胺油酸(SSO)下调BV2细胞中LPS/IFNγ诱导的炎症介质[1] 由于50μM剂量的SSO没有产生任何毒性,我们选择使用50μM浓度的SSO进行进一步的实验。接下来的分析侧重于分析SSO在LPS+IFNγ刺激的BV2细胞中是否具有体外抗炎特性。在所分析的各种细胞因子中,LPS+IFNγ促进了IL-6和TNF-α分泌的大幅增加,而与SSO联合治疗则显著降低了这些分泌(图2a,b)。所有治疗组的IL-10水平均无变化(图2c)。 磺基琥珀酰亚胺油酸(SSO)拯救神经元免受炎症诱导的死亡[1] 接下来,我们评估了SSO是否对暴露于谷氨酸介导的兴奋毒性的培养原代神经元具有直接的神经保护作用。原代神经元用50μM SSO预处理2小时,然后暴露于400μM谷氨酸和50μM SSO24小时。单独使用SSO对神经元没有毒性,但无法防止谷氨酸诱导的神经元死亡(图5a)。由于SSO不能在纯神经元培养物中挽救神经元活力,但具有抗炎特性,我们评估了SSO是否可以使用原代神经元-BV2共培养物预防炎症诱导的神经元死亡。共培养物用两种浓度的SSO(20μM和50μM)预处理,然后暴露于100 ng/ml LPS和5 ng/ml IFNγ。使用过氧化物酶ABTS试剂盒测量神经元存活率表明,单独使用SSO不会导致MAP-2免疫反应性的任何丧失。此外,SSO剂量依赖性地阻止了LPS/IFNγ诱导的神经元死亡(图5b)。为了证实原代小胶质细胞的这些发现,我们将原代神经元-原代小神经胶质细胞共培养模型暴露于20μM SSO,同样,2小时SSO预处理显著预防了LPS+IFNγ诱导的神经元死亡(图5c)。 - 在原代皮质神经元或HT22海马神经元细胞的体外缺氧缺糖(OGD)模型中:在OGD处理前或处理后,用浓度为1μM、5μM、10μM的Sulfosuccinimidyl oleate sodium处理细胞,可显著提高神经元细胞活力(MTT法检测;10μM浓度下,活力较单纯OGD组提高约25%-40%)。此外,该药物可减少细胞上清液中促炎细胞因子的释放,包括肿瘤坏死因子-α(TNF-α;降低约30%-50%)和白细胞介素-1β(IL-1β;降低约25%-45%)(ELISA法检测)。Western blot分析还显示,Sulfosuccinimidyl oleate sodium可下调核因子-κB(NF-κB)p65的磷酸化水平(磷酸化p65表达降低约35%-55%),并抑制与神经炎症相关的NF-κB信号通路激活[1] - 在HeLa细胞或大鼠肝脏组织分离的线粒体中进行的线粒体呼吸链复合物III活性检测中:Sulfosuccinimidyl oleate sodium的结构类似物Succinimidyl oleate在20μM、50μM、100μM浓度下,可剂量依赖性地抑制复合物III活性。抑制作用表现为细胞色素c还原速率降低(550nm处吸光度检测),100μM浓度下复合物III活性较对照组降低约40%-75%。过量底物(泛醌类似物)无法逆转该抑制作用,提示其可能为非竞争性或不可逆抑制机制[2] - 在3T3-L1脂肪细胞或RAW264.7巨噬细胞(高表达CD36的细胞)中进行的CD36介导脂肪酸摄取检测中:Sulfosuccinimidyl oleate sodium的结构类似物Succinimidyl oleate在10μM、30μM、50μM浓度下,可剂量依赖性地抑制BODIPY标记棕榈酸(荧光标记长链脂肪酸)的摄取。流式细胞术分析显示,50μM浓度下脂肪酸摄取量较对照组降低约20%-60%,证实其对CD36/FAT转运体的抑制作用[2] |
| 体内研究 (In Vivo) |
在 pMCAo 模型中的雄性 BALB/cABom 小鼠中,与媒介物处理的对照组相比,磺基琥珀酰亚胺油酸酯(50 mg/kg;单次口服灌胃给药)显着减少了皮质缺陷。血梗塞区域。此外,50 mg/kg 磺基琥珀酰亚胺油酸酯适合在中风后看到有益效果 [1]。
磺基琥珀酰亚胺油酸(SSO)治疗可减轻缺血后脑损伤[1] 基于我们的体外数据,我们在pMCAo小鼠模型中测试了SSO的治疗效果。我们选择了50mg/kg的SSO剂量,对小鼠没有不良影响。小鼠在受伤后3天接受了MRI成像。病变体积的量化显示,与赋形剂治疗的对照组相比,口服SSO显著减少了皮质缺血性梗死面积(图6)。 磺基琥珀酰亚胺油酸(SSO)治疗的小鼠缺血周微胶质增生显著减少,但星形胶质增生没有减少[1] 通过Iba-1免疫组织化学染色分析缺血诱导的脑微胶质瘤。正如预期的那样,与中风后3天对侧的相应区域相比,我们检测到SSO治疗组和对照组小鼠缺血周围区域的微胶质细胞增生显著上调(图7a)。然而,与赋形剂处理的小鼠相比,SSO处理的小鼠缺血周围区域的Iba-1免疫反应程度显著降低(图7a)。与对侧相比,缺血诱导缺血周围区域GFAP免疫反应性显著上调,但SSO未能减少中风诱导的GFAP免疫活性增加(图7b)。 磺基琥珀酰亚胺油酸(SSO)处理的小鼠显示缺血周围区域COX-2表达降低,HO-1表达增加[1] 由于SSO在体外具有降低COX-2表达的能力,我们分析了中风后3天中风动物缺血周围区域COX-2免疫反应的程度。pMCAo诱导缺血周围区域COX-2免疫反应性显著上调(图8a)。与载体处理的对照组相比,SSO处理的动物显示COX-2表达程度降低(图8a)。为了评估表达COX-2的细胞类型,我们用COX-2和小胶质细胞/巨噬细胞标记物CD45、神经元标记物NeuN和星形胶质细胞标记物GFAP进行了免疫组织学双染色。双重染色显示,COX-2免疫反应性主要位于小胶质细胞/巨噬细胞和神经元中,而不位于星形胶质细胞中(图8f)。为了评估SSO诱导抗氧化反应的影响,我们对HO-1进行了染色,并检测到与赋形剂处理的对照组相比,SSO处理的动物缺血周围区域HO-1的显著上调(图8g)。HO-1与CD45、NeuN和GFAP的双重染色显示出与COX-2相似的共定位,HO-1主要在小胶质细胞/巨噬细胞和神经元中表达,但在星形胶质细胞中不表达(图8l)。 - 在大鼠大脑中动脉阻塞(MCAO)中风模型中:选用体重250-300g的雄性SD大鼠,通过线栓法阻塞大脑中动脉90分钟后再灌注。在再灌注后1小时,通过尾静脉注射给予Sulfosuccinimidyl oleate sodium,剂量分别为1mg/kg、5mg/kg、10mg/kg(对照组给予等体积生理盐水)。在再灌注后24h、48h、72h,采用Longa评分系统(0分=无神经功能缺损,4分=严重神经功能缺损)评估神经功能:5mg/kg和10mg/kg剂量组的Longa评分显著降低(如72h时约为1.2-1.8分),而对照组约为2.8-3.2分。再灌注后72h对脑组织进行TTC染色显示,Sulfosuccinimidyl oleate sodium可减少脑梗死体积:10mg/kg剂量组的梗死体积百分比(相对于同侧大脑半球)约为15%-20%,而对照组约为35%-40%。对梗死周围脑组织的ELISA分析显示,药物处理组的TNF-α水平降低约35%-50%,IL-1β水平降低约30%-45%。Western blot还证实,药物处理大鼠脑组织中磷酸化NF-κB p65的表达下调[1] |
| 酶活实验 |
- 线粒体呼吸链复合物III活性检测:通过差速离心法从HeLa细胞或大鼠肝脏组织中分离线粒体(在冰浴线粒体分离缓冲液中匀浆,600×g离心10分钟去除细胞核,10000×g离心20分钟获得线粒体沉淀)。线粒体沉淀重悬于检测缓冲液中,采用BCA法将蛋白浓度调整至0.5-1mg/mL。检测反应体系包含线粒体悬液、50μM泛醌-2(底物)、10μM细胞色素c(电子受体)和25mM Tris-HCl缓冲液(pH7.4)。向反应体系中加入不同浓度的Succinimidyl oleate(20μM、50μM、100μM;Sulfosuccinimidyl oleate sodium的结构类似物),在37℃下用分光光度计监测5分钟内550nm处吸光度变化(反映细胞色素c还原情况)。复合物III活性以每分钟每毫克线粒体蛋白还原的细胞色素c纳摩尔数计算,药物的抑制作用以相对于对照组(无药物)的活性降低百分比表示[2]
- CD36/FAT转运体活性检测(脂肪酸摄取实验):将3T3-L1脂肪细胞或RAW264.7巨噬细胞接种于24孔板,培养至汇合。细胞用磷酸盐缓冲液(PBS)洗涤两次,在含不同浓度Succinimidyl oleate(10μM、30μM、50μM;Sulfosuccinimidyl oleate sodium的结构类似物)的无血清培养基中37℃预孵育30分钟。预孵育后,向每孔加入500nM BODIPY 493/503标记棕榈酸(荧光脂肪酸底物),继续孵育15分钟。用含0.1%牛血清白蛋白(BSA)的冰浴PBS洗涤细胞3次以终止反应(去除未结合的脂肪酸)。细胞用0.1% Triton X-100裂解,使用荧光计(激发波长485nm,发射波长520nm)检测裂解液的荧光强度。脂肪酸摄取量根据裂解液总蛋白浓度(BCA法检测)进行标准化,药物对CD36活性的抑制率相对于对照组计算[2] |
| 细胞实验 |
蛋白质印迹分析[1]
细胞类型: BV2 细胞 测试浓度: 50 μM 孵育时间: 24 hrs(小时) 实验结果:NOS2、COX-2 和 P-p38/T-p38 水平显着增加。 一氧化氮生成和细胞存活率测定[1] 在LPS/IFNγ刺激和磺基琥珀酰亚胺油酸(SSO)处理后24小时,通过Griess试验评估培养基中一氧化氮(NO)的产生。将50微升培养上清液与等体积的Griess试剂在室温(RT)下孵育10分钟,并使用Victor 2.0平板读数器在544nm处测量光密度。 暴露后24小时,使用刃天青测定法测量细胞存活率。简而言之,细胞与稀释在培养基中的10μM resazurin 在37°C下孵育2小时。然后使用Victor 2.0平板读数器在485nm处定量吸光度。 CBA测定[1] 使用小鼠抗炎细胞珠阵列(CBA)试剂盒,在磺基琥珀酰亚胺油酸(SSO)处理24小时后获得的培养上清液用于测定白细胞介素-6(IL-6)、IL-10、单核细胞趋化蛋白1(MCP-1)、TNF-α、IFN-γ和IL-12p70的水平。染色后,在FACS Calibur流式细胞仪上运行样品。使用FCAP阵列软件对结果进行分析。 - 神经元OGD损伤保护实验:从胚胎18天(E18)SD大鼠胚胎中分离原代皮质神经元,在添加B27和谷氨酰胺的神经基础培养基中培养7-10天;HT22海马神经元细胞在含10%胎牛血清(FBS)的DMEM培养基中培养至70%-80%汇合。建立OGD模型时,将培养基替换为无糖DMEM,细胞置于缺氧培养箱(95% N2、5% CO2)中37℃培养2小时。药物处理方式为:在OGD前1小时(预处理)或OGD后立即(后处理),向培养基中加入1μM、5μM或10μM的Sulfosuccinimidyl oleate sodium。OGD结束后,更换为正常培养基,细胞继续培养24小时。采用MTT法检测细胞活力:向每孔加入5mg/mL MTT溶液(占培养基体积的10%),37℃孵育4小时;甲臜晶体用DMSO溶解,在570nm处检测吸光度。收集上清液,用商品化ELISA试剂盒检测TNF-α和IL-1β水平。Western blot分析时,细胞用含蛋白酶和磷酸酶抑制剂的RIPA缓冲液裂解;取30-50μg蛋白进行SDS-PAGE电泳,转移至PVDF膜,用抗磷酸化NF-κB p65抗体和抗β-肌动蛋白抗体(内参)孵育,再用HRP标记的二抗孵育。通过ECL试剂显影条带,采用密度分析定量蛋白表达[1] - 线粒体功能相关细胞实验:将HeLa细胞接种于6孔板,在含10% FBS的DMEM培养基中培养至80%汇合。用Succinimidyl oleate(20μM、50μM、100μM;Sulfosuccinimidyl oleate sodium的结构类似物)37℃处理细胞4小时。处理后收集细胞,用PBS洗涤。按酶活性检测部分所述方法分离线粒体,采用Clark型氧电极检测线粒体呼吸控制率(RCR):线粒体在含谷氨酸/苹果酸(复合物I底物)或琥珀酸(复合物II底物)的呼吸缓冲液中孵育,分别记录加入ADP(检测状态3呼吸)和寡霉素(检测状态4呼吸)前后的耗氧率(OCR),RCR计算为状态3与状态4 OCR的比值。采用ATP检测试剂盒检测HeLa细胞ATP水平:细胞裂解后,裂解液与荧光素-荧光素酶试剂混合;用 luminometer检测发光强度,ATP浓度根据总蛋白浓度标准化[2] - CD36介导脂肪酸摄取细胞实验(详细方法见Enzyme Assay部分)[2] |
| 动物实验 |
Animal/Disease Models: 4-month-old male BALB/cABom mice, pMCAo model [1]
Doses: 50 mg/kg Route of Administration: Single oral administration once Experimental Results:Reduce post-ischemic brain damage. The infarct area is diminished. Ischemia surgery and treatment with sulfosuccinimidyl oleate (SSO) [1] All animals underwent distal permanent occlusion of the middle cerebral artery (MCA) (pMCAo) as described previously. Briefly, mice were anesthetized with 5% isoflurane for induction and 2% isoflurane for maintenance (70% N2O/30% O2). The temperature of the mice was maintained at 36-5 ± 0.5 °C using a thermostatically controlled heating blanket connected to a rectal probe. The temporalis muscle was retracted to expose the skull in between the ear and the eye, and a small hole of approximately 1 mm was drilled at the site of the MCA. The dura was carefully removed to expose the MCA. The artery was then gently lifted up and cauterized using a thermocoagulator. After the procedure, the muscle was lifted back and the skin wound was sutured. The animals were then placed back to their home cages. SSO was emulsified in 0.5% methyl cellulose and administered once by single oral gavage at the dose of 50 mg/kg immediately after the surgery, when the mice had retained their consciousness. The administration routes for SSO in vivo have been described previously. In addition, we performed a dose-response study and found that SSO at 50 mg/kg was suitable to see a beneficial effect after stroke. There was no mortality in this study. - Rat MCAO Stroke Model Protocol: Male SD rats (250-300 g) were acclimated to the animal facility for 1 week (12 h light/dark cycle, ad libitum access to food and water) before experimentation. Anesthesia was induced with 10% chloral hydrate (350 mg/kg, intraperitoneal injection). The right common carotid artery (CCA), external carotid artery (ECA), and internal carotid artery (ICA) were exposed via a midline cervical incision. A 4-0 nylon suture with a rounded tip was inserted through the ECA into the ICA until resistance was felt (≈18-20 mm from the CCA bifurcation), to occlude the middle cerebral artery (MCA). After 90 minutes of occlusion, the suture was withdrawn to allow reperfusion. Sulfosuccinimidyl oleate sodium was dissolved in normal saline (pH adjusted to 7.4) to prepare stock solutions of 0.1 mg/mL, 0.5 mg/mL, and 1 mg/mL. The drug was administered via tail vein injection at doses of 1 mg/kg, 5 mg/kg, or 10 mg/kg at 1 hour after reperfusion; the control group received an equal volume of normal saline. Neurological function was assessed by two blinded observers using the Longa scale at 24 h, 48 h, and 72 h post-reperfusion. At 72 h post-reperfusion, rats were euthanized by decapitation, and the brains were quickly removed and placed in ice-cold PBS. Each brain was sliced into 2 mm coronal sections, which were incubated in 2% TTC solution at 37°C for 30 minutes (viable tissue stained red, infarcted tissue stained pale). The sections were photographed, and infarct volume was calculated using image analysis software (infarct volume percentage = [infarct area / ipsilateral hemisphere area] × 100%). Peri-infarct brain tissue was dissected, homogenized in ice-cold RIPA buffer, and centrifuged at 12,000 × g for 20 minutes at 4°C; the supernatant was used for ELISA (TNF-α, IL-1β) and Western blot analysis [1] |
| 参考文献 |
|
| 其他信息 |
Background: Ischemic stroke is one of the main causes of death and disability worldwide. It is caused by the cessation of cerebral blood flow resulting in the insufficient delivery of glucose and oxygen to the neural tissue. The inflammatory response initiated by ischemic stroke in order to restore tissue homeostasis in the acute phase of stroke contributes to delayed brain damage.
Methods: By using in vitro models of neuroinflammation and in vivo model of permanent middle cerebral artery occlusion, we demonstrate the neuroprotective and anti-inflammatory effects of sulfosuccinimidyl oleate sodium (SSO). Results: SSO significantly reduced the lipopolysaccharide/interferon-γ-induced production of nitric oxide, interleukin-6 and tumor necrosis factor-α, and the protein levels of inflammatory enzymes including nitric oxide synthase 2, cyclooxygenase-2 (COX-2), and p38 mitogen-activated protein kinase (MAPK) in microglia, without causing cell toxicity. Although SSO failed to directly alleviate glutamate-induced excitotoxicity in murine cortical neurons, it prevented inflammation-induced neuronal death in microglia-neuron co-cultures. Importantly, oral administration of SSO in Balb/c mice subjected to permanent occlusion of the middle cerebral artery reduced microglial activation in the peri-ischemic area and attenuated brain damage. This in vivo neuroprotective effect of SSO was associated with a reduction in the COX-2 and heme oxygenase-1 immunoreactivities. Conclusions: Our results suggest that SSO is an anti-inflammatory and a possible therapeutic candidate in diseases such as stroke where inflammation is a central hallmark.[1] The functional role of CD36 protein detected in mitochondrial fractions in long chain fatty acid (LCFA) oxidation is unclear due to conflicting results obtained in Cd36 knockout mice and experiments using sulfo-N-succinimidyl oleate (SSO) for inhibition of CD36 mediated LCFA transport. We investigated effect of SSO on mitochondrial respiration and found that SSO substantially inhibits not only LCFA oxidation, but also oxidation of flavoprotein- and NADH-dependent substrates and generation of mitochondrial membrane potential. Experiments in rat liver, heart and kidney mitochondria demonstrated a direct effect on mitochondrial respiratory chain with the most pronounced inhibition of the complex III (IC(50) 4microM SSO). The results presented here show that SSO is a potent and irreversible inhibitor of mitochondrial respiratory chain.[2] - Sulfosuccinimidyl oleate sodium exerts neuroprotective effects in experimental stroke models, primarily through the inhibition of neuroinflammation. Its mechanism involves downregulating the NF-κB signaling pathway, which is a key mediator of pro-inflammatory cytokine production in the brain after ischemia-reperfusion injury. This finding suggests that Sulfosuccinimidyl oleate sodium may be a potential therapeutic candidate for the treatment of ischemic stroke [1] - Succinimidyl oleate, a structural analog of Sulfosuccinimidyl oleate sodium, is a well-established inhibitor of CD36/FAT translocase (a membrane protein involved in fatty acid uptake). The discovery that Succinimidyl oleate also inhibits mitochondrial respiratory chain Complex III indicates that this class of compounds may have multi-target effects. However, the inhibitory effect on Complex III may have implications for cellular energy metabolism, as Complex III is critical for ATP production via oxidative phosphorylation. Further studies are needed to determine whether Sulfosuccinimidyl oleate sodium shares this Complex III inhibitory activity [2] |
| 分子式 |
C22H37NO7S
|
|---|---|
| 分子量 |
482.58648
|
| 精确质量 |
481.211
|
| 元素分析 |
C, 54.87; H, 7.54; N, 2.91; Na, 4.77; O, 23.26; S, 6.66
|
| CAS号 |
135661-44-8
|
| 相关CAS号 |
Sulfosuccinimidyl oleate sodium;1212012-37-7
|
| PubChem CID |
90469841
|
| 外观&性状 |
Solid powder
|
| 密度 |
1.19g/cm3
|
| 熔点 |
220-222ºC
|
| 折射率 |
1.526
|
| LogP |
5.173
|
| tPSA |
129.26
|
| 氢键供体(HBD)数目 |
0
|
| 氢键受体(HBA)数目 |
7
|
| 可旋转键数目(RBC) |
18
|
| 重原子数目 |
32
|
| 分子复杂度/Complexity |
704
|
| 定义原子立体中心数目 |
0
|
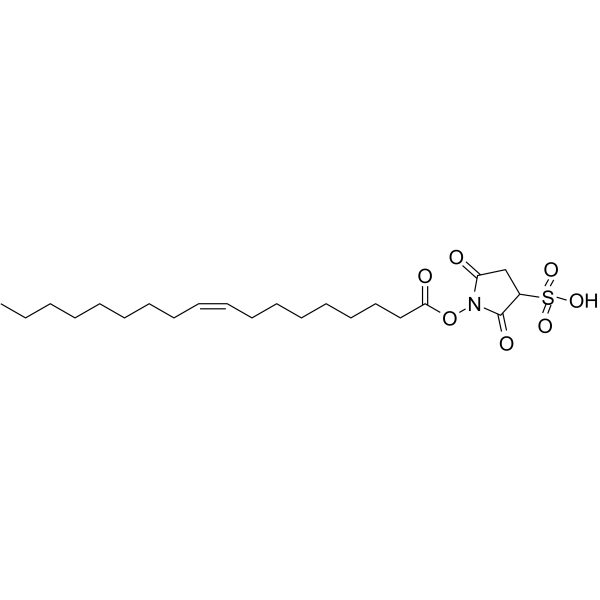
| SMILES |
O=S(C(C1)C(N(OC(CCCCCCC/C=C\CCCCCCCC)=O)C1=O)=O)(O)=O
|
| InChi Key |
IENDXPSKPJDQKO-UHFFFAOYSA-N
|
| InChi Code |
InChI=1S/C22H37NO7S.Na/c1-2-3-4-5-6-7-8-9-10-11-12-13-14-15-16-17-21(25)30-23-20(24)18-19(22(23)26)31(27,28)29;/h9-10,19H,2-8,11-18H2,1H3,(H,27,28,29)
|
| 化学名 |
sodium;1-[(Z)-octadec-9-enoyl]oxy-2,5-dioxopyrrolidine-3-sulfonate
|
| 别名 |
Sulfosuccinimidyl Oleate Sodium; sulfosuccinimidyl oleate; 135661-44-8; SCHEMBL2129565; CHEBI:183957; 1-(Oleoyloxy)-2,5-dioxopyrrolidine-3-sulfonic acid; SSO
|
| HS Tariff Code |
2934.99.9001
|
| 存储方式 |
Powder -20°C 3 years 4°C 2 years In solvent -80°C 6 months -20°C 1 month |
| 运输条件 |
Room temperature (This product is stable at ambient temperature for a few days during ordinary shipping and time spent in Customs)
|
| 溶解度 (体外实验) |
May dissolve in DMSO (in most cases), if not, try other solvents such as H2O, Ethanol, or DMF with a minute amount of products to avoid loss of samples
|
|---|---|
| 溶解度 (体内实验) |
注意: 如下所列的是一些常用的体内动物实验溶解配方,主要用于溶解难溶或不溶于水的产品(水溶度<1 mg/mL)。 建议您先取少量样品进行尝试,如该配方可行,再根据实验需求增加样品量。
注射用配方
注射用配方1: DMSO : Tween 80: Saline = 10 : 5 : 85 (如: 100 μL DMSO → 50 μL Tween 80 → 850 μL Saline)(IP/IV/IM/SC等) *生理盐水/Saline的制备:将0.9g氯化钠/NaCl溶解在100 mL ddH ₂ O中,得到澄清溶液。 注射用配方 2: DMSO : PEG300 :Tween 80 : Saline = 10 : 40 : 5 : 45 (如: 100 μL DMSO → 400 μL PEG300 → 50 μL Tween 80 → 450 μL Saline) 注射用配方 3: DMSO : Corn oil = 10 : 90 (如: 100 μL DMSO → 900 μL Corn oil) 示例: 以注射用配方 3 (DMSO : Corn oil = 10 : 90) 为例说明, 如果要配制 1 mL 2.5 mg/mL的工作液, 您可以取 100 μL 25 mg/mL 澄清的 DMSO 储备液,加到 900 μL Corn oil/玉米油中, 混合均匀。 View More
注射用配方 4: DMSO : 20% SBE-β-CD in Saline = 10 : 90 [如:100 μL DMSO → 900 μL (20% SBE-β-CD in Saline)] 口服配方
口服配方 1: 悬浮于0.5% CMC Na (羧甲基纤维素钠) 口服配方 2: 悬浮于0.5% Carboxymethyl cellulose (羧甲基纤维素) 示例: 以口服配方 1 (悬浮于 0.5% CMC Na)为例说明, 如果要配制 100 mL 2.5 mg/mL 的工作液, 您可以先取0.5g CMC Na并将其溶解于100mL ddH2O中,得到0.5%CMC-Na澄清溶液;然后将250 mg待测化合物加到100 mL前述 0.5%CMC Na溶液中,得到悬浮液。 View More
口服配方 3: 溶解于 PEG400 (聚乙二醇400) 请根据您的实验动物和给药方式选择适当的溶解配方/方案: 1、请先配制澄清的储备液(如:用DMSO配置50 或 100 mg/mL母液(储备液)); 2、取适量母液,按从左到右的顺序依次添加助溶剂,澄清后再加入下一助溶剂。以 下列配方为例说明 (注意此配方只用于说明,并不一定代表此产品 的实际溶解配方): 10% DMSO → 40% PEG300 → 5% Tween-80 → 45% ddH2O (或 saline); 假设最终工作液的体积为 1 mL, 浓度为5 mg/mL: 取 100 μL 50 mg/mL 的澄清 DMSO 储备液加到 400 μL PEG300 中,混合均匀/澄清;向上述体系中加入50 μL Tween-80,混合均匀/澄清;然后继续加入450 μL ddH2O (或 saline)定容至 1 mL; 3、溶剂前显示的百分比是指该溶剂在最终溶液/工作液中的体积所占比例; 4、 如产品在配制过程中出现沉淀/析出,可通过加热(≤50℃)或超声的方式助溶; 5、为保证最佳实验结果,工作液请现配现用! 6、如不确定怎么将母液配置成体内动物实验的工作液,请查看说明书或联系我们; 7、 以上所有助溶剂都可在 Invivochem.cn网站购买。 |
| 制备储备液 | 1 mg | 5 mg | 10 mg | |
| 1 mM | 2.0722 mL | 10.3608 mL | 20.7215 mL | |
| 5 mM | 0.4144 mL | 2.0722 mL | 4.1443 mL | |
| 10 mM | 0.2072 mL | 1.0361 mL | 2.0722 mL |
1、根据实验需要选择合适的溶剂配制储备液 (母液):对于大多数产品,InvivoChem推荐用DMSO配置母液 (比如:5、10、20mM或者10、20、50 mg/mL浓度),个别水溶性高的产品可直接溶于水。产品在DMSO 、水或其他溶剂中的具体溶解度详见上”溶解度 (体外)”部分;
2、如果您找不到您想要的溶解度信息,或者很难将产品溶解在溶液中,请联系我们;
3、建议使用下列计算器进行相关计算(摩尔浓度计算器、稀释计算器、分子量计算器、重组计算器等);
4、母液配好之后,将其分装到常规用量,并储存在-20°C或-80°C,尽量减少反复冻融循环。
计算结果:
工作液浓度: mg/mL;
DMSO母液配制方法: mg 药物溶于 μL DMSO溶液(母液浓度 mg/mL)。如该浓度超过该批次药物DMSO溶解度,请首先与我们联系。
体内配方配制方法:取 μL DMSO母液,加入 μL PEG300,混匀澄清后加入μL Tween 80,混匀澄清后加入 μL ddH2O,混匀澄清。
(1) 请确保溶液澄清之后,再加入下一种溶剂 (助溶剂) 。可利用涡旋、超声或水浴加热等方法助溶;
(2) 一定要按顺序加入溶剂 (助溶剂) 。