| 规格 | 价格 | 库存 | 数量 |
|---|---|---|---|
| 5mg |
|
||
| 10mg |
|
||
| 25mg |
|
||
| 50mg |
|
||
| 100mg |
|
||
| 250mg |
|
||
| Other Sizes |
|
| 靶点 |
ETA ( IC50 = 0.055 nM )
Atrasentan (ABT-627, 0-50 μM) strongly inhibits the growth of LNCaP and C4-2b prostate cancer cells. When combined with Taxotere, ABT-627 causes a notably higher reduction in viable prostate cancer cells compared to when either drug is used alone. It also exhibits a higher degree of NF-κB DNA binding activity down-regulation[2]. Atrasentan significantly induces a number of CYPs and drug transporters (CYP3A4 is 12-fold induced at 50 μM, for example). It is a weak BCRP inhibitor (IC50 in MDCKII-BCRP cells = 59.8±11 μM) and a moderate P-gp inhibitor (IC50 in P388/dx cells = 15.1±1.6 μM)[3]. |
|---|---|
| 体外研究 (In Vitro) |
Atrasentan (ABT-627, 0-50 μM) 显着抑制 LNCaP 和 C4-2b 前列腺癌细胞生长。与单独使用任一药物相比,ABT-627 与泰索帝联合使用可显着增加活前列腺癌细胞的损失,并显示出更大程度的 NF-κB DNA 结合活性下调[2]。 Atrasentan 可显着诱导多种 CYP 和药物转运蛋白(例如 50 μM 时可诱导 12 倍 CYP3A4)。它是一种中度 P-gp 抑制剂(P388/dx 细胞中的 IC50=15.1±1.6 μM)和弱 BCRP 抑制剂(MDCKII-BCRP 细胞中的 IC50=59.8±11 μM)[3]。
Atrasentan 浓度依赖性地抑制雄激素受体(AR)阳性前列腺癌细胞系LNCaP和C4-2b的生长,但对AR阴性的PC-3细胞系效果甚微。 在LNCaP细胞中,用10 µM、25 µM和50 µM的Atrasentan处理72小时,细胞活力分别降低18%、30%和60%。 在C4-2b细胞中,相同处理导致细胞活力降低15%、32%和56%。 与多西他赛(Taxotere,1 nM)联合使用Atrasentan(25 µM)处理72小时,在LNCaP和C4-2b细胞中导致比单药治疗(约40%抑制)显著更强的生长抑制(约60-70%活力降低)和细胞凋亡诱导。 通过组蛋白-DNA ELISA和流式细胞术证实了联合治疗的促凋亡效应,显示亚G0-G1期细胞比例增加。 在机制上,Atrasentan处理(25 µM,72小时)以剂量和时间依赖性方式下调C4-2b细胞中构成型的核因子κB(NF-κB)DNA结合活性。 与单药相比,联合治疗导致NF-κB活性更大程度的下调。 蛋白质印迹分析显示,Atrasentan和多西他赛联合治疗降低了C4-2b细胞中抗凋亡蛋白Bcl-2、Bcl-xL和survivin的表达,增加了PARP的切割(细胞凋亡标志物),并抑制了Akt及其底物GSK-3α/β的磷酸化。 |
| 体内研究 (In Vivo) |
Atrasentan (3 mg/kg, po) 抑制大内皮素-1 (1 nmol/kg) 在髓大鼠中诱导的升压反应[1]。在 SCID-hu 模型中,Aatrasentan(ABT-627,10 mg/kg,腹腔注射)以及单独的泰索帝在一定程度上抑制了骨环境中 C4-2b 肿瘤的生长[2]。
在SCID-hu小鼠实验性前列腺癌骨转移模型中(将C4-2b细胞植入人骨),联合使用Atrasentan(10 mg/kg,每日腹腔注射)和多西他赛(5 mg/kg,每三天静脉注射一次,共四剂)治疗5周,与未治疗对照组相比,肿瘤体积减少了90%。 联合治疗的抗肿瘤活性显著优于单独使用Atrasentan或多西他赛。 联合治疗组的血清前列腺特异性抗原(PSA)水平显著降低,与肿瘤负荷减少相关。 对联合治疗组肿瘤组织的分析显示,NF-κB DNA结合活性及其下游靶标survivin和Bcl-2的蛋白表达下调,这与体外研究结果一致。 未观察到明显的治疗相关毒性,表现为小鼠体重在研究期间保持稳定。 |
| 酶活实验 |
阿曲生坦用于处理和孵育细胞。两次 PBS 洗涤后,在冰冷的裂解缓冲液中裂解 [1 mM EGTA、1 mM EDTA、1.5 mM Tris (pH 7.4)、150 mM NaCl、1% Triton X-100、2.5 mM PPi 钠、1 mM β-甘油磷酸盐、1 mM 原钒酸钠、1 μg/mL 亮肽素和 1 mM PMSF]。离心提取物以除去任何残留的细胞碎片后,使用二辛可宁酸 (BCA) 蛋白质测定试剂测量上清液中的蛋白质含量。蛋白质 (150 μg) 与琼脂糖酰肼珠交联,并在 4°C 下轻轻摇动孵育整夜。使用裂解缓冲液和激酶测定缓冲液(25 mM Tris (pH 7.5)、10 mM MgCl2、5 mM β-磷酸甘油、0.1 mM 原钒酸钠、2 mM DTT)洗涤免疫沉淀。 Akt 从细胞裂解物中选择性免疫沉淀后,产物两次。然后将产物重悬于 40 μL 激酶测定缓冲液中,其中含有 200 μM ATP 和 1 μg GSK-3α/β 融合蛋白。在 30°C 下运行 30 分钟后,添加 Lamelli SDS 样品缓冲液可停止激酶测定反应。使用10% SDS-PAGE解析反应产物,然后使用抗磷酸化GSK-3α/β抗体进行Western blotting。使用 10% SDS-PAGE 从裂解液样品中分离出 40 μg 蛋白质后,使用抗 Akt 抗体进行蛋白质印迹以确定 Akt 的总量。
|
| 细胞实验 |
所有三种前列腺癌细胞系(LNCaP、C4-2b 和 PC-3 细胞)均以每孔 3 × 103 个细胞的密度接种在 96 孔微量滴定培养板中。过夜孵育后,除去培养基并更换为含有从 10 mM 库存稀释的不同浓度 ABT-627 (0-50 μM) 的新鲜培养基。与药物孵育 72 小时后,向每孔中添加 20 μL MTT 溶液(PBS 中 5 mg/mL)并进一步孵育 2 小时。终止后,吸出上清液,并将代谢活细胞形成的 MTT 甲臜溶解在异丙醇 (100 μL) 中。将板在旋转摇床上混合 30 分钟,并在读板器上测量 595 nm 处的吸光度。
细胞培养与生长抑制实验(MTT法): 将人前列腺癌细胞系(LNCaP、C4-2b、PC-3)接种于96孔板。过夜贴壁后,用浓度递增的Atrasentan(0-50 µM)或固定浓度的Atrasentan(25 µM)单独或与多西他赛(1 nM)联合处理细胞72小时。通过加入MTT溶液评估细胞活力。形成的甲臜产物溶解于异丙醇中,在595 nm波长下测量吸光度。 ELISA法检测细胞凋亡: 用Atrasentan(25 µM)和/或多西他赛(1 nM)处理LNCaP和C4-2b细胞72小时。提取细胞质组蛋白/DNA片段,并使用细胞死亡检测ELISA试剂盒按照说明书进行定量。在405 nm波长下测量吸光度。 流式细胞术检测细胞凋亡: 用Atrasentan(25 µM)和/或多西他赛(1 nM)处理C4-2b细胞48小时。收集细胞,用乙醇固定,用碘化丙啶和RNase A染色,并通过流式细胞仪分析。通过计算亚G0-G1期细胞的比例来确定凋亡细胞的百分比。 蛋白质提取与蛋白质印迹分析: 用Atrasentan(25 µM)和/或多西他赛(1 nM)处理C4-2b细胞72小时。裂解细胞,蛋白质提取物通过SDS-PAGE分离,转印至膜上,并用针对PARP、survivin、Bcl-2、Bcl-xL、Bax、磷酸化Akt、总Akt和β-肌动蛋白的特异性抗体进行检测。 Akt激酶活性测定: 裂解处理后的C4-2b细胞。使用固定化的Akt抗体从裂解液中免疫沉淀Akt。将免疫沉淀物与ATP和GSK-3α/β融合蛋白底物一起孵育。使用磷酸化特异性抗体通过蛋白质印迹检测GSK-3α/β的磷酸化。 电泳迁移率变动分析(EMSA): 从处理后的C4-2b细胞制备核提取物。将提取物与IRDye-700标记的NF-κB寡核苷酸探针孵育。DNA-蛋白质复合物在非变性聚丙烯酰胺凝胶上分离,并使用红外成像系统进行显影。 |
| 动物实验 |
Rats are orally given YM598 (0.3, 1, and 3 mg/kg), atrasentan (0.3, 1, and 3 mg/kg), or 0.5% methyl cellulose as a vehicle using a dosing cannula. 5 mL/kg is the dosage volume for both the test material and the vehicle. The rats are anesthetized with sodium pentobarbital about 20 minutes after the compounds are administered, and they are then pithed and ventilated 30 minutes after the dosage. Big endothelin-1 (1 nmol/kg) is injected intravenously and blood pressure is recorded about an hour after the compounds are taken orally. In these two experiments, linear regression analysis is used to determine the dose of test compound that causes 50% inhibition (ID50) of the big endothelin-1-induced increase in diastolic blood pressure.
SCID-hu Mouse Model of Bone Metastasis: Male CB-17 SCID mice were implanted with a fragment of human fetal bone. After engraftment, C4-2b prostate cancer cells (1x10^6 cells in serum-free medium) were injected directly into the bone marrow space. Treatment Regimen: Therapy began approximately 30 days after tumor cell inoculation, when bone implants showed signs of enlargement. Mice were randomized into four groups (n=7 per group): (1) Untreated control; (2) Atrasentan alone (10 mg/kg body weight, intraperitoneal injection, daily for 5 weeks); (3) Docetaxel alone (5 mg/kg body weight, intravenous injection, every 3rd day for a total of four doses); (4) Combination of Atrasentan and docetaxel, following the same schedules as individual treatments. Tumor Measurement and Sample Collection: Tumor volume was measured twice weekly using calipers. Mice were euthanized one day after the last Atrasentan dose (5 weeks). Tumors were excised, weighed, and processed for histology (H&E staining) and molecular analysis (protein extraction). Serum was collected for PSA measurement. Drug Formulation: The formulation for Atrasentan is not explicitly detailed beyond being dissolved appropriately for intraperitoneal injection. Docetaxel was obtained as a clinical formulation. |
| 参考文献 |
|
| 其他信息 |
Atrasentan is a member of pyrrolidines.
Atrasentan is a substance that is being studied in the treatment of cancer. It belongs to the family of drugs called endothelin-1 protein receptor antagonists. It is a novel, selective endothelin A receptor antagonist (SERA). A pyrrolidine and benzodioxole derivative that acts a RECEPTOR, ENDOTHELIN A antagonist. It has therapeutic potential as an antineoplastic agent and for the treatment of DIABETIC NEPHROPATHIES. Drug Indication Investigated for use/treatment in prostate cancer and cancer/tumors (unspecified). Atrasentan is an orally bioavailable, selective ETA receptor antagonist. By blocking the interaction of endothelin-1 (ET-1) with its ETA receptor, it inhibits ET-1-mediated signaling pathways that promote prostate cancer cell survival, proliferation, and osteoblastic bone metastasis. This study provides preclinical evidence that combining Atrasentan with the chemotherapeutic agent docetaxel results in superior antitumor efficacy in vitro and in vivo compared to monotherapy, particularly in androgen receptor-positive prostate cancer models. The enhanced activity is mechanistically linked to the cooperative down-regulation of the Akt/NF-κB survival signaling axis and its downstream anti-apoptotic targets (e.g., Bcl-2, survivin). The findings support the potential clinical investigation of Atrasentan in combination with taxane-based chemotherapy for the treatment of metastatic prostate cancer. |
| 分子式 |
C29H38N2O6
|
|---|---|
| 分子量 |
510.62182
|
| 精确质量 |
510.273
|
| 元素分析 |
C, 68.21; H, 7.50; N, 5.49; O, 18.80
|
| CAS号 |
173937-91-2
|
| 相关CAS号 |
Atrasentan hydrochloride; 195733-43-8; 178738-96-0 (sodium); 195704-72-4
|
| PubChem CID |
159594
|
| 外观&性状 |
White to light yellow solid powder
|
| 密度 |
1.188g/cm3
|
| 沸点 |
659.4ºC at 760mmHg
|
| 闪点 |
352.6ºC
|
| 蒸汽压 |
2.76E-18mmHg at 25°C
|
| LogP |
4.631
|
| tPSA |
88.54
|
| 氢键供体(HBD)数目 |
1
|
| 氢键受体(HBA)数目 |
7
|
| 可旋转键数目(RBC) |
12
|
| 重原子数目 |
37
|
| 分子复杂度/Complexity |
734
|
| 定义原子立体中心数目 |
3
|
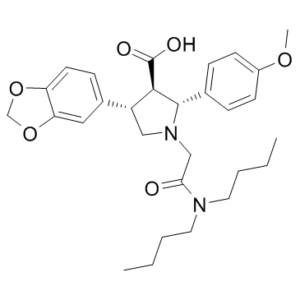
| SMILES |
O=C([C@H]1[C@H](C2=CC=C(OC)C=C2)N(CC(N(CCCC)CCCC)=O)C[C@@H]1C3=CC=C(OCO4)C4=C3)O
|
| InChi Key |
MOTJMGVDPWRKOC-QPVYNBJUSA-N
|
| InChi Code |
InChI=1S/C29H38N2O6/c1-4-6-14-30(15-7-5-2)26(32)18-31-17-23(21-10-13-24-25(16-21)37-19-36-24)27(29(33)34)28(31)20-8-11-22(35-3)12-9-20/h8-13,16,23,27-28H,4-7,14-15,17-19H2,1-3H3,(H,33,34)/t23-,27-,28+/m1/s1
|
| 化学名 |
(2R,3R,4S)-4-(1,3-benzodioxol-5-yl)-1-[2-(dibutylamino)-2-oxoethyl]-2-(4-methoxyphenyl)pyrrolidine-3-carboxylic acid
|
| 别名 |
ABT-627; (+)-A 127722; ABT627; ABT 627; ABT-627; NSC720763; A147627; Abbott 147627; trade name: Xinlay; A-147627
|
| HS Tariff Code |
2934.99.9001
|
| 存储方式 |
Powder -20°C 3 years 4°C 2 years In solvent -80°C 6 months -20°C 1 month |
| 运输条件 |
Room temperature (This product is stable at ambient temperature for a few days during ordinary shipping and time spent in Customs)
|
| 溶解度 (体外实验) |
May dissolve in DMSO (in most cases), if not, try other solvents such as H2O, Ethanol, or DMF with a minute amount of products to avoid loss of samples
|
|---|---|
| 溶解度 (体内实验) |
注意: 如下所列的是一些常用的体内动物实验溶解配方,主要用于溶解难溶或不溶于水的产品(水溶度<1 mg/mL)。 建议您先取少量样品进行尝试,如该配方可行,再根据实验需求增加样品量。
注射用配方
注射用配方1: DMSO : Tween 80: Saline = 10 : 5 : 85 (如: 100 μL DMSO → 50 μL Tween 80 → 850 μL Saline)(IP/IV/IM/SC等) *生理盐水/Saline的制备:将0.9g氯化钠/NaCl溶解在100 mL ddH ₂ O中,得到澄清溶液。 注射用配方 2: DMSO : PEG300 :Tween 80 : Saline = 10 : 40 : 5 : 45 (如: 100 μL DMSO → 400 μL PEG300 → 50 μL Tween 80 → 450 μL Saline) 注射用配方 3: DMSO : Corn oil = 10 : 90 (如: 100 μL DMSO → 900 μL Corn oil) 示例: 以注射用配方 3 (DMSO : Corn oil = 10 : 90) 为例说明, 如果要配制 1 mL 2.5 mg/mL的工作液, 您可以取 100 μL 25 mg/mL 澄清的 DMSO 储备液,加到 900 μL Corn oil/玉米油中, 混合均匀。 View More
注射用配方 4: DMSO : 20% SBE-β-CD in Saline = 10 : 90 [如:100 μL DMSO → 900 μL (20% SBE-β-CD in Saline)] 口服配方
口服配方 1: 悬浮于0.5% CMC Na (羧甲基纤维素钠) 口服配方 2: 悬浮于0.5% Carboxymethyl cellulose (羧甲基纤维素) 示例: 以口服配方 1 (悬浮于 0.5% CMC Na)为例说明, 如果要配制 100 mL 2.5 mg/mL 的工作液, 您可以先取0.5g CMC Na并将其溶解于100mL ddH2O中,得到0.5%CMC-Na澄清溶液;然后将250 mg待测化合物加到100 mL前述 0.5%CMC Na溶液中,得到悬浮液。 View More
口服配方 3: 溶解于 PEG400 (聚乙二醇400) 请根据您的实验动物和给药方式选择适当的溶解配方/方案: 1、请先配制澄清的储备液(如:用DMSO配置50 或 100 mg/mL母液(储备液)); 2、取适量母液,按从左到右的顺序依次添加助溶剂,澄清后再加入下一助溶剂。以 下列配方为例说明 (注意此配方只用于说明,并不一定代表此产品 的实际溶解配方): 10% DMSO → 40% PEG300 → 5% Tween-80 → 45% ddH2O (或 saline); 假设最终工作液的体积为 1 mL, 浓度为5 mg/mL: 取 100 μL 50 mg/mL 的澄清 DMSO 储备液加到 400 μL PEG300 中,混合均匀/澄清;向上述体系中加入50 μL Tween-80,混合均匀/澄清;然后继续加入450 μL ddH2O (或 saline)定容至 1 mL; 3、溶剂前显示的百分比是指该溶剂在最终溶液/工作液中的体积所占比例; 4、 如产品在配制过程中出现沉淀/析出,可通过加热(≤50℃)或超声的方式助溶; 5、为保证最佳实验结果,工作液请现配现用! 6、如不确定怎么将母液配置成体内动物实验的工作液,请查看说明书或联系我们; 7、 以上所有助溶剂都可在 Invivochem.cn网站购买。 |
| 制备储备液 | 1 mg | 5 mg | 10 mg | |
| 1 mM | 1.9584 mL | 9.7920 mL | 19.5840 mL | |
| 5 mM | 0.3917 mL | 1.9584 mL | 3.9168 mL | |
| 10 mM | 0.1958 mL | 0.9792 mL | 1.9584 mL |
1、根据实验需要选择合适的溶剂配制储备液 (母液):对于大多数产品,InvivoChem推荐用DMSO配置母液 (比如:5、10、20mM或者10、20、50 mg/mL浓度),个别水溶性高的产品可直接溶于水。产品在DMSO 、水或其他溶剂中的具体溶解度详见上”溶解度 (体外)”部分;
2、如果您找不到您想要的溶解度信息,或者很难将产品溶解在溶液中,请联系我们;
3、建议使用下列计算器进行相关计算(摩尔浓度计算器、稀释计算器、分子量计算器、重组计算器等);
4、母液配好之后,将其分装到常规用量,并储存在-20°C或-80°C,尽量减少反复冻融循环。
计算结果:
工作液浓度: mg/mL;
DMSO母液配制方法: mg 药物溶于 μL DMSO溶液(母液浓度 mg/mL)。如该浓度超过该批次药物DMSO溶解度,请首先与我们联系。
体内配方配制方法:取 μL DMSO母液,加入 μL PEG300,混匀澄清后加入μL Tween 80,混匀澄清后加入 μL ddH2O,混匀澄清。
(1) 请确保溶液澄清之后,再加入下一种溶剂 (助溶剂) 。可利用涡旋、超声或水浴加热等方法助溶;
(2) 一定要按顺序加入溶剂 (助溶剂) 。
| NCT Number | Recruitment | interventions | Conditions | Sponsor/Collaborators | Start Date | Phases |
| NCT04573478 | Active Recruiting |
Drug: Atrasentan Drug: Placebo |
Immunoglobulin A Nephropathy IgA Nephropathy |
Chinook Therapeutics U.S., Inc. | December 11, 2020 | Phase 3 |
| NCT04573920 | Recruiting | Drug: Atrasentan | IgA Nephropathy Alport Syndrome |
Chinook Therapeutics U.S., Inc. | February 1, 2021 | Phase 2 |
| NCT05834738 | Active Recruiting |
Drug: Atrasentan Drug: Placebo |
Immunoglobulin A Nephropathy IgA Nephropathy |
Chinook Therapeutics, Inc. | July 20, 2023 | Phase 2 |
| NCT02118714 | Completed | Drug: Atrasentan | Nephropathy Diabetes |
AbbVie | April 6, 2015 | Phase 2 |
| NCT00181558 | Completed | Drug: Atrasentan Drug: Zoledronic Acid (Zometa) |
Adenocarcinoma of the Prostate Prostate Cancer |
Massachusetts General Hospital | December 2001 | Phase 2 |