| 规格 | 价格 | |
|---|---|---|
| 500mg | ||
| 1g | ||
| Other Sizes |
| 靶点 |
BCL-2
|
|---|---|
| 体外研究 (In Vitro) |
A-1211212选择性抑制BCL-2,A-1331852选择性抑制BCL-XL。
|
| 体内研究 (In Vivo) |
为了在体内检查这些影响,我们评估了口服生物可利用的BCL-2家族抑制剂,包括A-874009(navitoclax的一种密切类似物)、A-1211212(venetoclax的一个密切相似物)和A-1331852(图4A)。在评估其循环血小板和中性粒细胞计数之前,雄性Sprague-Dawley大鼠每天服用每种化合物5天,单独服用或与单剂量多西他赛(5mg/kg)联合服用。多西他赛显著降低了中性粒细胞计数,与赋形剂对照组的平均值相比,减少了61%(P<0.01)至71%(P<0.01)(图6C)。用BCL-2/BCL-XL双重抑制剂A-874009或BCL-2选择性抑制剂A-1211212治疗的大鼠中性粒细胞也减少了,在这两种情况下,与各自的载体治疗组相比,中性粒细胞减少了41%(P<0.01)。然而,服用BCL-XL选择性抑制剂A-1331852的大鼠没有表现出对粒细胞生成的抑制作用,反而表现出中性粒细胞计数的增加。当将多西他赛与A-874009、A-1211212或A-1331852的组合与单独使用多西他赛进行比较时,中性粒细胞抑制的差异没有达到统计学意义(分别为P=0.383、0.981和0.773)。双重BCL-2/BCL-XL和BCL-XL选择性抑制剂均能显著减少循环血小板(P<0.01),尽管BCL-2选择性化合物A-1211212没有(图6C)。这与BCL-XL维持血小板存活是一致的,并表明中性粒细胞抑制的缺乏不是由于A-1331852暴露不足造成的。https://pubmed.ncbi.nlm.nih.gov/25787766/
在炎症性肠病(IBD)中,炎症是由淋巴细胞的过度反应维持的。这是由于抗凋亡B细胞淋巴瘤(BCL-2)和BCL-XL的表达增强,与周转减少有关。硫唑嘌呤(AZA)直接靶向BCL-2家族介导的细胞凋亡。我们研究了BCL-2家族表达模式是否可用于预测对AZA的治疗反应,并确定BCL-2抑制剂A-1211212是否能有效减少结肠炎模型中的淋巴细胞并改善炎症。BCL-2家族表达模式通过下一代测序(NGS)确定。对Il10-/-小鼠口服BCL-2抑制剂。使用ADVIA 2120进行血液学分析,并使用定量聚合酶链式反应(qPCR)和荧光激活细胞分选仪(FACS)研究免疫细胞的变化。我们确定了缓解期患者和难治性患者中BCL-2家族成员的相似表达水平,表明BCL-2家庭表达不能预测AZA治疗反应。表达与改良的Truelove和Witts活动指数(MTWAI)无关。BCL-2抑制剂引发了AZA难治患者T细胞的细胞死亡,并降低了Il10-/-小鼠的淋巴细胞计数。FACS显示,在IL-10-/-小鼠中,BCL-2抑制剂后CD8+T细胞减少,但不影响血小板。BCL-2抑制剂可降低Tnf、Il1β、Ifn和Mcp-1A-1211212积极改变小鼠结肠黏膜,改善炎症。促凋亡BCL-2抑制剂A-1211212可减少淋巴细胞,改善Il10-/-小鼠的结肠炎,而不会诱导血小板减少症。BCL-2抑制可能成为AZA难治患者的新治疗选择。https://pubmed.ncbi.nlm.nih.gov/29745420/ |
| 酶活实验 |
结合亲和力测定[1]
如前所述,对BCL-2、BCL-XL和MCL-1进行了时间分辨荧光共振能量转移(TR-FRET)结合亲和力测定。使用帝肯Gemini机器人从500μM开始在DMSO中连续稀释化合物。使用帝肯Temo在测定缓冲液中进行1:10的中间稀释,并将10μL转移到白色384孔低容量Corning#3673测定板上(2×起始浓度;10%DMSO)。然后将10μL的蛋白质/探针/抗体混合物添加到每个孔中,最终浓度如下:1 nM GST标记的蛋白质、1 nM铽抗GST抗体和100 nM俄勒冈绿标记的BAK肽。然后将样品在室温下平衡1小时。对于每种测定,探针/抗体和蛋白质/探针/抗体分别作为阴性和阳性对照包含在每个测定板上。在Envision平板阅读器上使用340nm激发滤光片和520nm(f-BAK)和495nm(Tb标记的抗His抗体)发射滤光片测量时间分辨荧光。离解常数(Ki)使用王方程[1]确定。
|
| 细胞实验 |
细胞增殖和存活率测定[1]
将癌症乳腺细胞系以每孔5000个细胞接种在96细胞板中,并用9×3剂量基质中的化合物组合处理,其中以三倍步骤(20-0.001μM)稀释的navitoclax、venetoclax和a-1155463,以及50、5.0或0.5 nM的多烯紫杉醇。在评估存活率之前,将细胞孵育72小时。NSCLC细胞系在5×5剂量基质中用化合物组合治疗72小时,并如前所述进行评估[1]。将卵巢癌症细胞系以每孔10000个细胞接种在96细胞板中,并在9×3剂量的基质中用化合物组合处理48小时。以三倍的步骤稀释多西他赛(10-1.1 nM)。Navitoclax、venetoclax和A-1155463分两步稀释(20-0.08μM)。[1]
菌落形成试验[1] 来源于正常人骨髓(BM)的造血前体细胞在添加了30 ng mL-1重组人粒细胞集落刺激因子(rhGCSF)的MethoCult 4230甲基纤维素基培养基中与不同浓度的navitoclax、venetoclax或A-1155463±5 nM多西他赛孵育。DMSO用于制备所有测试化合物的储备溶液,并在所有孔中以<0.002%的终浓度存在。将来自三个不同批次(BM07B21195、BM0080512A和BM5H09)的冷冻BM光密度细胞在37°C下快速解冻,在补充了2%胎牛血清(IMDM+2%FBS)的10 mL Iscove改良Dulbecco's培养基(IMDM)中洗涤一次,然后重新悬浮在IMDM+2%FBS中。将2.4-4.3×104个活细胞接种在6孔板的每个孔中,并在37°C(5%CO2)下在试验化合物的存在下孵育14-16天。由训练有素的技术人员使用光学显微镜计数包含至少30个粒细胞的集落形成单元。每种条件都进行了三次测试,以确定平均菌落数+/-一个标准差。 |
| 动物实验 |
Rat studies [1]
Three separate rat studies were conducted using male Sprague Dawley rats (Crl:CD). Each study consisted of four arms, with 10 rats per arm: vehicle control PO daily for 5 consecutive days, docetaxel dosed IV as a single dose on day 1, BCL-XL, BCL-2, or BCLXL/ BCL-2 inhibitors dosed PO daily for 5 consecutive days, and BCL-XL, BCL-2, or BCLXL/ BCL-2 inhibitors in combination with docetaxel (docetaxel was dosed as a single dose on day 1, followed immediately by a dose of BCL-2 family inhibitor, and continued daily doses of inhibitor on days 2-5). Control rats were dosed with vehicle: 80% PEG/20% TPGS at 2 mL/kg for the study with BCL-XL inhibitor A-1331852, a 20/80 mixture of Vitamin E TPGS/PEG400 and 0.9% Phosphate Buffered Saline at 5 mL/kg for the study with BCL-2 inhibitor A-1211212, and 10% ethanol/30% PEG-400/60% Phosal 50 PG for the study with the BCL-2/BCL-XL dual inhibitor A-874009. In each study, rats were dosed with docetaxel as a single agent, via intravenous (IV) bolus at a dose of 5 mg kg-1 (10 mL kg-1 volume) or with the inhibitors as single agents at 7 mg kg-1 (2 mL kg-1 volume) of A-1331852, 50 mg kg-1 (5 mL kg-1 volume) of A- 1211212, or 30 mg kg-1 (5 mL kg-1 volume) of A-874009. For the combination dosing, an IV bolus of 5 mg kg-1 of docetaxel was immediately followed by a dose of 7 mg kg-1 of A-1331852, 50 mg kg-1 of A-1211212, or 30 mg kg-1 of A-874009. Murine spontaneous colitis model and treatment with BCL‐2 inhibitors[2] Wild‐type (WT) mice, B.6129P2‐IL‐10tm1Cgn/J (Il10–/–) and B.6129P2‐Il10tm1Cgn/J × B6.129‐Bcl2l11tm1.1Ast/J (Il10–/– × Bim–/–) mice weighing 25–30 g were used. A‐1211212 (AbbVie) was applied by oral gavage (p.o., 3, 10, 30, 100 mg/kg/day) dissolved in 30 % polyethylene glycol 400, 60 % phosal PG 50 and 10 % ethanol. ABT‐737 was injected intraperitoneally (i.p., 50 mg/kg/day) dissolved in polyethylene glycol, Tween 80, dextrose solution and DMSO. Animals were killed on day 14 of treatment.https://pubmed.ncbi.nlm.nih.gov/29745420/ |
| 参考文献 | |
| 其他信息 |
The BCL-2/BCL-XL/BCL-W inhibitor ABT-263 (navitoclax) has shown promising clinical activity in lymphoid malignancies such as chronic lymphocytic leukemia. However, its efficacy in these settings is limited by thrombocytopenia caused by BCL-XL inhibition. This prompted the generation of the BCL-2-selective inhibitor venetoclax (ABT-199/GDC-0199), which demonstrates robust activity in these cancers but spares platelets. Navitoclax has also been shown to enhance the efficacy of docetaxel in preclinical models of solid tumors, but clinical use of this combination has been limited by neutropenia. We used venetoclax and the BCL-XL-selective inhibitors A-1155463 and A-1331852 to assess the relative contributions of inhibiting BCL-2 or BCL-XL to the efficacy and toxicity of the navitoclax-docetaxel combination. Selective BCL-2 inhibition suppressed granulopoiesis in vitro and in vivo, potentially accounting for the exacerbated neutropenia observed when navitoclax was combined with docetaxel clinically. By contrast, selectively inhibiting BCL-XL did not suppress granulopoiesis but was highly efficacious in combination with docetaxel when tested against a range of solid tumors. Therefore, BCL-XL-selective inhibitors have the potential to enhance the efficacy of docetaxel in solid tumors and avoid the exacerbation of neutropenia observed with navitoclax. These studies demonstrate the translational utility of this toolkit of selective BCL-2 family inhibitors and highlight their potential as improved cancer therapeutics.[1]
|
| 分子式 |
C47H54CLN7O7S
|
|---|---|
| 分子量 |
896.492369174957
|
| 精确质量 |
895.349
|
| 元素分析 |
C, 62.97; H, 6.07; Cl, 3.95; N, 10.94; O, 12.49; S, 3.58
|
| CAS号 |
1257044-75-9
|
| PubChem CID |
49846946
|
| 外观&性状 |
Typically exists as solid at room temperature
|
| LogP |
9
|
| tPSA |
183Ų
|
| 氢键供体(HBD)数目 |
3
|
| 氢键受体(HBA)数目 |
11
|
| 可旋转键数目(RBC) |
13
|
| 重原子数目 |
63
|
| 分子复杂度/Complexity |
1690
|
| 定义原子立体中心数目 |
0
|
| InChi Key |
CSBKUBOVPUXFLO-UHFFFAOYSA-N
|
| InChi Code |
InChI=1S/C47H54ClN7O7S/c1-47(2)18-16-34(41(27-47)32-6-8-35(48)9-7-32)30-53-20-22-54(23-21-53)36-10-14-40(44(25-36)62-38-24-33-17-19-49-45(33)51-29-38)46(56)52-63(59,60)39-13-15-42(43(26-39)55(57)58)50-28-31-4-11-37(61-3)12-5-31/h6-10,13-15,17,19,24-26,29,31,37,50H,4-5,11-12,16,18,20-23,27-28,30H2,1-3H3,(H,49,51)(H,52,56)
|
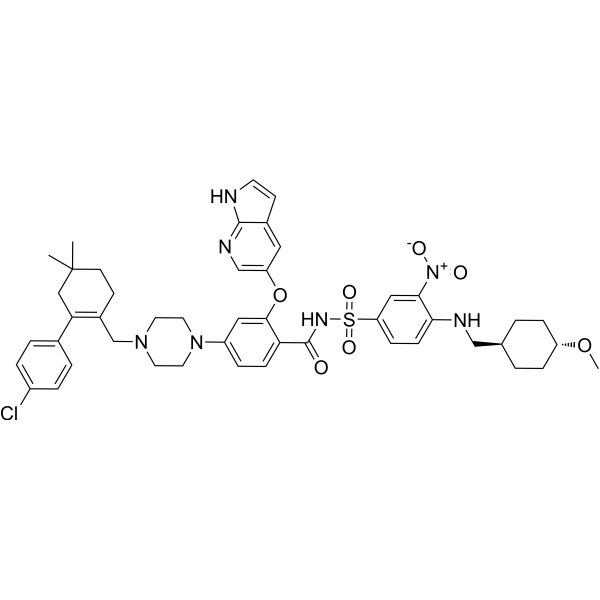
| 化学名 |
4-[4-[[2-(4-chlorophenyl)-4,4-dimethylcyclohexen-1-yl]methyl]piperazin-1-yl]-N-[4-[(4-methoxycyclohexyl)methylamino]-3-nitrophenyl]sulfonyl-2-(1H-pyrrolo[2,3-b]pyridin-5-yloxy)benzamide
|
| 别名 |
BCL2IN1; Bcl2-IN-1; 1257044-75-9; A-1211212; SCHEMBL523882; SCHEMBL523883; SCHEMBL1699818; CHEMBL3985475; CHEMBL4228713;
|
| HS Tariff Code |
2934.99.9001
|
| 存储方式 |
Powder -20°C 3 years 4°C 2 years In solvent -80°C 6 months -20°C 1 month |
| 运输条件 |
Room temperature (This product is stable at ambient temperature for a few days during ordinary shipping and time spent in Customs)
|
| 溶解度 (体外实验) |
May dissolve in DMSO (in most cases), if not, try other solvents such as H2O, Ethanol, or DMF with a minute amount of products to avoid loss of samples
|
|---|---|
| 溶解度 (体内实验) |
注意: 如下所列的是一些常用的体内动物实验溶解配方,主要用于溶解难溶或不溶于水的产品(水溶度<1 mg/mL)。 建议您先取少量样品进行尝试,如该配方可行,再根据实验需求增加样品量。
注射用配方
注射用配方1: DMSO : Tween 80: Saline = 10 : 5 : 85 (如: 100 μL DMSO → 50 μL Tween 80 → 850 μL Saline)(IP/IV/IM/SC等) *生理盐水/Saline的制备:将0.9g氯化钠/NaCl溶解在100 mL ddH ₂ O中,得到澄清溶液。 注射用配方 2: DMSO : PEG300 :Tween 80 : Saline = 10 : 40 : 5 : 45 (如: 100 μL DMSO → 400 μL PEG300 → 50 μL Tween 80 → 450 μL Saline) 注射用配方 3: DMSO : Corn oil = 10 : 90 (如: 100 μL DMSO → 900 μL Corn oil) 示例: 以注射用配方 3 (DMSO : Corn oil = 10 : 90) 为例说明, 如果要配制 1 mL 2.5 mg/mL的工作液, 您可以取 100 μL 25 mg/mL 澄清的 DMSO 储备液,加到 900 μL Corn oil/玉米油中, 混合均匀。 View More
注射用配方 4: DMSO : 20% SBE-β-CD in Saline = 10 : 90 [如:100 μL DMSO → 900 μL (20% SBE-β-CD in Saline)] 口服配方
口服配方 1: 悬浮于0.5% CMC Na (羧甲基纤维素钠) 口服配方 2: 悬浮于0.5% Carboxymethyl cellulose (羧甲基纤维素) 示例: 以口服配方 1 (悬浮于 0.5% CMC Na)为例说明, 如果要配制 100 mL 2.5 mg/mL 的工作液, 您可以先取0.5g CMC Na并将其溶解于100mL ddH2O中,得到0.5%CMC-Na澄清溶液;然后将250 mg待测化合物加到100 mL前述 0.5%CMC Na溶液中,得到悬浮液。 View More
口服配方 3: 溶解于 PEG400 (聚乙二醇400) 请根据您的实验动物和给药方式选择适当的溶解配方/方案: 1、请先配制澄清的储备液(如:用DMSO配置50 或 100 mg/mL母液(储备液)); 2、取适量母液,按从左到右的顺序依次添加助溶剂,澄清后再加入下一助溶剂。以 下列配方为例说明 (注意此配方只用于说明,并不一定代表此产品 的实际溶解配方): 10% DMSO → 40% PEG300 → 5% Tween-80 → 45% ddH2O (或 saline); 假设最终工作液的体积为 1 mL, 浓度为5 mg/mL: 取 100 μL 50 mg/mL 的澄清 DMSO 储备液加到 400 μL PEG300 中,混合均匀/澄清;向上述体系中加入50 μL Tween-80,混合均匀/澄清;然后继续加入450 μL ddH2O (或 saline)定容至 1 mL; 3、溶剂前显示的百分比是指该溶剂在最终溶液/工作液中的体积所占比例; 4、 如产品在配制过程中出现沉淀/析出,可通过加热(≤50℃)或超声的方式助溶; 5、为保证最佳实验结果,工作液请现配现用! 6、如不确定怎么将母液配置成体内动物实验的工作液,请查看说明书或联系我们; 7、 以上所有助溶剂都可在 Invivochem.cn网站购买。 |
| 制备储备液 | 1 mg | 5 mg | 10 mg | |
| 1 mM | 1.1155 mL | 5.5773 mL | 11.1546 mL | |
| 5 mM | 0.2231 mL | 1.1155 mL | 2.2309 mL | |
| 10 mM | 0.1115 mL | 0.5577 mL | 1.1155 mL |
1、根据实验需要选择合适的溶剂配制储备液 (母液):对于大多数产品,InvivoChem推荐用DMSO配置母液 (比如:5、10、20mM或者10、20、50 mg/mL浓度),个别水溶性高的产品可直接溶于水。产品在DMSO 、水或其他溶剂中的具体溶解度详见上”溶解度 (体外)”部分;
2、如果您找不到您想要的溶解度信息,或者很难将产品溶解在溶液中,请联系我们;
3、建议使用下列计算器进行相关计算(摩尔浓度计算器、稀释计算器、分子量计算器、重组计算器等);
4、母液配好之后,将其分装到常规用量,并储存在-20°C或-80°C,尽量减少反复冻融循环。
计算结果:
工作液浓度: mg/mL;
DMSO母液配制方法: mg 药物溶于 μL DMSO溶液(母液浓度 mg/mL)。如该浓度超过该批次药物DMSO溶解度,请首先与我们联系。
体内配方配制方法:取 μL DMSO母液,加入 μL PEG300,混匀澄清后加入μL Tween 80,混匀澄清后加入 μL ddH2O,混匀澄清。
(1) 请确保溶液澄清之后,再加入下一种溶剂 (助溶剂) 。可利用涡旋、超声或水浴加热等方法助溶;
(2) 一定要按顺序加入溶剂 (助溶剂) 。