| 规格 | 价格 | 库存 | 数量 |
|---|---|---|---|
| 5mg |
|
||
| 10mg |
|
||
| 50mg |
|
||
| 100mg |
|
||
| Other Sizes |
|
| 靶点 |
Tubulin; microtubule (IC50 = 18-40 nM)
|
|---|---|
| 体外研究 (In Vitro) |
Cevipabulin(0-50 nM,72 小时)对卵巢、乳腺、前列腺和宫颈区域肿瘤细胞系表现出良好的活性(IC50 值在 18 至 40 nM 之间)[1]。
Cevipabulin (TTI-237) ) 在低浓度 (20–40 nM) 下生成亚 G1 核,并在较高浓度 (>50 nM) 下强烈抑制 G2-M 复合物,根据流式细胞术实验[1]。 TTI-237引起微管蛋白和纯化微管蛋白的明显浑浊。 TTI-237抑制长春花碱与微管蛋白的结合。 TTI-237诱导多纺锤体极和多核细胞。 TTI-237以低于有丝分裂阻滞所需的浓度产生亚G1核。 TTI-237是P-糖蛋白的不良底物。[1] 在TTI-237与微管蛋白异二聚体的低摩尔比(约1:30)下,TTI-237在低温下增强了解聚动力学,但在较高的摩尔比(约1:4)下使聚集体稳定。同样,TTI-237在微管蛋白中诱导的聚集体在低TTI-237:微管蛋白异二聚体摩尔比下被过量钙(++)解聚,但在较高比率下是稳定的。TTI-237抑制微管蛋白异二聚体可交换核苷酸位点的[(3)H]GTP交换,其对HeLa细胞中八种细胞内蛋白质磷酸化的影响与长春新碱相似。 结论:TTI-237具有区别于典型vinca位点和紫杉类位点配体的特性,因此它可能是一类新的微管活性化合物[2]。 西维帕布林(0-50 nM,72 小时)对卵巢癌、乳腺癌、前列腺癌和宫颈癌细胞系具有良好的活性(IC50 值在 18 至 40 nM 之间)[1]。 Cevipabulin (TTI-237) 在浓度大于 50 nM 时表现出显着的 G2-M 阻断作用,尽管低浓度 (20–40 nM) 会导致亚 G1 细胞核 [1]。 |
| 体内研究 (In Vivo) |
Cevipabulin (TTI-2370) 静脉注射和口服给小鼠(每 4 天 5、10、15 和 20 mg/kg,共 4 个周期)对人类肿瘤异种移植物表现出剂量依赖性功效,并且在剂量为 20 和 15 时,具有剂量依赖性。具有良好的抗肿瘤活性[1]。
TTI-237通过静脉注射和口服给药对人类肿瘤异种移植物具有活性。[1] 由于Vinca生物碱和紫杉烷在治疗癌症方面的成功临床应用,TTI-237在两种小鼠异种移植模型中测试了抗肿瘤功效。首先,该化合物在水中具有极好的溶解性,在0.9%生理盐水中配制,静脉注射给患有LoVo人结肠腺癌分期肿瘤的无胸腺小鼠。该化合物以5、10、15和20mg/kg/剂的剂量每4天给药4个周期。该化合物显示出剂量依赖性作用,在20和15mg/kg时具有良好的抗肿瘤活性(图6A)。[1] 在第二个模型中,U87-MG人胶质母细胞瘤TTI-237以25mg/kg的单剂量静脉注射和口服给药给荷瘤小鼠。该化合物通过两种途径的效果大致相同(图6B)。 |
| 酶活实验 |
微管蛋白聚合实验。[1]
在使用前,将微管蛋白或纯化的微管蛋白溶解在冰冷的PEM缓冲液中。使用时,GTP以1 mmol/L的浓度存在于PEM缓冲液中。在未添加GTP的纯化微管蛋白的情况下,PEM缓冲液含有10%(w/v)的甘油。将微管蛋白溶液在Eppendorf 5415C型微量离心机中以最高速度在4°C下离心10分钟,以去除任何颗粒或聚集体。将离心后的上清液以每孔100μL的速度分配到已经含有10μL目标化合物的半面积96孔板的孔中。在加入孔中之前,化合物在用于微管蛋白增溶的相同缓冲液中稀释。最终化合物浓度和微管蛋白浓度如图例所示。在每个实验中,每种化合物在每个浓度下都进行了两次测试。在室温下制备聚合板,最后加入冷微管蛋白溶液。在添加微管蛋白后,尽快将板放入SpectraMax Plus板读数器中,在24°C或35°C下恒温,并使用仪器混合功能混合15秒,每分钟测定每个孔在340 nm处的吸光度,持续60分钟。在反应过程中,340 nm处表观吸光度的增加是浊度外观的衡量标准,据信是由未知形态的微管蛋白聚合物的形成引起的。从该孔的每个后续吸光度读数中减去每个孔在时间0的吸光度,然后取重复值的平均值。为清楚起见,图2和补充图S1至S3显示了其他所有点。 竞争性结合实验。[1] 为了研究Vinca结构域和秋水仙素位点可能存在的竞争,在不利于聚合的条件下进行孵育,因为长春碱和秋水仙碱优先与未聚合的异二聚体结合。将高纯度微管蛋白溶解在不含GTP的PEM缓冲液中,并以1.0至1.3 mg/mL(10-13μmol/L)的终浓度使用。将竞争对手的储备溶液等分加入微管蛋白溶液的等分中,使其最终浓度为100μmol/L,然后加入[3H]长春花碱或[3H]秋水仙素等分,使其分别达到100 nmol/L或50 nmol/L的最终浓度。每个反应进行四次。这些溶液在24°C下孵育1小时,然后应用于MicroSpin G-50柱,在Eppendorf 5415C微型离心机中以3000 rpm离心2分钟。将每个柱流出物(含有微管蛋白和结合的放射性配体)的等分试样与闪烁液混合,并在液体闪烁光谱仪中计数。对照组包括没有竞争对手的样品和含有未标记长春新碱、秋水仙碱或紫杉醇的样品。在没有任何竞争对手的情况下,竞争对手抑制放射性配体结合的能力表示为对照结合的百分比。 微管蛋白聚合: plate protocol [2] 在使用前,将微管蛋白或纯化的微管蛋白溶解在冰冷的PEM缓冲液中。使用时,GTP以1 mM的浓度存在于PEM缓冲液中。将微管蛋白溶液在冰上保持10-15分钟后,在Eppendorf 5415C型微量离心机中以最高速度在4°C下离心10分钟,以去除任何颗粒或聚集体。如前所述,将离心后的上清液分配到½面积96孔板的孔中,并进行以下修改。在30°C下340 nm处记录吸光度增加60分钟后,将板从SpectraMax Plus板读数器中取出,并立即在预冷至4°C的大托盘水中漂浮30分钟。对照实验表明,这比完全解聚对照微管所需的时间长2-3倍。在4°C的温育过程中,无法读取吸光度读数。在4°C孵育结束时,快速干燥平板,并将其放回30°C的SpectraMax Plus中再记录60分钟。低温培养导致的浊度变化显示为2小时记录中吸光度曲线的急剧不连续性。在每个实验中,每个样本都进行了两次测试。微管蛋白、化合物和DMSO的最终浓度如图2的图例所示。在整个测定过程中,每分钟进行一次吸光度测量。 微管蛋白聚合:分光光度计protocol[2] 在配备有六杯自动样品更换器和珀尔帖温度控制器的贝克曼DU7400型分光光度计中,在1cm路径长度的石英比色皿中进行反应。每个试管含有270μl微管蛋白和化合物;蛋白质、化合物和DMSO的最终浓度如图2的图例所示。在24°C下记录聚合反应60分钟,然后将温度升至12°C,再进行解聚60分钟。每分钟记录一次每个样品在340 nm处的吸光度。 微管蛋白聚合:Ca++诱导的解聚[2] 遵循上述分光光度计方案,除了在25°C下记录前60分钟后,通过添加10μl 100 mM CaCl2使所有样品在Ca++中达到3.6 mM。快速混合溶液,并在25°C下继续记录60分钟。每隔1分钟收集一次数据点。 [3H]GTP与纯化微管蛋白的结合[2] 反应在标准平底96孔板中进行。高纯度微管蛋白以11-14μM的异二聚体终浓度使用,化合物以100μM的终浓度使用。在一组实验中,在加入[3H]GTP(终浓度为96.7μM,比活度为0.04 Ci/mmol)之前,首先在室温下将微管蛋白与四份化合物一起孵育30分钟。再孵育30分钟后,将每个样品的等分试样施加到MicroSpin G-50柱上,在Eppendorf 5415C微型离心机中以3000rpm离心2分钟。将每个柱流出物(含有微管蛋白和结合的[3H]GTP)的等分试样与闪烁液混合,并在液体闪烁光谱仪中计数。 |
| 细胞实验 |
细胞毒性测定[1]
细胞类型:人类癌细胞系(SK-OV-3、MDA-MB-435、MDA-MB-468、LnCaP 和 Hela 细胞)。 测试浓度: 0-50 nM 孵育持续时间: 72 hrs(小时) 实验结果: > SK-OV-3、MDA-MB- 435、MDA-MB-468、LnCaP 和 HeLa 细胞中的 IC50 值为 24±8 nM、21±4 nM、18±6 nM、22±7 nM 和 40 nM。 细胞毒性试验。[1] 通过胰蛋白酶消化收获细胞,洗涤、计数并将其分配到96孔平底微量滴定板的孔中,在200μL培养基中每孔1000个细胞。所有平板在37°C的空气中,于5%的CO2加湿环境中孵育约24小时。 在第2天,将用于测试的化合物稀释并加入孔中。将化合物以10至20mmol/L的浓度溶解在DMSO中。对于每种化合物,在DMSO中制备9个连续的2倍稀释液。将每种稀释液10微升转移到100μL培养基中并充分混合,然后将5μL该稀释液一式三份或四份转移到含有细胞的孔中。每种化合物的最终高浓度通常为5μmol/L。所有培养物,包括没有化合物的对照,均含有0.27%的DMSO终浓度。在用测试化合物培养3天后(总共5天),对所有孔进行MTS测定(Promega;CellTiter 96水性非放射性细胞增殖测定)。将每种化合物在每个浓度水平下的平均重复数与浓度作图,将产生最大值(无化合物)和最小值(所有细胞均被杀死)之间一半相对颜色产量的浓度作为IC50值。 免疫荧光显微镜。[1] HeLa细胞在含有10%热灭活胎牛血清、100单位/mL青霉素和100μg/mL链霉素的DMEM中培养。在实验中,细胞以2.5×104/0.5mL/室的Biocoat聚-d-赖氨酸包被的八孔培养载玻片铺板。第二天,将化合物以5μL DMSO的体积加入腔室中,使DMSO的最终浓度为1%。20小时后,从孔中取出培养基,提起腔室侧面,用冰冷的甲醇固定细胞至少10分钟。将载玻片从甲醇中取出并风干。所有剩余步骤均在室温下完成。用两次更换的PBS洗涤细胞(每次10分钟,在科普兰罐中),然后用抗α-微管蛋白单克隆抗体(1:500稀释)在PBS中的1%牛血清白蛋白(BSA;无IgG和无蛋白酶)中孵育1小时。用PBS洗涤细胞两次,每次10分钟。然后在黑暗中用PBS中的1%BSA中的第二抗体[1:100稀释的FITC偶联的山羊抗鼠IgG,F(ab′)2特异性]孵育1 h。用PBS洗两次,各5分钟后,用Hoechst 33258在PBS中以6μg/mL染色10分钟,然后用PBS洗涤两次。最后,将细胞安装在SlowFade Light中,并使用40×UPlanApo空气物镜用奥林巴斯BX61显微镜进行检查。使用Cooke SensiCam CCD成像相机和Sliderule软件采集图像。 流式细胞术。[1] HeLa细胞以1.25×105的密度在2 mL/孔的12孔板中铺板,并培养过夜。然后如图所示加入不同浓度的化合物,继续培养18小时。然后收获细胞,注意从每个孔中回收所有非粘附细胞和粘附细胞。该试剂盒含有用非离子洗涤剂溶解细胞膜脂质、用胰蛋白酶降解结构蛋白、用RNase去除RNA和用精胺稳定核染色质的试剂。用碘化丙啶对清洁的分离核进行染色,并使用Becton Dickinson的FACSCalibur仪器通过流式细胞术进行分析。分析细胞核而不是细胞,因为这种方法在DNA含量估计中具有更高的准确性,而且我们希望检测多核细胞中的细胞核,尽管缺乏核膜的有丝分裂细胞可能无法准确测量。每种化合物都在三个独立的实验中进行了分析,并对数据进行了平均,得出了这里的图表。如图5B所示,通过在群体直方图上直观地设置标记来估计每个细胞周期室中总核的比例。 |
| 动物实验 |
Animal/Disease Models: Athymic nu/nu female mice were implanted subcutaneously (sc) (sc) with 1 × 107 LoVo human colon adenocarcinoma cells in the flank [1].
Doses: 5, 10, 15 and 20 mg/kg Doses: intravenously (iv) (iv)(iv) every 4 days for a total of 4 cycles. Experimental Results: The compound demonstrated dose-dependent effects and had good antitumor activity at 20 and 15 mg/kg. Animal/Disease Models: Athymic nu/nu female mice were implanted with 1 × 106 U87-MG human glioblastoma cells subcutaneously (sc) (sc) in the flank [1]. Doses: 25 mg/kg. Doses: Orally or intravenously (iv) (iv)(iv) on days 0, 7, and 14. Experimental Results: The compound was active against human tumor xenografts administered orally or intravenously (iv) (iv)(iv). Tumor xenograft experiments.[1] Athymic nu/nu female mice were implanted s.c. in the flank with either 1 × 107 LoVo human colon adenocarcinoma cells or 1 × 106 U87-MG human glioblastoma cells. Cells were suspended in culture medium for injection. When tumors attained a mass of between 80 and 120 mg (day 0), animals were randomized into treatment groups each containing 5 to 10 animals. After staging, animals were treated i.v. or p.o. with Cevipabulin (TTI-237) formulated in 0.9% saline or Klucel according to the schedules given in the figure legend or with vehicle alone. Tumor volumes [(length × width2) / 2] were determined at regular intervals. Results are reported as relative tumor growth (mean tumor volume on day measured divided by the mean tumor volume on day 0) as a function of time after staging. The data were analyzed by a one-sided Student's t test. A P value of ≤0.05 indicated a statistically significant reduction in tumor growth of the treated group compared with that of the vehicle control group. |
| 参考文献 | |
| 其他信息 |
Cevipabulin has been used in trials studying the treatment and educational/counseling/training of Tumors and Neoplasms.
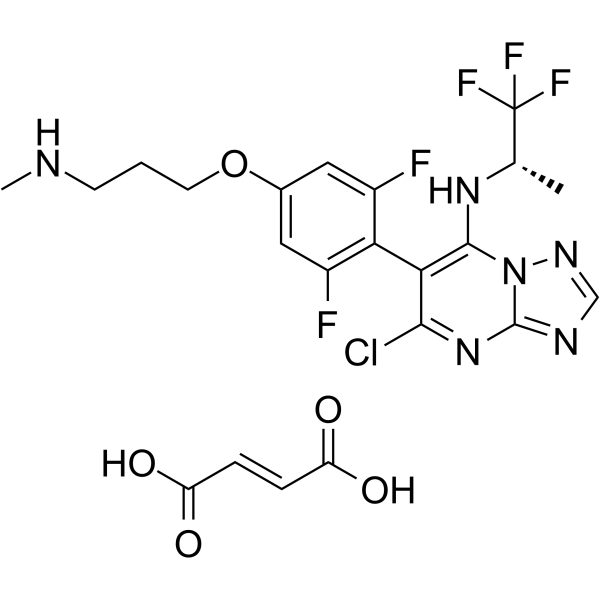
Cevipabulin is a synthetic, water soluble tubulin-binding agent with potential antineoplastic activity. Cevipabulin appears to bind at the vinca-binding site on tubulin, but seems to act more similar to taxane-site binding agents in that it enhances tubulin polymerization and does not induce tubulin depolymerization. The disruption in microtubule dynamics may eventually inhibit cell division and reduce cellular growth. 5-Chloro-6-[2,6-difluoro-4-[3-(methylamino)propoxy]phenyl]-N-[(1S)-2,2,2-trifluoro-1-methylethyl]-[1,2,4]triazolo[1,5-a]pyrimidin-7-amine butanedioate (TTI-237) is a microtubule-active compound of novel structure and function. Structurally, it is one of a class of compounds, triazolo[1,5a]pyrimidines, previously not known to bind to tubulin. Functionally, TTI-237 inhibited the binding of [(3)H]vinblastine to tubulin, but it caused a marked increase in turbidity development that more closely resembled the effect observed with docetaxel than that observed with vincristine. The morphologic character of the presumptive polymer is unknown at present. When applied to cultured human tumor cells at concentrations near its IC(50) value for cytotoxicity (34 nmol/L), TTI-237 induced multiple spindle poles and multinuclear cells, as did paclitaxel, but not vincristine or colchicine. Flow cytometry experiments revealed that, at low concentrations (20-40 nmol/L), TTI-237 produced sub-G(1) nuclei and, at concentrations above 50 nmol/L, it caused a strong G(2)-M block. The compound was a weak substrate of multidrug resistance 1 (multidrug resistance transporter or P-glycoprotein). In a cell line expressing a high level of P-glycoprotein, the IC(50) of TTI-237 increased 25-fold whereas those of paclitaxel and vincristine increased 806-fold and 925-fold, respectively. TTI-237 was not recognized by the MRP or MXR transporters. TTI-237 was active in vivo in several nude mouse xenograft models of human cancer, including LoVo human colon carcinoma and U87-MG human glioblastoma, when dosed i.v. or p.o. Thus, TTI-237 has a set of properties that distinguish it from other classes of microtubule-active compounds.[1] Purpose: To compare TTI-237 (5-chloro-6-[2,6-difluoro-4-[3-(methylamino)propoxy]phenyl]-N-[(1S)-2,2,2-trifluoro-1-methylethyl]-[1, 2, 4]triazolo[1,5-a]pyrimidin-7-amine butanedioate) with paclitaxel and vincristine in order to better understand the properties of this new anti-microtubule agent. Methods: Tubulin polymerization and depolymerization were followed by turbidimetric assays. Effects of compounds on the binding of [(3)H]guanosine triphosphate ([(3)H]GTP) to tubulin were studied by competition binding assays. Effects of compounds on the phosphorylation of a panel of intracellular proteins were determined by flow cytometry using phosphoprotein-specific antibodies. Results: At low molar ratios of TTI-237:tubulin heterodimer (about 1:30), TTI-237 enhanced depolymerization kinetics in response to low temperature, but stabilized the aggregates at higher ratios (about 1:4). Similarly, the aggregates induced in microtubule protein by TTI-237 were depolymerized by excess Ca(++) at low TTI-237:tubulin-heterodimer molar ratios, but were stable at higher ratios. TTI-237 inhibited the exchange of [(3)H]GTP at the exchangeable nucleotide site of the tubulin heterodimer, and was similar to vincristine in its effects on the phosphorylation of eight intracellular proteins in HeLa cells. Conclusions: TTI-237 has properties that distinguish it from typical vinca-site and taxoid-site ligands, and therefore it may exemplify a new class of microtubule-active compounds.[2] |
| 分子式 |
C22H22CLF5N6O5
|
|---|---|
| 分子量 |
580.892301082611
|
| 精确质量 |
580.126
|
| 元素分析 |
C, 42.83; H, 4.25; Cl, 5.75; F, 15.40; N, 13.62; O, 18.15
|
| CAS号 |
849550-67-0
|
| 相关CAS号 |
Cevipabulin;849550-05-6; 852954-81-5 (succinate); 849550-69-2 (fumarate)
|
| PubChem CID |
71587814
|
| 外观&性状 |
White to off-white solid powder
|
| LogP |
4.249
|
| tPSA |
150.97
|
| 氢键供体(HBD)数目 |
4
|
| 氢键受体(HBA)数目 |
15
|
| 可旋转键数目(RBC) |
10
|
| 重原子数目 |
39
|
| 分子复杂度/Complexity |
685
|
| 定义原子立体中心数目 |
1
|
| SMILES |
C[C@@H](C(F)(F)F)NC1=C(C(=NC2=NC=NN12)Cl)C3=C(C=C(C=C3F)OCCCNC)F.C(=C/C(=O)O)\C(=O)O
|
| InChi Key |
TUXZQBYIZLWUKK-AFIAKLHKSA-N
|
| InChi Code |
InChI=1S/C18H18ClF5N6O.C4H4O4/c1-9(18(22,23)24)28-16-14(15(19)29-17-26-8-27-30(16)17)13-11(20)6-10(7-12(13)21)31-5-3-4-25-2;5-3(6)1-2-4(7)8/h6-9,25,28H,3-5H2,1-2H3;1-2H,(H,5,6)(H,7,8)/b;2-1+/t9-;/m0./s1
|
| 化学名 |
(E)-but-2-enedioic acid;5-chloro-6-[2,6-difluoro-4-[3-(methylamino)propoxy]phenyl]-N-[(2S)-1,1,1-trifluoropropan-2-yl]-[1,2,4]triazolo[1,5-a]pyrimidin-7-amine
|
| 别名 |
Cevipabulin fumarate; Cevipabulin fumarate [USAN]; 849550-69-2; UNII-Q380BYV049; Q380BYV049; Cevipabulin fumarate dihydrate; TTI-237; Cevipabulin fumarate (USAN);
|
| HS Tariff Code |
2934.99.9001
|
| 存储方式 |
Powder -20°C 3 years 4°C 2 years In solvent -80°C 6 months -20°C 1 month 注意: 请将本产品存放在密封且受保护的环境中,避免吸湿/受潮。 |
| 运输条件 |
Room temperature (This product is stable at ambient temperature for a few days during ordinary shipping and time spent in Customs)
|
| 溶解度 (体外实验) |
DMSO : ~50 mg/mL (~86.07 mM)
H2O : ~1.43 mg/mL (~2.46 mM) |
|---|---|
| 溶解度 (体内实验) |
注意: 如下所列的是一些常用的体内动物实验溶解配方,主要用于溶解难溶或不溶于水的产品(水溶度<1 mg/mL)。 建议您先取少量样品进行尝试,如该配方可行,再根据实验需求增加样品量。
注射用配方
注射用配方1: DMSO : Tween 80: Saline = 10 : 5 : 85 (如: 100 μL DMSO → 50 μL Tween 80 → 850 μL Saline)(IP/IV/IM/SC等) *生理盐水/Saline的制备:将0.9g氯化钠/NaCl溶解在100 mL ddH ₂ O中,得到澄清溶液。 注射用配方 2: DMSO : PEG300 :Tween 80 : Saline = 10 : 40 : 5 : 45 (如: 100 μL DMSO → 400 μL PEG300 → 50 μL Tween 80 → 450 μL Saline) 注射用配方 3: DMSO : Corn oil = 10 : 90 (如: 100 μL DMSO → 900 μL Corn oil) 示例: 以注射用配方 3 (DMSO : Corn oil = 10 : 90) 为例说明, 如果要配制 1 mL 2.5 mg/mL的工作液, 您可以取 100 μL 25 mg/mL 澄清的 DMSO 储备液,加到 900 μL Corn oil/玉米油中, 混合均匀。 View More
注射用配方 4: DMSO : 20% SBE-β-CD in Saline = 10 : 90 [如:100 μL DMSO → 900 μL (20% SBE-β-CD in Saline)] 口服配方
口服配方 1: 悬浮于0.5% CMC Na (羧甲基纤维素钠) 口服配方 2: 悬浮于0.5% Carboxymethyl cellulose (羧甲基纤维素) 示例: 以口服配方 1 (悬浮于 0.5% CMC Na)为例说明, 如果要配制 100 mL 2.5 mg/mL 的工作液, 您可以先取0.5g CMC Na并将其溶解于100mL ddH2O中,得到0.5%CMC-Na澄清溶液;然后将250 mg待测化合物加到100 mL前述 0.5%CMC Na溶液中,得到悬浮液。 View More
口服配方 3: 溶解于 PEG400 (聚乙二醇400) 请根据您的实验动物和给药方式选择适当的溶解配方/方案: 1、请先配制澄清的储备液(如:用DMSO配置50 或 100 mg/mL母液(储备液)); 2、取适量母液,按从左到右的顺序依次添加助溶剂,澄清后再加入下一助溶剂。以 下列配方为例说明 (注意此配方只用于说明,并不一定代表此产品 的实际溶解配方): 10% DMSO → 40% PEG300 → 5% Tween-80 → 45% ddH2O (或 saline); 假设最终工作液的体积为 1 mL, 浓度为5 mg/mL: 取 100 μL 50 mg/mL 的澄清 DMSO 储备液加到 400 μL PEG300 中,混合均匀/澄清;向上述体系中加入50 μL Tween-80,混合均匀/澄清;然后继续加入450 μL ddH2O (或 saline)定容至 1 mL; 3、溶剂前显示的百分比是指该溶剂在最终溶液/工作液中的体积所占比例; 4、 如产品在配制过程中出现沉淀/析出,可通过加热(≤50℃)或超声的方式助溶; 5、为保证最佳实验结果,工作液请现配现用! 6、如不确定怎么将母液配置成体内动物实验的工作液,请查看说明书或联系我们; 7、 以上所有助溶剂都可在 Invivochem.cn网站购买。 |
| 制备储备液 | 1 mg | 5 mg | 10 mg | |
| 1 mM | 1.7215 mL | 8.6075 mL | 17.2150 mL | |
| 5 mM | 0.3443 mL | 1.7215 mL | 3.4430 mL | |
| 10 mM | 0.1721 mL | 0.8607 mL | 1.7215 mL |
1、根据实验需要选择合适的溶剂配制储备液 (母液):对于大多数产品,InvivoChem推荐用DMSO配置母液 (比如:5、10、20mM或者10、20、50 mg/mL浓度),个别水溶性高的产品可直接溶于水。产品在DMSO 、水或其他溶剂中的具体溶解度详见上”溶解度 (体外)”部分;
2、如果您找不到您想要的溶解度信息,或者很难将产品溶解在溶液中,请联系我们;
3、建议使用下列计算器进行相关计算(摩尔浓度计算器、稀释计算器、分子量计算器、重组计算器等);
4、母液配好之后,将其分装到常规用量,并储存在-20°C或-80°C,尽量减少反复冻融循环。
计算结果:
工作液浓度: mg/mL;
DMSO母液配制方法: mg 药物溶于 μL DMSO溶液(母液浓度 mg/mL)。如该浓度超过该批次药物DMSO溶解度,请首先与我们联系。
体内配方配制方法:取 μL DMSO母液,加入 μL PEG300,混匀澄清后加入μL Tween 80,混匀澄清后加入 μL ddH2O,混匀澄清。
(1) 请确保溶液澄清之后,再加入下一种溶剂 (助溶剂) 。可利用涡旋、超声或水浴加热等方法助溶;
(2) 一定要按顺序加入溶剂 (助溶剂) 。
| NCT Number | Recruitment | interventions | Conditions | Sponsor/Collaborators | Start Date | Phases |
| NCT00195325 | Terminated | Drug: TTI-237 | Tumors Neoplasms |
Wyeth is now a wholly owned subsidiary of Pfizer |
August 2005 | Phase 1 |
| NCT00195247 | Terminated | Drug: TTI-237 Neoplasms |
Neoplasms | Wyeth is now a wholly owned subsidiary of Pfizer |
May 2005 | Phase 1 |