| 规格 | 价格 | 库存 | 数量 |
|---|---|---|---|
| 10mg |
|
||
| 25mg |
|
||
| 50mg |
|
||
| 100mg |
|
||
| 250mg |
|
||
| 500mg |
|
||
| Other Sizes |
|
| 靶点 |
FEMIB E3 ligase; covalent binding mode targeting cysteine
|
|---|---|
| 体外研究 (In Vitro) |
为了鉴定共价FEM1B招募者,我们使用TAMRA偶联的FNIP1562-591 degron和重组小鼠FEM1B在竞争性荧光偏振分析中筛选了566个半胱氨酸反应性共价配体库(图1a-1b,表S1)。通过这一筛选,我们鉴定出氯乙酰胺EN106,其抑制FEM1B-FNIP1 degron荧光偏振的50%抑制浓度(IC50)为2.2μM(图1c-1d)。从最初的筛选来看,EN106对FEM1B与FNIP1去旋器的相互作用显示出最显著的抑制作用(图1b)。EN106显示了与基于凝胶的ABPP用半胱氨酸反应性罗丹明共轭碘乙酰胺(IA罗丹明)探针标记FEM1B的竞争,证实了EN106与FEM1B上的半胱氨酸的直接相互作用(图1e)。通过液相色谱-串联质谱(LC-MS/MS)分析FEM1B胰蛋白酶消化物,对EN106与重组FEM1B的反应性进行分析,结果显示EN106加合物仅存在于C186上,该位点先前被证明对FEM1B底物识别至关重要(图1f)。我们还证明了EN106的非反应性版本NJH-2-082不会抑制FEM1B与FNIP1 degron的相互作用,证实了半胱氨酸反应弹头与C186共价相互作用的重要性(图S1)。[1]
为了确认EN106在细胞中与FEM1B结合,我们合成了NJH-2-030,这是EN106的炔官能化衍生物(图2a)。为了保持C186的接合,通过将苯并二恶烷交换为二氢[1,4]苯并恶嗪支架,将炔烃定位在氯乙酰胺的远端。将起始苯并恶嗪进行Boc保护,得到1,然后还原硝基,得到苯胺2。2与丙烯腈烷基化得到丙腈取代的化合物,将其酰化得到氯乙酰胺3。Boc脱保护和用己-5-炔酰氯酰化提供了炔探针NJH-2-030(图2a)。[1] 为了评估EN106的蛋白质组范围半胱氨酸反应性,我们还进行了竞争性同位素串联正交蛋白水解ABPP(isoTOP ABPP)研究,以定量评估细胞中EN106在蛋白质组范围内的半胱氨酸反应性(图S2;表S2)。虽然我们在化学蛋白质组学实验中没有捕捉到FEM1B,但我们在1465个定量半胱氨酸中只观察到细胞中的两个EN106靶点——HNRNPA3的C63和PRDX3的C127(图S2)。EN106的这些非靶点都不是E3连接酶。鉴于我们在isoTOP ABPP实验中没有检测到FEM1B的C186,我们还在HEK293T细胞中原位使用NJH-2-030探针进行下拉定量蛋白质组学实验,以进一步确认这种紧密的EN106衍生物的靶点参与和蛋白质组范围内的选择性(图2d;表S3)。与DMSO对照组相比,FEM1B是NJH-2-030探针富集最显著的靶标之一,检测到另外四个非靶标——GSTO1、SNX6、SELO和NT5DC1——其中这些蛋白质都不是E3连接酶(图2d;表S3)。这些数据共同表明,EN106或其衍生物在细胞中与FEM1B功能性结合,对其他内源性降解途径成分没有可检测到的脱靶效应。[1] 为了进一步证明EN106破坏了FEM1B在细胞中的底物识别,我们通过流式细胞术监测了与FNIP1 degron连接的GFP的降解,并与HEK293T细胞中同一质粒的IRES驱动的mCherry表达进行了比较EN106处理在FEM1B过表达细胞中以剂量反应方式显著稳定了FNIP1 degron GFP水平,与赋形剂处理的对照组相比(图2e,f)。EN106在缺乏外源表达FEM1B的细胞中增加了FNIP1报告蛋白水平,其程度与之前在缺失FEM1B时观察到的相似,表明该化合物可以靶向内源性E3连接酶(图2e-2f)。EN106不影响E3连接酶cereblon对泊马度胺诱导的无关E4F1 degron的降解(图S3)。因此,这些发现表明EN106不仅参与,而且抑制CUL2FEM1B依赖性泛素化。FNIP1线粒体池的稳定会损害线粒体活性,如耗氧率所示。为了与内源性FEM1B结合并稳定FNIP1,我们发现EN106显著降低了HEK293T细胞中的细胞线粒体耗氧量(图2g)。[1] 为了证明EN106可以在TPD应用中用作共价FEM1B募集剂,我们接下来通过6个不同的连接体将EN106连接到靶向BRD4以及其他BET家族蛋白的BET溴结构域抑制剂JQ1,合成了一系列基于FEM1B的BET溴化结构域降解剂(图3a、图S5)。为了保持炔探针NJH-2-030的核心苯并恶嗪,我们首先连接了一个乙酸酯间隔物以提供甲酯4。硝基被还原,所得苯胺5用丙烯腈单烷基化,并酰化,得到氯乙酰胺中间体6。甲酯在温和的碱性条件下水解,并与具有不同连接体连接的胺7a-7f、JQ1衍生物偶联,得到双功能降解剂NJH-2-088、NJH-1-106、NJH-2-090、NJH-2.091、NJH2-092和NJH-2-02-093(NJH-1-106的方案如图3a所示;图S4)。这些化合物都在HEK293T细胞中不同程度地降解了BRD4,NJH-1-106显示出最佳的降解效力,DC50为250 nM,BRD4的最大降解率为94%(图3b-3c,图S4)。NJH-1-106对FNIP1 degron的FEM1B识别保持抑制活性,IC50为1.5μM(图3d)。这种BRD4降解是时间依赖性的,用NJH-1-106处理4小时后观察到显著降解(图3e-3f)。NJH-106还降解癌症细胞系中的BRD4,包括231MFP乳腺癌症和HAP1白血病癌症细胞系(图S5a–S5b)。[1] 与共价弹头的必要性一致,NJH-1-106、NJH-2-105的非反应性版本没有抑制FEM1B与FNIP1去旋器的相互作用,也没有降解BRD4(图S6a-S6d)。蛋白酶体和NED酰化抑制剂可以减轻BRD4的损失,这与BRD4降解的蛋白酶体和Cullin E3连接酶依赖机制一致(图4a-4b)。NJH-1-106处理HEK293T细胞后,FEM1B水平保持不变(图4a-4b)。用EN106或JQ1预处理细胞也会减弱BRD4的降解,这表明三元复合物和分子两端降解BRD4是必要的(图4c)。此外,与野生型(WT)细胞相比,FEM1B敲除(KO)细胞中的BRD4降解减弱,进一步证明了BRD4的FEM1B依赖性降解(图4d)。我们在FEM1B KO细胞中观察到的不完全拯救可能是由于FEM1B KO群体中残留的野生型细胞或其他潜在的脱靶E3连接酶。用NJH-1-106处理的HEK293T细胞的全球蛋白质组学分析也显示,在4446种定量蛋白质中,BRD4发生了选择性降解,只有大部分未鉴定的PNMAL1是明显的脱靶(图4e;表S4)。然而,PNMAL1可能是我们蛋白质组学分析的假阳性(图S7)。虽然JQ1是一种泛BET溴结构域抑制剂,但我们只观察到BRD4的降解,而没有观察到BRD2或BRD3的降解(表S4)。然而,我们不能排除这些其他溴结构域在较长时间的处理下会被降解。与蛋白质印迹数据相比,观察到的BRD4较小的折叠变化可能反映了基于TMT的定量蛋白质组学中众所周知的折叠变化抑制[1]。 |
| 酶活实验 |
凝胶基ABPP[1]
重组MBP-FEM1B1-377(0.1μg/样品)在25μL PBS中用DMSO载体或EN106或在37°C下预处理30分钟,随后在室温下用IA罗丹明(浓度如图例所示)处理1小时。通过加入4×还原Laemmli-SDS样品加载缓冲液停止反应。在95°C下煮沸5分钟后,将样品在预制的4-20%Criterion TGX凝胶上分离。使用ChemiDoc MP通过凝胶内荧光分析探针标记的蛋白质。 |
| 细胞实验 |
GFP-FNIP1 degron/mHerry的流式细胞术分析[1]
将HEK293T细胞/孔接种到6孔板中。第二天,用0.1μg pCS2-GFP-FNIP1562-591-IRES-mCherry或0.1μg的pCS2-E4F123432-GFP-IRES-mCherry转染细胞,如图所示,用0.075μg的pCS2-3xFLAG-FM1B转染。每次转染时,将空的pCS2加入到含有12μg聚乙烯亚胺(PEI)的300μl Opti-MEM中的2μg总DNA中。用65μl转染混合物转染每个孔。转染后12小时,加入指示浓度的EN106或DMSO。经过12小时的EN106处理后,细胞被胰蛋白酶消化,离心,重新悬浮在DMEM+10%FBS中,并在Fortessa X20上进行分析。使用FlowJo处理数据,所有定量均为GFP/mHerry比值的中位数。对于泊马度胺处理的细胞,在分析前加入10μM泊马度酰胺4小时。 |
| 参考文献 | |
| 其他信息 |
Proteolysis-targeting chimeras (PROTACs), heterobifunctional compounds that consist of protein-targeting ligands linked to an E3 ligase recruiter, have arisen as a powerful therapeutic modality for targeted protein degradation (TPD). Despite the popularity of TPD approaches in drug discovery, only a small number of E3 ligase recruiters are available for the >600 E3 ligases that exist in human cells. Here, we have discovered a cysteine-reactive covalent ligand, EN106, that targets FEM1B, an E3 ligase recently discovered as the critical component of the cellular response to reductive stress. By targeting C186 in FEM1B, EN106 disrupts recognition of the key reductive stress substrate of FEM1B, FNIP1. We further establish that EN106 can be used as a covalent recruiter for FEM1B in TPD applications by demonstrating that a PROTAC linking EN106 to the BET bromodomain inhibitor JQ1 or the kinase inhibitor dasatinib leads to the degradation of BRD4 and BCR-ABL, respectively. Our study showcases a covalent ligand that targets a natural E3 ligase-substrate binding site and highlights the utility of covalent ligand screening in expanding the arsenal of E3 ligase recruiters suitable for TPD applications. [1]
In this study, we discovered the covalent recruiter EN106 against FEM1B, the E3 ligase controlling the reductive stress response, that can be used for TPD applications. While zinc has been discovered to be a molecular glue that brings together FEM1B with its endogenous substrate FNIP1, EN106 represents the first synthetic small-molecule ligand against FEM1B. While EN106 is an early hit tool compound with low micromolar potency against FEM1B with a metabolically unstable chloroacetamide warhead and requires further medicinal chemistry efforts to improve potency, selectivity, and drug-like properties, we demonstrate that EN106 targets a cysteine residue in FEM1B that is essential for substrate recognition. We show that EN106 can be used as a FEM1B recruiter in bifunctional degraders to recruit potential neo-substrates to the physiological target recognition site of FEM1B, likely placing them in an optimal manner for ubiquitylation through CUL2-RBX1. Surprisingly, we observed BRD4 degradation with all of the FEM1B-based BRD4 PROTACs regardless of linker length, although there were preferences for optimal Dmax and DC50s. These data could potentially suggest that positive cooperativity is less crucial with a covalent FEM1B degrader as long as protein clashes are avoided. Future studies will be needed to determine whether EN106 or its derivatives can act as molecular glue degraders to recruit potential neo-substrates for FEM1B-dependent ubiquitylation and degradation. More broadly, it will also be of future interest to determine whether cell-state specific degraders can be developed. Additionally, determining whether EN106 and more potent derivatives can be used therapeutically to inhibit CUL2FEM1B and disrupt reductive stress signaling through stabilization on FNIP1 in certain cancer settings would be of future interest. Overall, our study underscores the utility of covalent ligand screening in expanding the scope of E3 ligase recruiters for TPD applications. [1] |
| 分子式 |
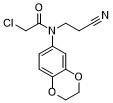
C13H13CLN2O3
|
|---|---|
| 分子量 |
280.706922292709
|
| 精确质量 |
280.06
|
| 元素分析 |
C, 55.62; H, 4.67; Cl, 12.63; N, 9.98; O, 17.10
|
| CAS号 |
757192-67-9
|
| PubChem CID |
5100616
|
| 外观&性状 |
White to off-white solid powder
|
| 密度 |
1.351±0.06 g/cm3(Predicted)
|
| 沸点 |
489.1±45.0 °C(Predicted)
|
| LogP |
1.3
|
| tPSA |
62.6
|
| 氢键供体(HBD)数目 |
0
|
| 氢键受体(HBA)数目 |
4
|
| 可旋转键数目(RBC) |
4
|
| 重原子数目 |
19
|
| 分子复杂度/Complexity |
368
|
| 定义原子立体中心数目 |
0
|
| SMILES |
ClCC(N(CCC#N)C1C=CC2=C(C=1)OCCO2)=O
|
| InChi Key |
GLDJSVHDOXCYPT-UHFFFAOYSA-N
|
| InChi Code |
InChI=1S/C13H13ClN2O3/c14-9-13(17)16(5-1-4-15)10-2-3-11-12(8-10)19-7-6-18-11/h2-3,8H,1,5-7,9H2
|
| 化学名 |
2-chloro-N-(2-cyanoethyl)-N-(2,3-dihydro-1,4-benzodioxin-6-yl)acetamide
|
| 别名 |
EN106; EN-106; 757192-67-9; 2-chloro-N-(2-cyanoethyl)-N-(2,3-dihydro-1,4-benzodioxin-6-yl)acetamide; 2-chloro-N-(2-cyanoethyl)-N-2,3-dihydro-1,4-benzodioxin-6-ylacetamide; CHEMBL5289726; SCHEMBL23804991; DTXSID001152090; EN 106
|
| HS Tariff Code |
2934.99.9001
|
| 存储方式 |
Powder -20°C 3 years 4°C 2 years In solvent -80°C 6 months -20°C 1 month |
| 运输条件 |
Room temperature (This product is stable at ambient temperature for a few days during ordinary shipping and time spent in Customs)
|
| 溶解度 (体外实验) |
DMSO : ~250 mg/mL (~890.60 mM)
|
|---|---|
| 溶解度 (体内实验) |
注意: 如下所列的是一些常用的体内动物实验溶解配方,主要用于溶解难溶或不溶于水的产品(水溶度<1 mg/mL)。 建议您先取少量样品进行尝试,如该配方可行,再根据实验需求增加样品量。
注射用配方
注射用配方1: DMSO : Tween 80: Saline = 10 : 5 : 85 (如: 100 μL DMSO → 50 μL Tween 80 → 850 μL Saline)(IP/IV/IM/SC等) *生理盐水/Saline的制备:将0.9g氯化钠/NaCl溶解在100 mL ddH ₂ O中,得到澄清溶液。 注射用配方 2: DMSO : PEG300 :Tween 80 : Saline = 10 : 40 : 5 : 45 (如: 100 μL DMSO → 400 μL PEG300 → 50 μL Tween 80 → 450 μL Saline) 注射用配方 3: DMSO : Corn oil = 10 : 90 (如: 100 μL DMSO → 900 μL Corn oil) 示例: 以注射用配方 3 (DMSO : Corn oil = 10 : 90) 为例说明, 如果要配制 1 mL 2.5 mg/mL的工作液, 您可以取 100 μL 25 mg/mL 澄清的 DMSO 储备液,加到 900 μL Corn oil/玉米油中, 混合均匀。 View More
注射用配方 4: DMSO : 20% SBE-β-CD in Saline = 10 : 90 [如:100 μL DMSO → 900 μL (20% SBE-β-CD in Saline)] 口服配方
口服配方 1: 悬浮于0.5% CMC Na (羧甲基纤维素钠) 口服配方 2: 悬浮于0.5% Carboxymethyl cellulose (羧甲基纤维素) 示例: 以口服配方 1 (悬浮于 0.5% CMC Na)为例说明, 如果要配制 100 mL 2.5 mg/mL 的工作液, 您可以先取0.5g CMC Na并将其溶解于100mL ddH2O中,得到0.5%CMC-Na澄清溶液;然后将250 mg待测化合物加到100 mL前述 0.5%CMC Na溶液中,得到悬浮液。 View More
口服配方 3: 溶解于 PEG400 (聚乙二醇400) 请根据您的实验动物和给药方式选择适当的溶解配方/方案: 1、请先配制澄清的储备液(如:用DMSO配置50 或 100 mg/mL母液(储备液)); 2、取适量母液,按从左到右的顺序依次添加助溶剂,澄清后再加入下一助溶剂。以 下列配方为例说明 (注意此配方只用于说明,并不一定代表此产品 的实际溶解配方): 10% DMSO → 40% PEG300 → 5% Tween-80 → 45% ddH2O (或 saline); 假设最终工作液的体积为 1 mL, 浓度为5 mg/mL: 取 100 μL 50 mg/mL 的澄清 DMSO 储备液加到 400 μL PEG300 中,混合均匀/澄清;向上述体系中加入50 μL Tween-80,混合均匀/澄清;然后继续加入450 μL ddH2O (或 saline)定容至 1 mL; 3、溶剂前显示的百分比是指该溶剂在最终溶液/工作液中的体积所占比例; 4、 如产品在配制过程中出现沉淀/析出,可通过加热(≤50℃)或超声的方式助溶; 5、为保证最佳实验结果,工作液请现配现用! 6、如不确定怎么将母液配置成体内动物实验的工作液,请查看说明书或联系我们; 7、 以上所有助溶剂都可在 Invivochem.cn网站购买。 |
| 制备储备液 | 1 mg | 5 mg | 10 mg | |
| 1 mM | 3.5624 mL | 17.8120 mL | 35.6240 mL | |
| 5 mM | 0.7125 mL | 3.5624 mL | 7.1248 mL | |
| 10 mM | 0.3562 mL | 1.7812 mL | 3.5624 mL |
1、根据实验需要选择合适的溶剂配制储备液 (母液):对于大多数产品,InvivoChem推荐用DMSO配置母液 (比如:5、10、20mM或者10、20、50 mg/mL浓度),个别水溶性高的产品可直接溶于水。产品在DMSO 、水或其他溶剂中的具体溶解度详见上”溶解度 (体外)”部分;
2、如果您找不到您想要的溶解度信息,或者很难将产品溶解在溶液中,请联系我们;
3、建议使用下列计算器进行相关计算(摩尔浓度计算器、稀释计算器、分子量计算器、重组计算器等);
4、母液配好之后,将其分装到常规用量,并储存在-20°C或-80°C,尽量减少反复冻融循环。
计算结果:
工作液浓度: mg/mL;
DMSO母液配制方法: mg 药物溶于 μL DMSO溶液(母液浓度 mg/mL)。如该浓度超过该批次药物DMSO溶解度,请首先与我们联系。
体内配方配制方法:取 μL DMSO母液,加入 μL PEG300,混匀澄清后加入μL Tween 80,混匀澄清后加入 μL ddH2O,混匀澄清。
(1) 请确保溶液澄清之后,再加入下一种溶剂 (助溶剂) 。可利用涡旋、超声或水浴加热等方法助溶;
(2) 一定要按顺序加入溶剂 (助溶剂) 。
|
|
|