| 规格 | 价格 | 库存 | 数量 |
|---|---|---|---|
| 1mg |
|
||
| 5mg |
|
||
| 10mg |
|
||
| 25mg |
|
||
| 50mg |
|
||
| Other Sizes |
|
| 靶点 |
Anti-fibrotic
|
|---|---|
| 体外研究 (In Vitro) |
本研究研究了GNS561/Ezurpimtrostat的抗病毒活性及其相关机制,这是一种晚期自噬的小溶酶体性分子抑制剂。有趣的是,根据考虑的病毒株,GNS561表现出6-40 nM的抗病毒活性,目前将其定位为SARS-CoV-2感染中研究的最强大的分子。结果表明,GNS561与SARS-CoV-2一起位于溶酶体相关膜蛋白2阳性(lamp2阳性)溶酶体中。此外,GNS561增加了LC3-II斑点的大小,引起自噬液泡的积累和多层小体的存在,提示GNS561破坏了自噬机制。[2]
GNS561对SARS-CoV-2复制具有较强的抗病毒活性[2] 为了评估GNS561的抗病毒活性,我们使用Vero E6细胞研究了SARS-CoV-2拷贝。首先,针对gns561对Vero E6细胞自噬的特异性影响,我们对LC3-II和p62蛋白水平进行了蛋白表达分析,LC3-II和p62蛋白是两种众所周知的自噬标志物。在不同浓度的药物作用24小时,以及在实验最后4小时添加巴菲霉素A1 (Baf A1)或不添加巴菲霉素A1(一种表征良好的晚期自噬抑制剂)时,评估自噬抑制作用。正常化的LC3-II蛋白表达呈剂量依赖性增加,当Baf A1以最高剂量添加时,LC3-II蛋白表达没有进一步增加(图1A),反映了细胞中自噬体的积累。在p62蛋白水平上进行了同样的观察,表明GNS561在Vero E6细胞系模型中阻滞了晚期的自噬通量。 |
| 体内研究 (In Vivo) |
研究发现,ezurpimtrostat联合抗程序性死亡-1 (anti-programmed death-1, PD-1)抑制PPT1可诱导淋巴细胞穿透肿瘤,从而降低小鼠肝癌模型的肝脏肿瘤负荷。抑制PPT1通过增加肝癌细胞表面主要组织相容性复合体(MHC)- 1的表达,增强抗pd -1免疫治疗的效果,并通过细胞毒性CD8+淋巴细胞的再定植和激活来调节免疫。
Ezurpimtrostat可以将冷肿瘤转化为热肿瘤,从而可以改善肝癌中T细胞介导的免疫疗法。[1]
研究人员使用了K18-hACE2小鼠模型,并强调GNS561治疗导致肺部SARS-CoV-2病毒粒子的下降,这与自噬途径的破坏有关。总体而言,本研究强调GNS561是治疗SARS-CoV-2感染的有效药物,并支持自噬阻滞剂可能是COVID-19替代策略的假设。[2] 在 DEN 肝脏肿块模型中,ezurpimtrostat 盐酸盐(化合物 2-3)(15 mg/kg/天,PO)持续 6 周可降低胶原纤维沉积水平(减少 41.0%)和肝纤维化面积 [3]。 |
| 酶活实验 |
体外抗病毒活性测定[2]
将Vero E6(25,000个细胞/孔)和Calu-3(12,000个细胞/孔)细胞系用175µL合适的培养基涂于96孔的组织培养板中,并让其粘附至少24小时,直到培养达到90%的融合。Vero E6和Calu-3细胞分别用25µL药物或对照物处理2 h,然后在0.1 MOI下感染SARS-CoV-2,分别孵育24 h或48 h。使用machery - nagel™NucleoSpin™ARN病毒试剂盒对细胞培养上清进行病毒提取。使用先前提取的病毒RNA操作的特定qRT-PCR来评估子代病毒的产量。简单地说,一步qRT-PCR的终体积为25 μL,其中含有10 μL提取的病毒RNA和15 μL的混合物,其中含有针对E基因的探针/引物混合物(表S1)和SuperScriptTM III PlatinumTM一步qRT-PCR试剂盒中的SuperScript主混合物。使用Cobas z 480 PCR系统进行定量PCR检测,并根据制造商的说明使用LightCycler 480 SW 1.5软件分析数据。放大后进行熔化曲线分析,以验证扩增子的准确性。子代病毒产量计算为考虑条件的E基因相对表达量归一化到感染和未处理条件。每个实验均为技术重复,并进行3个独立实验。 Vero E6和Vero E6- tmprss2细胞在含完整培养基的24孔板中镀24 h。在MOI为0.025的条件下,增加GNS561浓度或用载体感染细胞,并与SARS-CoV-2 (hCoV-19_IPL_France株)共孵育16 h。用磷酸盐缓冲盐水(PBS)冲洗细胞,并在非还原性Laemmli加载缓冲液中裂解。然后将蛋白质分离到10% sds -聚丙烯酰胺凝胶上,并转移到硝化纤维素膜上。用兔多克隆抗体(1:1000)和辣根过氧化物酶偶联二抗(1:10 000)检测SARS-CoV-2核衣壳(N)蛋白。采用化学发光法检测,ImageJ软件进行图像定量。实验一式两份进行。 |
| 细胞实验 |
体外细胞毒性试验[2]
根据制造商的说明,使用CellTiter- glo®发光细胞活力测定法或使用CellTiter 96®非放射性细胞增殖试剂盒评估细胞活力。简单地说,将Vero E6(25,000个细胞/孔)和Calu-3(12,000个细胞/孔)细胞系用175µL合适的培养基接种到96孔的组织培养板中。Vero E6和Calu-3细胞分别用25µL增加浓度的受试药物或适当的对照物处理2小时,然后以0.1感染倍数(MOI)感染50µL SARS-CoV-2菌株(IHUMI-6或USA-WA1/2020),分别孵育24和48小时。处理结束时,每孔加入CellTiter- glo溶液(IHUMI-6)或CellTiter 96®非放射性溶液(USA-WA1/2020)。细胞短暂振荡,然后在室温(RT)下孵育10分钟,使发光信号稳定,使用Infinite F200 Pro板读取器记录。细胞毒性以抑制细胞增殖50% (CC50)的化合物浓度表示,并使用Chou和Talalay方法计算。每项实验均为技术重复,并进行3次独立实验。 免疫荧光测定和分析[2] 为了进行细胞研究,在感染前一天,将Vero E6细胞(500,000个细胞/孔)培养在24孔板上,其中包含一个玻璃盖和700µL培养基。然后将细胞用100µL GNS561的荧光类似物GNS561G或载体处理2小时,然后用SARS-CoV-2菌株(IHUMI-6, MOI 0.1)感染48小时。 细胞和小鼠器官电镜成像[2] 感染前一天,在含有7 mL培养基的T75烧瓶中培养Vero E6细胞(210万个细胞),第二天达到90%的融合度。将培养的细胞用4µM GNS561或对照处理2小时,然后用SARS-CoV-2菌株(IHUMI-6, MOI 0.1)再感染24小时。 Western Blot Assay[2] 感染前一天,在含有7 mL培养基的T75烧瓶中培养Vero E6细胞(200万个细胞),第二天达到90%的融合度。培养的细胞用GNS561或载体对照处理2小时,然后用SARS-CoV-2菌株(IHUMI-6, MOI 0.1)感染24小时,在37℃、5% CO2和95%空气存在的加湿培养箱中孵育。 |
| 动物实验 |
The aim of this study was to determine the cellular and molecular activity of targeting PPT1 using ezurpimtrostat, in combination with an anti-PD-1 antibody.
Methods: In this study, a transgenic immunocompetent mouse model of hepatocellular carcinoma was used. [1]
Female K18-hACE C57BL/6J mice (strain: 2B6.Cg-Tg (K18-ACE2)2Prlmn/J, 8-9 weeks) were bred and housed in a ventilated cage system under SOPF requirements at the CIPHE animal facility with standard chow diets. Randomized mouse females were treated for 24 h with 50 mg/kg GNS561/ezurpimtrostat, 200 µL per os (i.e., oral gavage administration), or with vehicle for the control group, before intranasal infection with 1.1 × 105 plaque-forming units (PFUs) of the BetaCoV/France/IDF0372/2020 SARS-CoV-2 strain in a final volume of 30 μL, as illustrated in Figure S2. Twenty-four hours after treatment, virus inoculation was performed under anesthesia that was induced and maintained with ketamine hydrochloride and xylazine, and all efforts were made to minimize animal suffering. Mice were then treated daily with GNS561 compound or vehicle. Mice were humanely euthanized at 7 days post-infection, and lung tissues were harvested.[2] |
| 参考文献 |
[1]. Ezurpimtrostat, A Palmitoyl-Protein Thioesterase-1 Inhibitor, Combined with PD-1 Inhibition Provides CD8+ Lymphocyte Repopulation in Hepatocellular Carcinoma. Target Oncol . 2024 Jan;19(1):95-106.
[2]. GNS561 Exhibits Potent Antiviral Activity against SARS-CoV-2 through Autophagy Inhibition. Viruses . 2022 Jan 12;14(1):132. [3]. Substituted 2,4 diamino-quinoline as new medicament for fibrosis, autophagy and cathepsins b (ctsb), l (ctsl) and d (ctsd) related diseases. EP3620164A1. |
| 其他信息 |
Since December 2019, SARS-CoV-2 has spread quickly worldwide, leading to more than 280 million confirmed cases, including over 5,000,000 deaths. Interestingly, coronaviruses were found to subvert and hijack autophagic process to allow their viral replication. Autophagy-modulating compounds thus rapidly emerged as an attractive strategy to fight SARS-CoV-2 infection, including the well-known chloroquine (CQ). Here, we investigated the antiviral activity and associated mechanism of GNS561/Ezurpimtrostat, a small lysosomotropic molecule inhibitor of late-stage autophagy. Interestingly, GNS561 exhibited antiviral activity of 6-40 nM depending on the viral strain considered, currently positioning it as the most powerful molecule investigated in SARS-CoV-2 infection. We then showed that GNS561 was located in lysosome-associated-membrane-protein-2-positive (LAMP2-positive) lysosomes, together with SARS-CoV-2. Moreover, GNS561 increased LC3-II spot size and caused the accumulation of autophagic vacuoles and the presence of multilamellar bodies, suggesting that GNS561 disrupted the autophagy mechanism. To confirm our findings, we used the K18-hACE2 mouse model and highlighted that GNS561 treatment led to a decline in SARS-CoV-2 virions in the lungs associated with a disruption of the autophagy pathway. Overall, our study highlights GNS561 as a powerful drug in the treatment of SARS-CoV-2 infection and supports the hypothesis that autophagy blockers could be an alternative strategy for COVID-19.[2]
|
| 分子式 |
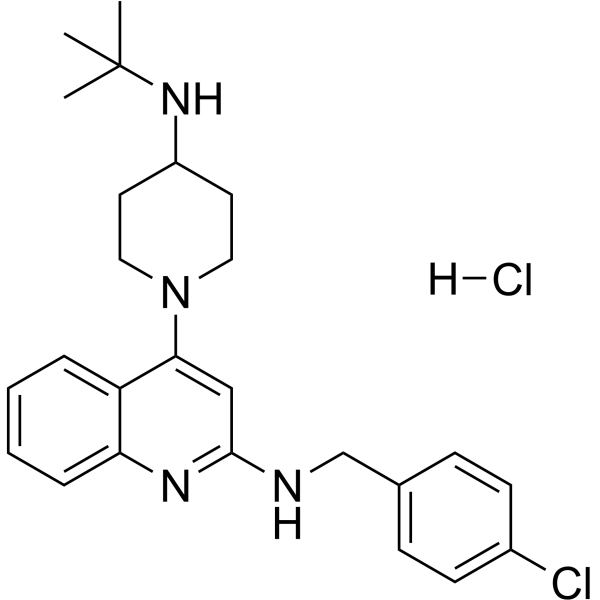
C25H32CL2N4
|
|---|---|
| 分子量 |
459.45
|
| 精确质量 |
458.2
|
| 元素分析 |
C, 65.35; H, 7.02; Cl, 15.43; N, 12.19
|
| CAS号 |
1914148-73-4
|
| 相关CAS号 |
Ezurpimtrostat;1914148-72-3
|
| PubChem CID |
121305179
|
| 外观&性状 |
Off-white to light yellow solid powder
|
| tPSA |
40.2
|
| 氢键供体(HBD)数目 |
3
|
| 氢键受体(HBA)数目 |
4
|
| 可旋转键数目(RBC) |
6
|
| 重原子数目 |
31
|
| 分子复杂度/Complexity |
520
|
| 定义原子立体中心数目 |
0
|
| InChi Key |
DLXMKLHCUTYCGO-UHFFFAOYSA-N
|
| InChi Code |
InChI=1S/C25H31ClN4.ClH/c1-25(2,3)29-20-12-14-30(15-13-20)23-16-24(28-22-7-5-4-6-21(22)23)27-17-18-8-10-19(26)11-9-18;/h4-11,16,20,29H,12-15,17H2,1-3H3,(H,27,28);1H
|
| 化学名 |
4-[4-(tert-butylamino)piperidin-1-yl]-N-[(4-chlorophenyl)methyl]quinolin-2-amine;hydrochloride
|
| 别名 |
Ezurpimtrostat hydrochloride; 1914148-73-4; Ezurpimtrostat (hydrochloride); 42P6K4PL76; UNII-42P6K4PL76; 2-((4-Chlorobenzyl)amino)-4-(4-tert-butylaminopiperidin-1-yl)quinoline hydrochloride; 2-Quinolinamine, N-((4-chlorophenyl)methyl)-4-(4-((1,1-dimethylethyl)amino)-1-piperidinyl)-, hydrochloride (1:1); GNS561 (hydrochloride); GNS-561
|
| HS Tariff Code |
2934.99.9001
|
| 存储方式 |
Powder -20°C 3 years 4°C 2 years In solvent -80°C 6 months -20°C 1 month |
| 运输条件 |
Room temperature (This product is stable at ambient temperature for a few days during ordinary shipping and time spent in Customs)
|
| 溶解度 (体外实验) |
DMSO : ~8.33 mg/mL (~18.13 mM)
|
|---|---|
| 溶解度 (体内实验) |
注意: 如下所列的是一些常用的体内动物实验溶解配方,主要用于溶解难溶或不溶于水的产品(水溶度<1 mg/mL)。 建议您先取少量样品进行尝试,如该配方可行,再根据实验需求增加样品量。
注射用配方
注射用配方1: DMSO : Tween 80: Saline = 10 : 5 : 85 (如: 100 μL DMSO → 50 μL Tween 80 → 850 μL Saline)(IP/IV/IM/SC等) *生理盐水/Saline的制备:将0.9g氯化钠/NaCl溶解在100 mL ddH ₂ O中,得到澄清溶液。 注射用配方 2: DMSO : PEG300 :Tween 80 : Saline = 10 : 40 : 5 : 45 (如: 100 μL DMSO → 400 μL PEG300 → 50 μL Tween 80 → 450 μL Saline) 注射用配方 3: DMSO : Corn oil = 10 : 90 (如: 100 μL DMSO → 900 μL Corn oil) 示例: 以注射用配方 3 (DMSO : Corn oil = 10 : 90) 为例说明, 如果要配制 1 mL 2.5 mg/mL的工作液, 您可以取 100 μL 25 mg/mL 澄清的 DMSO 储备液,加到 900 μL Corn oil/玉米油中, 混合均匀。 View More
注射用配方 4: DMSO : 20% SBE-β-CD in Saline = 10 : 90 [如:100 μL DMSO → 900 μL (20% SBE-β-CD in Saline)] 口服配方
口服配方 1: 悬浮于0.5% CMC Na (羧甲基纤维素钠) 口服配方 2: 悬浮于0.5% Carboxymethyl cellulose (羧甲基纤维素) 示例: 以口服配方 1 (悬浮于 0.5% CMC Na)为例说明, 如果要配制 100 mL 2.5 mg/mL 的工作液, 您可以先取0.5g CMC Na并将其溶解于100mL ddH2O中,得到0.5%CMC-Na澄清溶液;然后将250 mg待测化合物加到100 mL前述 0.5%CMC Na溶液中,得到悬浮液。 View More
口服配方 3: 溶解于 PEG400 (聚乙二醇400) 请根据您的实验动物和给药方式选择适当的溶解配方/方案: 1、请先配制澄清的储备液(如:用DMSO配置50 或 100 mg/mL母液(储备液)); 2、取适量母液,按从左到右的顺序依次添加助溶剂,澄清后再加入下一助溶剂。以 下列配方为例说明 (注意此配方只用于说明,并不一定代表此产品 的实际溶解配方): 10% DMSO → 40% PEG300 → 5% Tween-80 → 45% ddH2O (或 saline); 假设最终工作液的体积为 1 mL, 浓度为5 mg/mL: 取 100 μL 50 mg/mL 的澄清 DMSO 储备液加到 400 μL PEG300 中,混合均匀/澄清;向上述体系中加入50 μL Tween-80,混合均匀/澄清;然后继续加入450 μL ddH2O (或 saline)定容至 1 mL; 3、溶剂前显示的百分比是指该溶剂在最终溶液/工作液中的体积所占比例; 4、 如产品在配制过程中出现沉淀/析出,可通过加热(≤50℃)或超声的方式助溶; 5、为保证最佳实验结果,工作液请现配现用! 6、如不确定怎么将母液配置成体内动物实验的工作液,请查看说明书或联系我们; 7、 以上所有助溶剂都可在 Invivochem.cn网站购买。 |
| 制备储备液 | 1 mg | 5 mg | 10 mg | |
| 1 mM | 2.1765 mL | 10.8826 mL | 21.7652 mL | |
| 5 mM | 0.4353 mL | 2.1765 mL | 4.3530 mL | |
| 10 mM | 0.2177 mL | 1.0883 mL | 2.1765 mL |
1、根据实验需要选择合适的溶剂配制储备液 (母液):对于大多数产品,InvivoChem推荐用DMSO配置母液 (比如:5、10、20mM或者10、20、50 mg/mL浓度),个别水溶性高的产品可直接溶于水。产品在DMSO 、水或其他溶剂中的具体溶解度详见上”溶解度 (体外)”部分;
2、如果您找不到您想要的溶解度信息,或者很难将产品溶解在溶液中,请联系我们;
3、建议使用下列计算器进行相关计算(摩尔浓度计算器、稀释计算器、分子量计算器、重组计算器等);
4、母液配好之后,将其分装到常规用量,并储存在-20°C或-80°C,尽量减少反复冻融循环。
计算结果:
工作液浓度: mg/mL;
DMSO母液配制方法: mg 药物溶于 μL DMSO溶液(母液浓度 mg/mL)。如该浓度超过该批次药物DMSO溶解度,请首先与我们联系。
体内配方配制方法:取 μL DMSO母液,加入 μL PEG300,混匀澄清后加入μL Tween 80,混匀澄清后加入 μL ddH2O,混匀澄清。
(1) 请确保溶液澄清之后,再加入下一种溶剂 (助溶剂) 。可利用涡旋、超声或水浴加热等方法助溶;
(2) 一定要按顺序加入溶剂 (助溶剂) 。