| 规格 | 价格 | 库存 | 数量 |
|---|---|---|---|
| 5mg |
|
||
| 10mg |
|
||
| Other Sizes |
|

| 靶点 |
mGlu4 (EC50 = 0.13 μM); mGlu8 (EC50 = 0.29 μM); mGlu6 (EC50 = 1.0 μM); mGlu7 (EC50 = 249 μM)
|
|---|---|
| 体外研究 (In Vitro) |
通过虚拟HTS鉴定了一种III组代谢型谷氨酸(mGlu)受体激动剂(PCEP)。这种正构配体由一个模拟谷氨酸的L-AP4衍生片段和一个结合到相邻口袋的链组成,为提高亲和力和选择性提供了可能性[1]。
|
| 体内研究 (In Vivo) |
在 8 只神经结扎大鼠中,L-AP4(5-30 μg,鞘内感染 4-5 天)呈剂量依赖性,并显着提高了冯弗雷丝给药后的缩爪阈值。鞘内注射不同剂量的 L-AP4 似乎不会引起任何明显的运动功能障碍[2]。这些正常大鼠的缩爪潜伏期并未受到鞘内注射 30 μg L-AP4 的显着影响[2]。通过向脊髓局部注射 5 至 50 μML-AP4,以浓度依赖性方式显着抑制神经元对触摸、压力、捏捏和 von Frey 丝的诱发反应 [2]。
脊髓背角神经元谷氨酸能输入的增加是神经性疼痛的重要机制。然而,III组代谢型谷氨酸受体(mGluRs)在正常和神经性疼痛条件下对伤害感受和背角神经元的调节作用尚不完全清楚。在这项研究中,我们确定了III组mGluR特异性激动剂L(+)-2-氨基-4-膦酰基丁酸(L-AP4)对正常大鼠和神经性疼痛大鼠模型的伤害感受和背角投射神经元的影响。通过结扎大鼠L5/L6左脊神经诱导触觉异常性疼痛。通过von Frey细丝测定神经损伤大鼠的异常性疼痛。使用辐射热和Randall-Selitto压力装置在正常大鼠身上测试了伤害感受阈值。在麻醉的大鼠中,从腰椎脊髓记录上升背角神经元的单个单位活动。鞘内注射(5-30微克)L-AP4剂量依赖性地减轻了神经损伤大鼠的异常性疼痛,但对正常大鼠没有镇痛作用。局部脊髓应用5至50微ML-AP4也显著抑制了神经结扎但非正常大鼠升背角神经元的诱发反应。此外,阻断脊髓III组mGluRs显著降低了正常但未受神经损伤的大鼠的戒断阈值,并增加了背角神经元的诱发反应。这些数据表明,III组mGluRs在正常和神经性疼痛状态下对伤害感受和背角神经元的调节中起着不同的作用。脊髓III组mGluRs的激活抑制了异常性疼痛,并抑制了与神经性疼痛相关的背角投射神经元的超敏反应[2]。 |
| 酶活实验 |
重组mGlu受体的药理学分析[1]
如别处所述,通过电穿孔将代谢性谷氨酸受体瞬时转染到HEK293细胞中,并将其铺在96孔微孔板中。高亲和力谷氨酸转运体EAAT3与受体共转染,以避免分析培养基中细胞释放的谷氨酸的任何影响。在我们的实验中,III组mGlu受体与嵌合G蛋白共转染,该嵌合G蛋白将受体的激活与磷脂酶C(PLC)途径偶联。因此,受体激活诱导磷酸肌醇(IP)的产生,进而诱导细胞内Ca2+的释放。然后通过测量IP产生或Ca2+释放来确定受体活性,如前所述。我们之前报道过,这些测定比经典的毛喉素激活的腺苷酸环化酶活性抑制测量更容易处理,结果也更准确,而且这些受体的药理学没有改变。事实上,近年来,我们和其他人获得的证据表明,这些受体的药理学特征在这些检测中得到了很好的保护。 为了测定磷酸肌醇的产量,将表达mGlu受体的细胞接种在96孔微孔板中,并在培养基中与3H-肌醇(23.4Ci/mol)一起孵育过夜。第二天,用激动剂刺激细胞30分钟,最后更换培养基,用冷的0.1M甲酸孵育细胞1小时,诱导细胞裂解。使用Dowex树脂通过离子交换色谱法回收受体刺激后产生的3H-IP。洗脱后,使用Wallac 1450微菌落计数和发光计数器对放射性进行计数。膜中剩余的放射性用于使产生的IP标准化。结果表示为IP与IP加膜对应的总放射性之间的比值。所有数据点代表三个副本。 对于细胞内钙测量,表达mGlu受体的细胞在37°C下用溶解在含2.5mM丙磺舒的Hanks平衡盐溶液中的Ca2+敏感荧光染料Fluo-4AM加载1小时,然后洗涤并与含丙磺舒(probenecid)的HBSS一起孵育。用不同浓度的待测激动剂制备药物板,并在记录20秒后将药物溶液加入每个孔中。使用荧光微孔板读数器Flexstation III以1.5秒的采样间隔测量荧光信号(激发485 nm,发射525 nm),持续60秒。所有数据点代表三份。 使用GraphPad Prism程序和以下方程拟合剂量-反应曲线:y=[(ymax-ymin)/(1+(x/EC50)n)]+ymin,其中EC50是获得半最大效应所需的化合物浓度,n是希尔系数。 重组NMDA受体的药理学分析[1] 在共注射30nL编码大鼠GluN1-a和大鼠GluN2A或小鼠GluN2B亚基(比例1:1)的cDNA混合物(10-30ng/μL;核注射)后,非洲爪蟾卵母细胞中表达了重组NMDA受体。如前所述,制备、注射、电压钳位和超滤卵母细胞。使用pClamp 9.2收集和分析数据。它们是用Sigmaplot 8.0安装的。用于pH 7.3记录的标准外溶液含有(单位:mM):100 NaCl、0.3 BaCl2、5 HEPES、2.5 KOH。用HCl将pH调节至7.3。然后将10μM DTPA添加到所有溶液中,以螯合污染的锌,锌是GluN1/GluN2A NMDA受体的一种非常有效的变构抑制剂。通过同时施加l-谷氨酸和甘氨酸诱导NMDA电流,并在-60 mV的保持电位和室温下记录。在施加饱和浓度的甘氨酸(100μM)和接近其EC50(5μM)的谷氨酸浓度的过程中,通过添加不同量的化合物来测量它们对17m的抑制作用。通过在激动剂溶液中稀释50mM的化合物水储备溶液,并加入1当量的NaOH,得到17m的不同浓度溶液。抑制剂量-反应曲线用以下Hill方程拟合:I17m/I0=1-1/(1+(IC50/[17m])nH),其中I17m/I0是相对电流,IC50是产生50%最大增强的17m浓度,nH是Hill系数。 |
| 细胞实验 |
小脑切片制剂[1]
老鼠被击晕,然后被斩首。用振动钳Microm HM 650从18-29日龄大鼠的蚓部制备冠状和矢状小脑切片(250μm厚)。切片在冰冷(3°C)的蔗糖基溶液中制备,该溶液饱和95%O2–5%CO2,含有(mM):蔗糖230、KCl 2.5、KH2PO4 1.25、MgCl2 8、葡萄糖25、NaHCO3 26、CaCl2 0.8(渗透压330 mOsm l–1)。切片在室温下保持至少1小时,然后在用95%O2-5%CO2充气的盐水溶液中记录。该溶液含有(以mM计):NaCl,124;氯化钾,3;碳酸氢钠24;KH2PO4,1.15;硫酸镁1.15;氯化钙2;葡萄糖,10;渗透压为330 mOsm l–1,pH值为7.35,温度为25°C。记录室以每分钟2毫升的速度用这种相同的含氧生理盐水溶液进行灌注,并补充GABAA受体拮抗剂甲基碘荷包牡丹碱(10μM)。 电生理学[1] 用Axopatch-1D放大器在矢状切片中对浦肯野细胞(PC)进行全细胞膜片钳记录。通过立式显微镜的×60水浸物镜,用Nomarski光学系统直接观察PC体细胞。所有记录均在28-30°C下进行。贴片移液管(3.5–5 MΩ,硼硅酸盐玻璃)填充有以下成分(mM)的内溶液:KGlu,140;氯化钾,6;HEPES,10岁;EGTA为0.75;氯化镁,1,钠GTP,0.4;Na2-ATP,4;pH 7.3,KOH溶液;300毫渗摩尔-1。PC被钳制在-70 mV,每6秒通过放置在分子层下半部分切片表面的玻璃盐水填充单极电极刺激一次平行纤维(PF),以引发PF诱发的兴奋性突触后电流(EPSCs)。以40ms的间质间隔对细胞施加相同强度的成对刺激,诱发PF-EPSC。在线计算成对脉冲促进(PPF),即第二个PF-EPSC的振幅与第一个PF-EPSC的振幅之比。平均PPF值是通过对每个细胞的单个迹线中的PPF进行平均而获得的。在保存用于分析的细胞中,根据Llano等人描述的程序,通路电阻(通常为5-10MΩ)得到了部分补偿(50-70%)。在整个实验过程中,PF EPSCs在10mV的超极化电压步长下被诱发,这允许监测被动膜特性。使用Acquis1软件在线和离线分析PF-EPSC。 钙敏感荧光测量[1] 如前所述,使用冠状切片,通过局部应用含有低亲和力钙敏感染料Fluo-4FF-AM(100μM)的盐水溶液加载PF束。加载后至少45分钟,以单一激发波长(485±22nm)照射标记PFs的受限区域。用机电快门对从100W汞灯获得的激发光进行门控。通过放置在加载位点和记录位点之间的分子层中的盐水填充玻璃电极,每分钟用一个100 Hz的五个电刺激序列刺激位于记录窗口中的PF。在分子层上方的20μm×50μm窗口中记录了标记PFs引发的荧光瞬变,该窗口距离加载位点约500-800μm,PC层上方100μm,通过立式显微镜的×60水浸物镜收集,用530±30nm的屏障滤光片过滤,并用光度计转换为电信号。针对染料漂白校正的荧光信号表示为相对荧光变化ΔF/F,其中F是基线荧光强度,ΔF是PF刺激引起的变化。当切片未标记区域组织的背景荧光大于指示剂基础荧光强度的5%时,对数据进行背景荧光校正。所有实验均在28-30°C下进行。使用Acquis1软件在线和离线分析荧光测量值。 |
| 动物实验 |
Animal/Disease Models: Rats.[2]
Doses: 5-30 μg. Route of Administration: Intrathecal inhection 4-5 days. Experimental Results: Dose-dependently increased paw withdrawal threshold. |
| 参考文献 |
|
| 其他信息 |
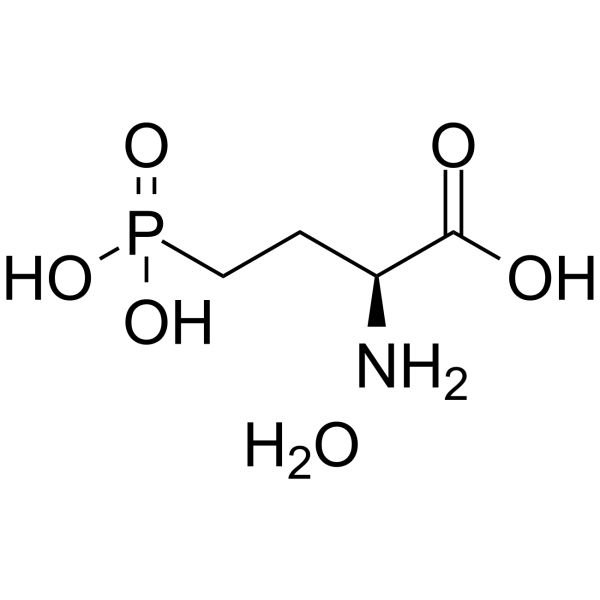
(2S)-2-amino-4-phosphonobutanoic acid is a non-proteinogenc L-alpha-amino acid that is L-alpha-aminobutyric acid in which one of the hydrogens of the terminal methyl group has been replaced by a dihydroxy(oxido)-lambda(5)-phosphanyl group. It is a potent and selective agonist for the group III metabotropic glutamate receptors (mGluR4/6/7/8). It has a role as a metabotropic glutamate receptor agonist. It is a non-proteinogenic L-alpha-amino acid and a member of phosphonic acids.
A group III metabotropic glutamate (mGlu) receptor agonist (PCEP) was identified by virtual HTS. This orthosteric ligand is composed by an l-AP4-derived fragment that mimics glutamate and a chain that binds into a neighboring pocket, offering possibilities to improve affinity and selectivity. Herein we describe a series of derivatives where the distal chain is replaced by an aromatic or heteroaromatic group. Potent agonists were identified, including some with a mGlu4 subtype preference, e.g., 17m (LSP1-2111) and 16g (LSP4-2022). Molecular modeling suggests that aromatic functional groups may bind at either one of the two chloride regulatory sites. These agonists may thus be considered as particular bitopic/dualsteric ligands. 17m was shown to reduce GABAergic synaptic transmission at striatopallidal synapses. We now demonstrate its inhibitory effect at glutamatergic parallel fiber-Purkinje cell synapses in the cerebellar cortex. Although these ligands have physicochemical properties that are markedly different from typical CNS drugs, they hold significant therapeutic potential.[1] |
| 分子式 |
C4H12NO6P
|
|---|---|
| 分子量 |
201.11
|
| 精确质量 |
201.04
|
| CAS号 |
2247534-79-6
|
| 相关CAS号 |
D-AP4;78739-01-2;L-AP4;23052-81-5
|
| PubChem CID |
146401139
|
| 外观&性状 |
White to off-white solid powder
|
| tPSA |
122
|
| 氢键供体(HBD)数目 |
5
|
| 氢键受体(HBA)数目 |
7
|
| 可旋转键数目(RBC) |
4
|
| 重原子数目 |
12
|
| 分子复杂度/Complexity |
187
|
| 定义原子立体中心数目 |
1
|
| SMILES |
P(O)(O)(=O)CC[C@H](N)C(=O)O.O
|
| InChi Key |
ZAXJAZYNVPZMRL-DFWYDOINSA-N
|
| InChi Code |
InChI=1S/C4H10NO5P.H2O/c5-3(4(6)7)1-2-11(8,9)10;/h3H,1-2,5H2,(H,6,7)(H2,8,9,10);1H2/t3-;/m0./s1
|
| 化学名 |
(2S)-2-amino-4-phosphonobutanoic acid;hydrate
|
| 别名 |
L-AP4 monohydrate; L-AP4 (monohydrate); 2247534-79-6; (2S)-2-amino-4-phosphonobutanoic acid;hydrate; SCHEMBL21747432;
|
| HS Tariff Code |
2934.99.9001
|
| 存储方式 |
Powder -20°C 3 years 4°C 2 years In solvent -80°C 6 months -20°C 1 month 注意: 请将本产品存放在密封且受保护的环境中(例如氮气保护),避免吸湿/受潮和光照。 |
| 运输条件 |
Room temperature (This product is stable at ambient temperature for a few days during ordinary shipping and time spent in Customs)
|
| 溶解度 (体外实验) |
May dissolve in DMSO (in most cases), if not, try other solvents such as H2O, Ethanol, or DMF with a minute amount of products to avoid loss of samples
|
|---|---|
| 溶解度 (体内实验) |
注意: 如下所列的是一些常用的体内动物实验溶解配方,主要用于溶解难溶或不溶于水的产品(水溶度<1 mg/mL)。 建议您先取少量样品进行尝试,如该配方可行,再根据实验需求增加样品量。
注射用配方
注射用配方1: DMSO : Tween 80: Saline = 10 : 5 : 85 (如: 100 μL DMSO → 50 μL Tween 80 → 850 μL Saline)(IP/IV/IM/SC等) *生理盐水/Saline的制备:将0.9g氯化钠/NaCl溶解在100 mL ddH ₂ O中,得到澄清溶液。 注射用配方 2: DMSO : PEG300 :Tween 80 : Saline = 10 : 40 : 5 : 45 (如: 100 μL DMSO → 400 μL PEG300 → 50 μL Tween 80 → 450 μL Saline) 注射用配方 3: DMSO : Corn oil = 10 : 90 (如: 100 μL DMSO → 900 μL Corn oil) 示例: 以注射用配方 3 (DMSO : Corn oil = 10 : 90) 为例说明, 如果要配制 1 mL 2.5 mg/mL的工作液, 您可以取 100 μL 25 mg/mL 澄清的 DMSO 储备液,加到 900 μL Corn oil/玉米油中, 混合均匀。 View More
注射用配方 4: DMSO : 20% SBE-β-CD in Saline = 10 : 90 [如:100 μL DMSO → 900 μL (20% SBE-β-CD in Saline)] 口服配方
口服配方 1: 悬浮于0.5% CMC Na (羧甲基纤维素钠) 口服配方 2: 悬浮于0.5% Carboxymethyl cellulose (羧甲基纤维素) 示例: 以口服配方 1 (悬浮于 0.5% CMC Na)为例说明, 如果要配制 100 mL 2.5 mg/mL 的工作液, 您可以先取0.5g CMC Na并将其溶解于100mL ddH2O中,得到0.5%CMC-Na澄清溶液;然后将250 mg待测化合物加到100 mL前述 0.5%CMC Na溶液中,得到悬浮液。 View More
口服配方 3: 溶解于 PEG400 (聚乙二醇400) 请根据您的实验动物和给药方式选择适当的溶解配方/方案: 1、请先配制澄清的储备液(如:用DMSO配置50 或 100 mg/mL母液(储备液)); 2、取适量母液,按从左到右的顺序依次添加助溶剂,澄清后再加入下一助溶剂。以 下列配方为例说明 (注意此配方只用于说明,并不一定代表此产品 的实际溶解配方): 10% DMSO → 40% PEG300 → 5% Tween-80 → 45% ddH2O (或 saline); 假设最终工作液的体积为 1 mL, 浓度为5 mg/mL: 取 100 μL 50 mg/mL 的澄清 DMSO 储备液加到 400 μL PEG300 中,混合均匀/澄清;向上述体系中加入50 μL Tween-80,混合均匀/澄清;然后继续加入450 μL ddH2O (或 saline)定容至 1 mL; 3、溶剂前显示的百分比是指该溶剂在最终溶液/工作液中的体积所占比例; 4、 如产品在配制过程中出现沉淀/析出,可通过加热(≤50℃)或超声的方式助溶; 5、为保证最佳实验结果,工作液请现配现用! 6、如不确定怎么将母液配置成体内动物实验的工作液,请查看说明书或联系我们; 7、 以上所有助溶剂都可在 Invivochem.cn网站购买。 |
| 制备储备液 | 1 mg | 5 mg | 10 mg | |
| 1 mM | 4.9724 mL | 24.8620 mL | 49.7240 mL | |
| 5 mM | 0.9945 mL | 4.9724 mL | 9.9448 mL | |
| 10 mM | 0.4972 mL | 2.4862 mL | 4.9724 mL |
1、根据实验需要选择合适的溶剂配制储备液 (母液):对于大多数产品,InvivoChem推荐用DMSO配置母液 (比如:5、10、20mM或者10、20、50 mg/mL浓度),个别水溶性高的产品可直接溶于水。产品在DMSO 、水或其他溶剂中的具体溶解度详见上”溶解度 (体外)”部分;
2、如果您找不到您想要的溶解度信息,或者很难将产品溶解在溶液中,请联系我们;
3、建议使用下列计算器进行相关计算(摩尔浓度计算器、稀释计算器、分子量计算器、重组计算器等);
4、母液配好之后,将其分装到常规用量,并储存在-20°C或-80°C,尽量减少反复冻融循环。
计算结果:
工作液浓度: mg/mL;
DMSO母液配制方法: mg 药物溶于 μL DMSO溶液(母液浓度 mg/mL)。如该浓度超过该批次药物DMSO溶解度,请首先与我们联系。
体内配方配制方法:取 μL DMSO母液,加入 μL PEG300,混匀澄清后加入μL Tween 80,混匀澄清后加入 μL ddH2O,混匀澄清。
(1) 请确保溶液澄清之后,再加入下一种溶剂 (助溶剂) 。可利用涡旋、超声或水浴加热等方法助溶;
(2) 一定要按顺序加入溶剂 (助溶剂) 。