| 规格 | 价格 | 库存 | 数量 |
|---|---|---|---|
| 5mg |
|
||
| 10mg |
|
||
| 25mg |
|
||
| 50mg |
|
||
| 100mg |
|
||
| 250mg |
|
||
| 500mg |
|
||
| Other Sizes |
|
| 靶点 |
Mps1 (IC50 = 1.8 nM); ALK (IC50 = 0.26 μM); B-RAF (IC50 = 3.2 μM); ERK2 (IC50 = 3.9 μM); FAK1 (IC50 = 2.7 μM); FER (IC50 = 0.59 μM); FLT3 (IC50 = 0.08 μM); INSR (IC50 = 0.38 μM); JNK1 (IC50 = 0.11 μM); PLK4 (IC50 = 3.3 μM); STK33 (IC50 = 1.1 μM )
|
||
|---|---|---|---|
| 体外研究 (In Vitro) |
MPI-0479605的 IC50 为 1.8 nM,是一种强效且特异性的 Mps1 ATP 竞争性抑制剂。 MPI-0479605 (0.1–10 μM) 会剂量依赖性地降低 HCT-116 细胞活力。在引起完全胞质分裂的同时,MPI-0479605 在中期板的染色体排列中表现出严重缺陷[1]。
MPI-0479605是Mps1激酶的强效选择性抑制剂[1] MPI-0479605是一种强效的ATP竞争性Mps1抑制剂,通过化合物筛选和随后的药物化学优化鉴定。它以1.8 nmol/L的IC50值抑制Mps1(图1A),并且在针对120种其他激酶进行测试时对Mps1具有高度选择性(补充表S1)。MPI-0479605在结构上与最近发表的MPS1抑制剂reversine和MPS1-IN-1相似,但与reversine的不同之处在于它缺乏对极光激酶的活性。[1] MPI-0479605抑制了细胞中Mps1的功能,这表现在能够覆盖微管失稳药物诺考达唑诱导的SAC。在诺考达唑阻滞的细胞中,MPI-0479605触发了细胞周期蛋白B和securin的时间依赖性降解,这通常允许有丝分裂退出,以及BubR1磷酸化的减少(图1B)。因此,细胞退出有丝分裂,未能进行胞质分裂,这可以从DNA含量超过4N的细胞百分比的增加中得到证明(图1C)。此外,有丝分裂细胞的标志物磷酸组蛋白-H3(pHH3)染色阳性的细胞百分比在MPI-0479605治疗后呈剂量依赖性下降(补充图S2)。与细胞内Mps1的抑制一致,MPI-0479605阻断了过表达Mps1的HEK293T细胞中Mps1在苏氨酸676处的明显自磷酸化(图1D)。 Mps1抑制对有丝分裂和细胞周期进程的影响[1] 通过在有丝分裂过程中对A549细胞进行成像,检查了MPI-0479605对染色体分离的影响。用MPI-0479605处理的细胞在中期板上排列染色体的能力方面表现出严重缺陷。用MPI-0479605处理的细胞中有很大一部分进入后期,至少有一条染色体未对齐,这从后期滞后染色体的存在中可以看出(图2A)。在完成有丝分裂并重新进入间期后,用MPI-0479605或相关化合物MPI-0485812(结构见补充图S3)处理的细胞含有着丝粒染色阳性的微核,但不含γH2AX(图2B和数据未显示),这与这些微核中存在整条染色体而非DNA片段一致。在一些细胞中,我们观察到存在多个细胞核,但这不是主要的表型。 尽管染色体分离存在缺陷,但大多数经MPI-0479605处理的细胞能够完成胞质分裂,这表明没有大量四倍体细胞(8N DNA含量的细胞)。相反,在大多数细胞中,DNA含量与2N和4N峰的差异表明,染色体似乎有所增加或减少(图3A)。有趣的是,在化合物暴露的72小时内,富含p53的HCT-116细胞的凋亡亚G1细胞群仅略有增加,而p53缺陷的Colo-205细胞在这一群体中表现出强烈的增加。这表明,具有野生型p53的细胞可能部分免于凋亡。为了更好地了解细胞是否在积极分裂,细胞在G1晚期同步,并用CSFE处理,CSFE标记细胞内蛋白质。细胞分裂后,荧光强度降低,从而可以监测细胞分裂。标记的细胞从G1区释放到含有DMSO或MPI-0479605的培养基中,并测定72小时内发生的细胞分裂次数。用MPI-0479605处理的细胞能够以类似于DMSO处理的细胞的方式完成一次细胞分裂,但此后,MPI-0479905处理的细胞显示出细胞周期进程的显著延迟和/或停滞(图3B)。通过掺入BrdUrd监测DNA合成。在暴露于MPI-0479605 48小时后,BrdUrd掺入受到极大抑制,表明大多数细胞没有在S期积极循环(图3C)。这发生在p53野生型和p53缺陷型细胞中,表明这种作用不依赖于功能性p53的存在。我们得出结论,抑制Mps1可以消除SAC,并在染色体错接的情况下允许后期进展,导致染色体分离缺陷和非整倍性。随后,细胞周期进程被延缓,可能是由于有丝分裂后检查点的激活或有丝分裂突变的开始。[1] 最近的研究表明,纺锤体检查点的失活会诱导非整倍性,随后激活p53反应和生长停滞和/或凋亡。为了确定MPI-0479605诱导的非整倍体是否会促进类似的反应,我们检查了p53信号通路。在富含p53的细胞中,MPI-0479605以时间依赖的方式诱导p53的表达,最高水平出现在48小时,这一时间框架与观察到的DNA合成抑制一致(图4A)。p21蛋白和mRNA的诱导也以时间和剂量依赖的方式发生,表明p53具有转录活性(图4A和B)。先前的研究表明,Mps1在有丝分裂后检查点对微管失稳的反应中磷酸化苏氨酸18上的p53。令人惊讶的是,在没有微管靶向药物的情况下抑制内源性Mps1会诱导p53在丝氨酸15而不是苏氨酸18上的磷酸化(图4C和数据未显示)。如果细胞用CGK733预处理,丝氨酸15的磷酸化会被阻止,CGK733是DNA损伤激酶ATR和共济失调毛细血管扩张症突变的双重抑制剂(ATM;参考文献18),但用ATM特异性抑制剂KU-55933预处理则不会,这表明ATR是相关的激酶。(图4C和数据未显示)。由于ATR通常在DNA损伤时被激活,因此研究了组蛋白H2AX的磷酸化,组蛋白H2AX是DNA损伤的标志物,也是ATR的直接底物。在用MPI-0479605处理48小时后,约15%的细胞显示出γH2AX的弥漫性核染色,但没有显示出对DNA损伤的典型局灶性染色(数据未显示)。通过蛋白质印迹,检测到γH2AX的增加,最大信号出现在36小时(图4A)。CGK733抑制了H2AX对MPI-0479605的磷酸化反应,但KU-55933没有(图4C和数据未显示)。因此,已知的ATR底物p53和H2AX在MPI-0479605治疗后都发生了磷酸化。 抑制Mps1诱导时间依赖性细胞死亡[1] 用MPI-0479605处理HCT-116细胞后,48小时和72小时的细胞存活率显著降低(图5A)。同时,诱导了caspase-3/7的活性,诱导水平在48小时时最高(图5B)。在p53野生型和突变型细胞中均观察到半胱天冬酶诱导,但用泛半胱天冬蛋白酶抑制剂z-VAD-fmk预处理细胞不影响MPI-0479605介导的细胞死亡(补充图S4)。为了探索细胞死亡的承诺,细胞暴露于Mps1抑制剂24小时,然后在无化合物培养基中再孵育9天。在较低剂量的抑制剂下,细胞杀伤不完全,细胞生长恢复,而在较高剂量下,细胞杀灭基本完成(图5C和D)。对一组肿瘤细胞系进行72小时的治疗后,发现许多细胞系的敏感性极低。相比之下,治疗7天导致所有受试细胞系的细胞毒性,大多数细胞系的半最大生长抑制(GI50)值在30至100 nmol/L之间(补充表S2)。细胞死亡的延长时间过程可能反映了积累致命水平的染色体分离错误所需的时间,也可能反映了Mps1抑制时表现出的延迟细胞周期动力学。 |
||
| 体内研究 (In Vivo) |
在 HCT-116 异种移植物中,MPI-0479605(每天 30 mg/kg 或每四天 150 mg/kg (Q4D),腹腔注射)可抑制肿瘤发展 49% 和 74%。对于 Colo-205 异种移植物,每天给药时 MPI-0479605 不会表现出抑制作用;相比之下,每四天给药一次可抑制 63% 的肿瘤生长 (TGI)[1]。
MPI-0479605在结肠癌癌症异种移植物模型中显示抗肿瘤活性[1] 为了确定Mps 1抑制对肿瘤生长的影响,我们用MPI-0479605治疗皮下HCT-116或Colo-205人肿瘤细胞异种移植物的小鼠。根据药代动力学分析(补充图S5)和最大耐受剂量研究,小鼠每天服用30mg/kg或每4天服用150mg/kg的MPI-0479605。对于HCT-116异种移植物,与赋形剂治疗的小鼠相比,每天以30mg/kg的剂量给药可产生49%的TGI(P=0.1),而每4天以150mg/kg的剂量服用可产生74%的TGI,P=0.005(图6A)。对于Colo-205异种移植物,每日给药没有显示出抗肿瘤活性,而每4天给药导致63%的TGI(P=0.07;补充图S6)。这些动物研究为Mps1作为癌症靶点提供了验证,但表明使用这些给药方案存在相关毒性(体重减轻和死亡)。毒性的具体原因尚不清楚;然而,用单剂量MPI-0479605治疗的小鼠在第5天表现出明显的中性粒细胞减少症(图6B)。这表明MPI-0479605的作用不仅限于肿瘤细胞。 |
||
| 细胞实验 |
细胞周期分析[1]
为了测量DNA含量,用7-氨基放线菌素(7-AAD)对固定的、透性的细胞进行染色。为了监测细胞分裂,G1同步细胞用羧基荧光素二乙酸酯琥珀酰亚胺酯(CSFE)标记,并从停滞状态释放到含有二甲亚砜(DMSO)或MPI-0479605 的培养基中。固定细胞并通过流式细胞术进行分析。为了测量溴脱氧尿苷(BrdUrd)的掺入,根据制造商的方案,用BrdUr德标记细胞,并用BrdU Flow Kit染色。 |
||
| 动物实验 |
|
||
| 参考文献 | |||
| 其他信息 |
Mps1 is a dual specificity protein kinase that is essential for the bipolar attachment of chromosomes to the mitotic spindle and for maintaining the spindle assembly checkpoint until all chromosomes are properly attached. Mps1 is expressed at high levels during mitosis and is abundantly expressed in cancer cells. Disruption of Mps1 function induces aneuploidy and cell death. We report the identification of MPI-0479605 , a potent and selective ATP competitive inhibitor of Mps1. Cells treated with MPI-0479605 undergo aberrant mitosis, resulting in aneuploidy and formation of micronuclei. In cells with wild-type p53, this promotes the induction of a postmitotic checkpoint characterized by the ATM- and RAD3-related-dependent activation of the p53-p21 pathway. In both wild-type and p53 mutant cells lines, there is a growth arrest and inhibition of DNA synthesis. Subsequently, cells undergo mitotic catastrophe and/or an apoptotic response. In xenograft models, MPI-0479605 inhibits tumor growth, suggesting that drugs targeting Mps1 may have utility as novel cancer therapeutics.[1]
Mps1 has been proposed to play a role in Aurora B signaling, but this remains controversial. Early studies showed that Mps1 phosphorylates borealin, a chromosomal passenger protein that regulates Aurora B, suggesting that Mps1 functions upstream of Aurora B during chromosome biorientation. In addition, the Mps1 inhibitor, MPS1-IN-1 was found to inhibit both Aurora B autophosphorylation on threonine 232 and phosphorylation of its substrate histone H3 on serine 10. In contrast, 2 other newly characterized inhibitors of Mps1 failed to affect Aurora B kinase activity. Inhibition of Aurora B overrides the SAC and impairs cytokinesis, resulting in multinucleated cells. Furthermore, cells treated with Aurora B inhibitors fail to effectively engage the postmitotic checkpoint, resulting in endoreduplication and subsequent polyploidy. These phenotypes were not highly observed in response to treatment with MPI-0479605 . Cell-cycle analysis failed to show a significant increase in 8N cells after 72 hours of treatment (Fig. 3A). Also, whereas there were some multinucleated cells, the vast majority were not (Fig. 2), indicating that MPI-0479605 does not impair cytokinesis. Furthermore, in p53-proficient cells, the postmitotic checkpoint seems to be intact following treatment with MPI-0479605, as indicated by an increase in p53 and p21 and the inhibition of DNA synthesis. As a result, the majority of cells do not become polyploid. These results show that inhibition of Mps1 does not affect the ability of Aurora B to promote cytokinesis or engage the postmitotic checkpoint, suggesting Aurora B functions independently of Mps1 in this context. Administration of MPI-0479605 to mice bearing human tumor xenografts led to partial TGI that was associated with significant toxicity. Related compounds with greater potency or superior pharmacokinetic properties (to be described elsewhere) did not show improved antitumor activity. In viability assays, MPI-0479605 inhibited the growth of normal colon cell lines (data not shown) as well as human fibroblasts immortalized with hTERT (Fig. 6C) and MPI-0479605 induced significant neutropenia in mice (Fig. 6B), indicating a lack of tumor selectivity. Recently, a novel Mps1 inhibitor was shown to have antitumor activity with no associated toxicity in 10- and 13-day xenograft studies using A2780 and A375 tumor cell lines. It will be of great interest to learn whether these responses are durable. If longer term exposure to Mps1 inhibitors as a single agent is intolerable, these compounds may still find utility when used in combination regimens, such as with tubulin-targeting agents. [1] |
| 分子式 |
C22H29N7O
|
|
|---|---|---|
| 分子量 |
407.511963605881
|
|
| 精确质量 |
407.243
|
|
| 元素分析 |
C, 64.84; H, 7.17; N, 24.06; O, 3.93
|
|
| CAS号 |
1246529-32-7
|
|
| 相关CAS号 |
|
|
| PubChem CID |
46909588
|
|
| 外观&性状 |
White to gray solid powder
|
|
| 密度 |
1.3±0.1 g/cm3
|
|
| 折射率 |
1.700
|
|
| LogP |
1.69
|
|
| tPSA |
90.99
|
|
| 氢键供体(HBD)数目 |
3
|
|
| 氢键受体(HBA)数目 |
7
|
|
| 可旋转键数目(RBC) |
5
|
|
| 重原子数目 |
30
|
|
| 分子复杂度/Complexity |
540
|
|
| 定义原子立体中心数目 |
0
|
|
| SMILES |
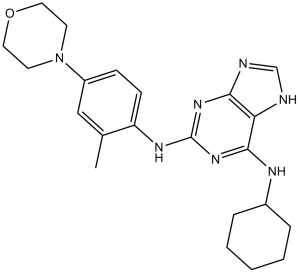
CC(C=C(N1CCOCC1)C=C2)=C2NC3=NC4=C(N=CN4)C(NC5CCCCC5)=N3
|
|
| InChi Key |
OVJBNYKNHXJGSA-UHFFFAOYSA-N
|
|
| InChi Code |
InChI=1S/C22H29N7O/c1-15-13-17(29-9-11-30-12-10-29)7-8-18(15)26-22-27-20-19(23-14-24-20)21(28-22)25-16-5-3-2-4-6-16/h7-8,13-14,16H,2-6,9-12H2,1H3,(H3,23,24,25,26,27,28)
|
|
| 化学名 |
N6-cyclohexyl-N2-(2-methyl-4-morpholinophenyl)-9H-purine-2,6-diamin
|
|
| 别名 |
|
|
| HS Tariff Code |
2934.99.9001
|
|
| 存储方式 |
Powder -20°C 3 years 4°C 2 years In solvent -80°C 6 months -20°C 1 month |
|
| 运输条件 |
Room temperature (This product is stable at ambient temperature for a few days during ordinary shipping and time spent in Customs)
|
| 溶解度 (体外实验) |
|
|||
|---|---|---|---|---|
| 溶解度 (体内实验) |
注意: 如下所列的是一些常用的体内动物实验溶解配方,主要用于溶解难溶或不溶于水的产品(水溶度<1 mg/mL)。 建议您先取少量样品进行尝试,如该配方可行,再根据实验需求增加样品量。
注射用配方
注射用配方1: DMSO : Tween 80: Saline = 10 : 5 : 85 (如: 100 μL DMSO → 50 μL Tween 80 → 850 μL Saline)(IP/IV/IM/SC等) *生理盐水/Saline的制备:将0.9g氯化钠/NaCl溶解在100 mL ddH ₂ O中,得到澄清溶液。 注射用配方 2: DMSO : PEG300 :Tween 80 : Saline = 10 : 40 : 5 : 45 (如: 100 μL DMSO → 400 μL PEG300 → 50 μL Tween 80 → 450 μL Saline) 注射用配方 3: DMSO : Corn oil = 10 : 90 (如: 100 μL DMSO → 900 μL Corn oil) 示例: 以注射用配方 3 (DMSO : Corn oil = 10 : 90) 为例说明, 如果要配制 1 mL 2.5 mg/mL的工作液, 您可以取 100 μL 25 mg/mL 澄清的 DMSO 储备液,加到 900 μL Corn oil/玉米油中, 混合均匀。 View More
注射用配方 4: DMSO : 20% SBE-β-CD in Saline = 10 : 90 [如:100 μL DMSO → 900 μL (20% SBE-β-CD in Saline)] 口服配方
口服配方 1: 悬浮于0.5% CMC Na (羧甲基纤维素钠) 口服配方 2: 悬浮于0.5% Carboxymethyl cellulose (羧甲基纤维素) 示例: 以口服配方 1 (悬浮于 0.5% CMC Na)为例说明, 如果要配制 100 mL 2.5 mg/mL 的工作液, 您可以先取0.5g CMC Na并将其溶解于100mL ddH2O中,得到0.5%CMC-Na澄清溶液;然后将250 mg待测化合物加到100 mL前述 0.5%CMC Na溶液中,得到悬浮液。 View More
口服配方 3: 溶解于 PEG400 (聚乙二醇400) 请根据您的实验动物和给药方式选择适当的溶解配方/方案: 1、请先配制澄清的储备液(如:用DMSO配置50 或 100 mg/mL母液(储备液)); 2、取适量母液,按从左到右的顺序依次添加助溶剂,澄清后再加入下一助溶剂。以 下列配方为例说明 (注意此配方只用于说明,并不一定代表此产品 的实际溶解配方): 10% DMSO → 40% PEG300 → 5% Tween-80 → 45% ddH2O (或 saline); 假设最终工作液的体积为 1 mL, 浓度为5 mg/mL: 取 100 μL 50 mg/mL 的澄清 DMSO 储备液加到 400 μL PEG300 中,混合均匀/澄清;向上述体系中加入50 μL Tween-80,混合均匀/澄清;然后继续加入450 μL ddH2O (或 saline)定容至 1 mL; 3、溶剂前显示的百分比是指该溶剂在最终溶液/工作液中的体积所占比例; 4、 如产品在配制过程中出现沉淀/析出,可通过加热(≤50℃)或超声的方式助溶; 5、为保证最佳实验结果,工作液请现配现用! 6、如不确定怎么将母液配置成体内动物实验的工作液,请查看说明书或联系我们; 7、 以上所有助溶剂都可在 Invivochem.cn网站购买。 |
| 制备储备液 | 1 mg | 5 mg | 10 mg | |
| 1 mM | 2.4539 mL | 12.2696 mL | 24.5393 mL | |
| 5 mM | 0.4908 mL | 2.4539 mL | 4.9079 mL | |
| 10 mM | 0.2454 mL | 1.2270 mL | 2.4539 mL |
1、根据实验需要选择合适的溶剂配制储备液 (母液):对于大多数产品,InvivoChem推荐用DMSO配置母液 (比如:5、10、20mM或者10、20、50 mg/mL浓度),个别水溶性高的产品可直接溶于水。产品在DMSO 、水或其他溶剂中的具体溶解度详见上”溶解度 (体外)”部分;
2、如果您找不到您想要的溶解度信息,或者很难将产品溶解在溶液中,请联系我们;
3、建议使用下列计算器进行相关计算(摩尔浓度计算器、稀释计算器、分子量计算器、重组计算器等);
4、母液配好之后,将其分装到常规用量,并储存在-20°C或-80°C,尽量减少反复冻融循环。
计算结果:
工作液浓度: mg/mL;
DMSO母液配制方法: mg 药物溶于 μL DMSO溶液(母液浓度 mg/mL)。如该浓度超过该批次药物DMSO溶解度,请首先与我们联系。
体内配方配制方法:取 μL DMSO母液,加入 μL PEG300,混匀澄清后加入μL Tween 80,混匀澄清后加入 μL ddH2O,混匀澄清。
(1) 请确保溶液澄清之后,再加入下一种溶剂 (助溶剂) 。可利用涡旋、超声或水浴加热等方法助溶;
(2) 一定要按顺序加入溶剂 (助溶剂) 。
|
|---|
|