| 规格 | 价格 | |
|---|---|---|
| 500mg | ||
| 1g | ||
| Other Sizes |
| 靶点 |
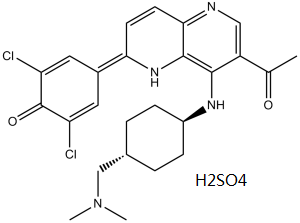
MELK (IC50 = 0.41 nM)
|
|---|---|
| 体外研究 (In Vitro) |
OTSSP167 抑制 A549(肺)、T47D(乳腺癌)、DU4475(乳腺癌)、22Rv1(前列腺)和 HT1197(膀胱)癌细胞的生长,IC50 值分别为 6.7、4.3、2.3、6.0 和 97 nM[1] 。 OTSSP167 可以废除 MCF7 细胞中的有丝分裂检查点、破坏 MCC 和 MCC-APC/C 相互作用。 OTSSP167 导致 GFP-MELK 定位到中期细胞的细胞皮层 [2]。 OTSSP167 是一种 MELK 选择性抑制剂,具有很强的体外活性,IC50 为 0.41 nM[3]。
|
| 体内研究 (In Vivo) |
OTSSP167在异种移植小鼠模型中的生长抑制作用[1]
随后,我们通过使用MDA-MB-231细胞(MELK-阳性、三阴性乳腺癌症细胞)的异种移植模型研究了OTSSP167的体内抗肿瘤作用。在肿瘤大小达到约100mm3后,将该化合物给予携带异种移植物的小鼠14天。肿瘤大小被测量为药物反应的替代标志物(肿瘤生长抑制(TGI))。每两天静脉注射一次20mg/kg的OTSSP167,TGI为73%(图3A)。由于该化合物的生物利用度预计非常高(数据未显示),我们尝试口服该化合物。口服10mg/kg,每天一次,TGI为72%(图3B)。由于对各种癌症细胞系具有强烈的生长抑制作用,我们使用其他类型的癌症细胞系进一步研究了体内生长抑制效应,并发现OTSSP167以剂量依赖的方式对多种癌症类型显着抑制肿瘤生长,没有或有少量体重损失(图3和补充图S1)。例如,携带A549(肺癌)异种移植物的小鼠通过静脉内施用1、5和10 mg/kg OTSSP167每天一次治疗,其TGI分别为51%、91%和108%(图3C),而通过口服施用5和10 mg/kg每天一次的小鼠显示TGI分别为95%和124%(图3D)。此外,我们通过每天一次口服10 mg/kg检查了DU145(癌症)和MIAPaCa-2(癌症)异种移植物模型,并观察到TGI分别为106和87%(图3E和F)。为了进一步验证MELK特异性体内肿瘤抑制作用,我们检测了几乎无法检测到MELK表达的PC-14肺癌细胞(图3G)。口服10mg/kg OTSSP167,每天一次,持续14天,对PC-14异种移植物没有肿瘤生长抑制作用(图3H),进一步支持了OTSSP177的MELK依赖性抗肿瘤活性。
|
| 参考文献 |
|
| 其他信息 |
We previously reported MELK (maternal embryonic leucine zipper kinase) as a novel therapeutic target for breast cancer. MELK was also reported to be highly upregulated in multiple types of human cancer. It was implied to play indispensable roles in cancer cell survival and indicated its involvement in the maintenance of tumor-initiating cells. We conducted a high-throughput screening of a compound library followed by structure-activity relationship studies, and successfully obtained a highly potent MELK inhibitor OTSSP167 with IC₅₀ of 0.41 nM. OTSSP167 inhibited the phosphorylation of PSMA1 (proteasome subunit alpha type 1) and DBNL (drebrin-like), which we identified as novel MELK substrates and are important for stem-cell characteristics and invasiveness. The compound suppressed mammosphere formation of breast cancer cells and exhibited significant tumor growth suppression in xenograft studies using breast, lung, prostate, and pancreas cancer cell lines in mice by both intravenous and oral administration. This MELK inhibitor should be a promising compound possibly to suppress the growth of tumor-initiating cells and be applied for treatment of a wide range of human cancer. [1]
Maternal embryonic leucine zipper kinase (MELK) is upregulated in a variety of human tumors, and is considered an attractive molecular target for cancer treatment. We characterized the expression of MELK in gastric cancer (GC) and measured the effects of reducing MELK mRNA levels and protein activity on GC growth. MELK was frequently overexpressed in primary GCs, and higher MELK levels correlated with worse clinical outcomes. Reducing MELK expression or inhibiting kinase activity resulted in growth inhibition, G2/M arrest, apoptosis and suppression of invasive capability of GC cells in vitro and in vivo. MELK knockdown led to alteration of epithelial mesenchymal transition (EMT)-associated proteins. Furthermore, targeting treatment with OTSSP167 in GC patient-derived xenograft (PDX) models had anticancer effects. Thus, MELK promotes cell growth and invasiveness by inhibiting apoptosis and promoting G2/M transition and EMT in GC. These results suggest that MELK may be a promising target for GC treatment.[2] OTSSP167 was recently characterized as a potent inhibitor for maternal embryonic leucine zipper kinase (MELK) and is currently tested in Phase I clinical trials for solid tumors that have not responded to other treatment. Here we report that OTSSP167 abrogates the mitotic checkpoint at concentrations used to inhibit MELK. The abrogation is not recapitulated by RNAi mediated silencing of MELK in cells. Although OTSSP167 indeed inhibits MELK, it exhibits off-target activity against Aurora B kinase in vitro and in cells. Furthermore, OTSSP167 inhibits BUB1 and Haspin kinases, reducing phosphorylation at histones H2AT120 and H3T3 and causing mislocalization of Aurora B and associated chromosomal passenger complex from the centromere/kinetochore. The results suggest that OTSSP167 may have additional mechanisms of action for cancer cell killing and caution the use of OTSSP167 as a MELK specific kinase inhibitor in biochemical and cellular assays.[3] Murine protein serine/threonine kinase 38 (MPK38), also known as maternal embryonic leucine zipper kinase (MELK), has been associated with various human cancers and plays an important role in the formation of cancer stem cells. OTSSP167, a MELK selective inhibitor, exhibits a strong in vitro activity, conferring an IC50 of 0.41nM and in vivo effect on various human cancer xenograft models. Here, we report the crystal structure of MPK38 (T167E), an active mutant, in complex with OTSSP167 and describe its detailed protein-inhibitor interactions. Comparison with the previous determined structure of MELK bound to the nanomolar inhibitors shows that OTSSP167 effectively fits into the active site, thus offering an opportunity for structure-based development and optimization of MELK inhibitors.[4] |
| 相关CAS号 |
1431697-89-0; 1431698-10-0
|
|---|---|
| 外观&性状 |
Typically exists as solid at room temperature
|
| HS Tariff Code |
2934.99.9001
|
| 存储方式 |
Powder -20°C 3 years 4°C 2 years In solvent -80°C 6 months -20°C 1 month |
| 运输条件 |
Room temperature (This product is stable at ambient temperature for a few days during ordinary shipping and time spent in Customs)
|
| 溶解度 (体外实验) |
May dissolve in DMSO (in most cases), if not, try other solvents such as H2O, Ethanol, or DMF with a minute amount of products to avoid loss of samples
|
|---|---|
| 溶解度 (体内实验) |
注意: 如下所列的是一些常用的体内动物实验溶解配方,主要用于溶解难溶或不溶于水的产品(水溶度<1 mg/mL)。 建议您先取少量样品进行尝试,如该配方可行,再根据实验需求增加样品量。
注射用配方
注射用配方1: DMSO : Tween 80: Saline = 10 : 5 : 85 (如: 100 μL DMSO → 50 μL Tween 80 → 850 μL Saline)(IP/IV/IM/SC等) *生理盐水/Saline的制备:将0.9g氯化钠/NaCl溶解在100 mL ddH ₂ O中,得到澄清溶液。 注射用配方 2: DMSO : PEG300 :Tween 80 : Saline = 10 : 40 : 5 : 45 (如: 100 μL DMSO → 400 μL PEG300 → 50 μL Tween 80 → 450 μL Saline) 注射用配方 3: DMSO : Corn oil = 10 : 90 (如: 100 μL DMSO → 900 μL Corn oil) 示例: 以注射用配方 3 (DMSO : Corn oil = 10 : 90) 为例说明, 如果要配制 1 mL 2.5 mg/mL的工作液, 您可以取 100 μL 25 mg/mL 澄清的 DMSO 储备液,加到 900 μL Corn oil/玉米油中, 混合均匀。 View More
注射用配方 4: DMSO : 20% SBE-β-CD in Saline = 10 : 90 [如:100 μL DMSO → 900 μL (20% SBE-β-CD in Saline)] 口服配方
口服配方 1: 悬浮于0.5% CMC Na (羧甲基纤维素钠) 口服配方 2: 悬浮于0.5% Carboxymethyl cellulose (羧甲基纤维素) 示例: 以口服配方 1 (悬浮于 0.5% CMC Na)为例说明, 如果要配制 100 mL 2.5 mg/mL 的工作液, 您可以先取0.5g CMC Na并将其溶解于100mL ddH2O中,得到0.5%CMC-Na澄清溶液;然后将250 mg待测化合物加到100 mL前述 0.5%CMC Na溶液中,得到悬浮液。 View More
口服配方 3: 溶解于 PEG400 (聚乙二醇400) 请根据您的实验动物和给药方式选择适当的溶解配方/方案: 1、请先配制澄清的储备液(如:用DMSO配置50 或 100 mg/mL母液(储备液)); 2、取适量母液,按从左到右的顺序依次添加助溶剂,澄清后再加入下一助溶剂。以 下列配方为例说明 (注意此配方只用于说明,并不一定代表此产品 的实际溶解配方): 10% DMSO → 40% PEG300 → 5% Tween-80 → 45% ddH2O (或 saline); 假设最终工作液的体积为 1 mL, 浓度为5 mg/mL: 取 100 μL 50 mg/mL 的澄清 DMSO 储备液加到 400 μL PEG300 中,混合均匀/澄清;向上述体系中加入50 μL Tween-80,混合均匀/澄清;然后继续加入450 μL ddH2O (或 saline)定容至 1 mL; 3、溶剂前显示的百分比是指该溶剂在最终溶液/工作液中的体积所占比例; 4、 如产品在配制过程中出现沉淀/析出,可通过加热(≤50℃)或超声的方式助溶; 5、为保证最佳实验结果,工作液请现配现用! 6、如不确定怎么将母液配置成体内动物实验的工作液,请查看说明书或联系我们; 7、 以上所有助溶剂都可在 Invivochem.cn网站购买。 |
计算结果:
工作液浓度: mg/mL;
DMSO母液配制方法: mg 药物溶于 μL DMSO溶液(母液浓度 mg/mL)。如该浓度超过该批次药物DMSO溶解度,请首先与我们联系。
体内配方配制方法:取 μL DMSO母液,加入 μL PEG300,混匀澄清后加入μL Tween 80,混匀澄清后加入 μL ddH2O,混匀澄清。
(1) 请确保溶液澄清之后,再加入下一种溶剂 (助溶剂) 。可利用涡旋、超声或水浴加热等方法助溶;
(2) 一定要按顺序加入溶剂 (助溶剂) 。