| 规格 | 价格 | 库存 | 数量 |
|---|---|---|---|
| 25mg |
|
||
| 100mg |
|
||
| 500mg |
|
||
| 1g | |||
| Other Sizes |
| 靶点 |
Glucocorticoid receptor
|
|---|---|
| 体外研究 (In Vitro) |
对糖皮质激素的耐药性或敏感性被认为对儿童急性淋巴细胞白血病的疾病预后至关重要。泼尼松龙对耐药CCRF-CEM白血病细胞系具有延迟的双相作用,低剂量时坏死,高剂量时凋亡。在低剂量下,尽管泼尼松龙诱导了总细胞死亡,但它仍具有显性促有丝分裂作用,而在高剂量下,泼尼松隆的促有丝分化和细胞死亡作用得到了平衡。早期基因微阵列分析显示,40个基因存在显著差异。泼尼松龙的促有丝分裂/双相作用在耐药白血病细胞的情况下具有临床意义。这种方法可能会导致识别未来与糖皮质激素联合治疗中分子药物靶点的候选基因,以及糖皮质激素耐药性的早期标志物[1]。
|
| 体内研究 (In Vivo) |
一氧化氮被认为参与非特异性细胞免疫。革兰氏阴性细菌内毒素通过诱导一氧化氮合酶II(NOS II)增加吞噬细胞中活性氮中间体(RNI)的产生。抗炎糖皮质激素可减弱内毒素诱导的RNI增加。本研究评估了体内给予泼尼松龙对大肠杆菌脂多糖内毒素(LPS)诱导的大鼠血浆RNI和中性粒细胞NOS II mRNA增加以及RNI产生的影响。我们发现,静脉注射0.5mg/kg亚致死剂量的LPS后2小时内,LPS迅速诱导大鼠中性粒细胞中NOS II的mRNA和RNI(NO2-和NO3-阴离子)的产生。在LPS前15分钟给予药物剂量的泼尼松龙(50微克/kg,im),可减弱中性粒细胞产生NO2-和NO_3-,并抑制LPS刺激的NOS II mRNA。3-氨基-1,2,4-三嗪抑制NO2-和NO3-的产生,而不影响NOS II的基因表达。这些数据表明,LPS迅速诱导NOS II的功能基因表达,泼尼松龙通过抑制其mRNA的转录来阻止NOS II活性的诱导[2]。
短期服用大剂量皮质类固醇后,膈肌萎缩和无力。在本研究中,研究了长期服用中等剂量的氟化和非氟化类固醇对大鼠膈肌收缩特性和组织病理学的影响。60只大鼠每天接受生理盐水、1.0 mg/kg曲安奈德或1.25或5 mg/kg泼尼松龙肌肉注射,持续4周。对照组和两个泼尼松龙组的呼吸和外周肌肉质量同样增加,而曲安奈德会导致严重的肌肉萎缩。对照组的最大强直张力平均为2.23+/-0.54kg/cm2(SD)。5-mg/kg泼尼松龙组膈肌束数量的增加产生了最大强直张力<2.0 kg/cm2(P<0.05)。此外,该组在力量频率方案期间的疲劳性最为明显(P<0.05)。相比之下,曲安奈德导致半松弛时间延长和力-频率曲线向左偏移(P<0.05)。对照组和1.25mg/kg泼尼松龙组的膈肌组织学检查显示正常模式。然而,在5-mg/kg泼尼松龙组中发现了肌源性变化,在曲安奈德组中更为明显。在后一组中发现了选择性IIb型纤维萎缩,但在泼尼松龙组中没有发现。总之,曲安奈德诱导IIb型纤维萎缩,导致呼吸肌力量减弱和力频曲线向左偏移。相比之下,5 mg/kg泼尼松龙引起膈肌收缩特性的改变和组织学变化,而没有纤维萎缩[3]。 |
| 细胞实验 |
泼尼松龙治疗[1]
根据1个月至12岁儿童静脉注射的平均体内剂量选择泼尼松龙的浓度(详细信息见补充数据,文件:CCRFCEM细胞毒性测定.xls)。此外,皮质醇当量的生物活性估计在40-200nM的范围内。为确保研究涵盖这些范围,将泼尼松龙稀释至以下12个浓度:对照组、10 nM、100 nM、1μM、5.5μM、11μM、22μM、44μM、88μM、175μM、350μM和700μM。 细胞增殖测定 使用NIHON KOHDEN CellTaq-α血液分析仪测定细胞群计数。在开始接触Prednisolone/泼尼松龙后-24小时以及0小时、4小时、24小时、48小时和72小时对细胞进行计数。为此,从每个烧瓶中获得200μl细胞悬浮液,并直接用分析仪计数。 蛋白质提取和蛋白质印迹[1] 在暴露于不同浓度的Prednisolone/泼尼松龙1小时和4小时后收获细胞。如前所述进行蛋白质提取和蛋白质印迹。以牛血清白蛋白为标准,采用Bradford法测定总蛋白含量。通过SDS-PAGE分离蛋白质,并用抗p65抗体进行蛋白质印迹 微阵列分析[1] cDNA微阵列芯片(1200个基因)从TAKARA(人癌症芯片v.40)获得。按照制造商的描述,使用CyScribe Post Labeling试剂盒进行杂交,使用Cy3和Cy5荧光染料。载玻片用微阵列扫描仪扫描。使用ScanArray微阵列采集软件生成图像。使用来自三个实验装置的cDNA,每个装置由三个独立的实验组成。实验装置由以下三对组成:对照组与10 nMPrednisolone(指定为0vs1),10 nM泼尼松龙与700μM泼尼松隆(指定为1vs3),对照组与700μM泼尼松松(指定为0vs3)。如前所述,这是一种“简单循环”实验设计,考虑了样本之间的所有可能组合。原始微阵列数据可作为补充数据。 实时逆转录聚合酶链式反应(qRT-PCR)[1] 使用一步法Plexor™qRT-PCR试剂盒,在4小时和48小时的处理下,从3个样品对照中检测GRIM19(NDUFA13)基因,即10 nM和700μM的Prednisolone。该套引物是使用Promega的在线工具Plexor™引物设计系统v1.2设计的 |
| 动物实验 |
Study design, animals, and treatment [3]
60 adult male Wistar rats, aged 14 wk, weighing 350-400 g, were randomized in quadruplets, into one of four treatment groups: control (C), saline, 0.05 ml/d i.m.; low dose prednisolone (LD), 1.25 mg/kg per d i.m.; high dose prednisolone (HD), 5 mg/kg per d i.m.; or triamcinolone-diacetate (TR), 1 mg/kg per d i.m. Dilution of medication was performed such that with each injection all animals received a similar volume (0.05 ml). During 4 wk the animals were injected daily in the left hindlimb. They were fed ad libitum and weighed twice weekly. After the treatment period, contractile properties, histological, and histochemical characteristics of the diaphragm were examined.[3] |
| 参考文献 |
|
| 其他信息 |
ATL-2502(Colal-Pred) is an old drug (prednisolone metasulphobenzoate, a steroid) with a new delivery system that releases the medication only in the colon. Releasing the drug directly into the colon reduces the potential for significant side effects often experienced with steroid drugs. Colal-Pred is being studied for use in ulcerative colitis.
Prednisolone Sodium Metasulfobenzoate is a poorly adsorbed analog of prednisolone, a synthetic glucocorticoid with anti-inflammatory and immunomodulating properties. After cell surface receptor attachment and cell entry, prednisolone enters the nucleus where it binds to and activates specific nuclear receptors, resulting in an altered gene expression and inhibition of proinflammatory cytokine production. This agent also decreases the number of circulating lymphocytes, induces cell differentiation, and stimulates apoptosis in sensitive tumor cells populations. (NCI) Drug Indication Investigated for use/treatment in inflammatory bowel disease and ulcerative colitis. Mechanism of Action ATL-2502 is the combination of Alizyme's proprietary colonic drug delivery system, colal, and prednisolone metasulfobenzoate sodium ("PMSBS"), an approved steroid in Europe. colal-PRED has a starch coating that is only broken down in the gut by bacteria occurring in the colon. This leads to topical delivery of PMSBS to the colon rather than systemic delivery with the objective of providing efficacy, but without the side effects of steroids; however, the efficacy and safety of colal-PRED must be shown in well-controlled, prospective clinical trials and approved by the FDA. In conclusion, this study shows: (a) prednisolone exerts a delayed biphasic effect on CCRF-CEM cells, necrotic at low doses and apoptotic at higher doses, (b) at low doses, prednisolone exerts a pre-dominant mitogenic effect despite its induction on total cell death, while at higher doses, prednisolone's mitogenic and cell death effects are counterbalanced. These mitogenic effects are of clinical importance in the case of resistant leukemic cells. It is of crucial importance if a certain administered dose of GCs to an ALL patient possesses proliferative rather than suppressive actions, (c) NF-κB is constitutively localized in the nucleus and its inhibition emerges as a possible candidate for the treatment of resistant leukemia, (d) prednisolone activates genes related to at least four different pathways upon 4 h treatment: apoptosis and tumor suppression, cell cycle progression, metabolism and intra- and extra-cellular signaling. Several of these genes manifested a biphasic differential expression profile. This approach might lead to the identification of genes candidates for future molecular drug targets in combination therapy with GCs. These drugs may affect the potential of GCs to inhibit growth of resistant leukemic cells. Also, this type of approach could identify potential early markers for GCs resistance. Early detection of resistance could facilitate the efficiency of ALL therapies.[1] In conclusion, the present study shows that triamcinolone and prednisolone have different effects on morphology and contractile properties of the rat diaphragm. Fluorinated steroids such as triamcinolone caused severe muscle wasting due to selective type Ilb fiber atrophy, resulting in markedly reduced respiratory muscle strength. Prednisolone in four times higher doses caused a tendency towards lower tetanic tensions and increased fatigability of diaphragmatic muscle bundles, with distinct alterations in muscle histology.[3] |
| 分子式 |
C28H31O9S-.NA+
|
|---|---|
| 分子量 |
566.59514
|
| 精确质量 |
566.158
|
| 元素分析 |
C, 59.36; H, 5.52; Na, 4.06; O, 25.41; S, 5.66
|
| CAS号 |
630-67-1
|
| 相关CAS号 |
52-21-1 (acetate);72064-79-0 (valerate acetate);630-67-1 (sodium metazoate);125-02-0 (Na+ phosphate); 50-24-8 (free);
|
| PubChem CID |
23675004
|
| 外观&性状 |
Typically exists as solid at room temperature
|
| tPSA |
167
|
| 氢键供体(HBD)数目 |
2
|
| 氢键受体(HBA)数目 |
9
|
| 可旋转键数目(RBC) |
6
|
| 重原子数目 |
39
|
| 分子复杂度/Complexity |
1210
|
| 定义原子立体中心数目 |
7
|
| SMILES |
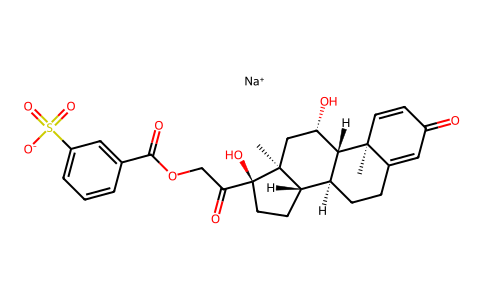
C[C@]12C[C@@H]([C@H]3[C@H]([C@@H]1CC[C@@]2(C(=O)COC(=O)C4=CC(=CC=C4)S(=O)(=O)[O-])O)CCC5=CC(=O)C=C[C@]35C)O.[Na+]
|
| InChi Key |
RWFZSORKWFPGNE-VDYYWZOJSA-M
|
| InChi Code |
InChI=1S/C28H32O9S.Na/c1-26-10-8-18(29)13-17(26)6-7-20-21-9-11-28(33,27(21,2)14-22(30)24(20)26)23(31)15-37-25(32)16-4-3-5-19(12-16)38(34,35)36;/h3-5,8,10,12-13,20-22,24,30,33H,6-7,9,11,14-15H2,1-2H3,(H,34,35,36);/q;+1/p-1/t20-,21-,22-,24+,26-,27-,28-;/m0./s1
|
| 化学名 |
sodium;3-[2-[(8S,9S,10R,11S,13S,14S,17R)-11,17-dihydroxy-10,13-dimethyl-3-oxo-7,8,9,11,12,14,15,16-octahydro-6H-cyclopenta[a]phenanthren-17-yl]-2-oxoethoxy]carbonylbenzenesulfonate
|
| 别名 |
PREDNISOLONE SODIUM METAZOATE; 630-67-1; Cortico-Sol; Prednisolone sodium metasulfobenzoate; Prednisolone methylsulfobenzoate; UNII-D345THM53T; Prednisolone sodium metazoate [USAN]; D345THM53T;
|
| HS Tariff Code |
2934.99.9001
|
| 存储方式 |
Powder -20°C 3 years 4°C 2 years In solvent -80°C 6 months -20°C 1 month |
| 运输条件 |
Room temperature (This product is stable at ambient temperature for a few days during ordinary shipping and time spent in Customs)
|
| 溶解度 (体外实验) |
May dissolve in DMSO (in most cases), if not, try other solvents such as H2O, Ethanol, or DMF with a minute amount of products to avoid loss of samples
|
|---|---|
| 溶解度 (体内实验) |
注意: 如下所列的是一些常用的体内动物实验溶解配方,主要用于溶解难溶或不溶于水的产品(水溶度<1 mg/mL)。 建议您先取少量样品进行尝试,如该配方可行,再根据实验需求增加样品量。
注射用配方
注射用配方1: DMSO : Tween 80: Saline = 10 : 5 : 85 (如: 100 μL DMSO → 50 μL Tween 80 → 850 μL Saline)(IP/IV/IM/SC等) *生理盐水/Saline的制备:将0.9g氯化钠/NaCl溶解在100 mL ddH ₂ O中,得到澄清溶液。 注射用配方 2: DMSO : PEG300 :Tween 80 : Saline = 10 : 40 : 5 : 45 (如: 100 μL DMSO → 400 μL PEG300 → 50 μL Tween 80 → 450 μL Saline) 注射用配方 3: DMSO : Corn oil = 10 : 90 (如: 100 μL DMSO → 900 μL Corn oil) 示例: 以注射用配方 3 (DMSO : Corn oil = 10 : 90) 为例说明, 如果要配制 1 mL 2.5 mg/mL的工作液, 您可以取 100 μL 25 mg/mL 澄清的 DMSO 储备液,加到 900 μL Corn oil/玉米油中, 混合均匀。 View More
注射用配方 4: DMSO : 20% SBE-β-CD in Saline = 10 : 90 [如:100 μL DMSO → 900 μL (20% SBE-β-CD in Saline)] 口服配方
口服配方 1: 悬浮于0.5% CMC Na (羧甲基纤维素钠) 口服配方 2: 悬浮于0.5% Carboxymethyl cellulose (羧甲基纤维素) 示例: 以口服配方 1 (悬浮于 0.5% CMC Na)为例说明, 如果要配制 100 mL 2.5 mg/mL 的工作液, 您可以先取0.5g CMC Na并将其溶解于100mL ddH2O中,得到0.5%CMC-Na澄清溶液;然后将250 mg待测化合物加到100 mL前述 0.5%CMC Na溶液中,得到悬浮液。 View More
口服配方 3: 溶解于 PEG400 (聚乙二醇400) 请根据您的实验动物和给药方式选择适当的溶解配方/方案: 1、请先配制澄清的储备液(如:用DMSO配置50 或 100 mg/mL母液(储备液)); 2、取适量母液,按从左到右的顺序依次添加助溶剂,澄清后再加入下一助溶剂。以 下列配方为例说明 (注意此配方只用于说明,并不一定代表此产品 的实际溶解配方): 10% DMSO → 40% PEG300 → 5% Tween-80 → 45% ddH2O (或 saline); 假设最终工作液的体积为 1 mL, 浓度为5 mg/mL: 取 100 μL 50 mg/mL 的澄清 DMSO 储备液加到 400 μL PEG300 中,混合均匀/澄清;向上述体系中加入50 μL Tween-80,混合均匀/澄清;然后继续加入450 μL ddH2O (或 saline)定容至 1 mL; 3、溶剂前显示的百分比是指该溶剂在最终溶液/工作液中的体积所占比例; 4、 如产品在配制过程中出现沉淀/析出,可通过加热(≤50℃)或超声的方式助溶; 5、为保证最佳实验结果,工作液请现配现用! 6、如不确定怎么将母液配置成体内动物实验的工作液,请查看说明书或联系我们; 7、 以上所有助溶剂都可在 Invivochem.cn网站购买。 |
| 制备储备液 | 1 mg | 5 mg | 10 mg | |
| 1 mM | 1.7649 mL | 8.8246 mL | 17.6491 mL | |
| 5 mM | 0.3530 mL | 1.7649 mL | 3.5298 mL | |
| 10 mM | 0.1765 mL | 0.8825 mL | 1.7649 mL |
1、根据实验需要选择合适的溶剂配制储备液 (母液):对于大多数产品,InvivoChem推荐用DMSO配置母液 (比如:5、10、20mM或者10、20、50 mg/mL浓度),个别水溶性高的产品可直接溶于水。产品在DMSO 、水或其他溶剂中的具体溶解度详见上”溶解度 (体外)”部分;
2、如果您找不到您想要的溶解度信息,或者很难将产品溶解在溶液中,请联系我们;
3、建议使用下列计算器进行相关计算(摩尔浓度计算器、稀释计算器、分子量计算器、重组计算器等);
4、母液配好之后,将其分装到常规用量,并储存在-20°C或-80°C,尽量减少反复冻融循环。
计算结果:
工作液浓度: mg/mL;
DMSO母液配制方法: mg 药物溶于 μL DMSO溶液(母液浓度 mg/mL)。如该浓度超过该批次药物DMSO溶解度,请首先与我们联系。
体内配方配制方法:取 μL DMSO母液,加入 μL PEG300,混匀澄清后加入μL Tween 80,混匀澄清后加入 μL ddH2O,混匀澄清。
(1) 请确保溶液澄清之后,再加入下一种溶剂 (助溶剂) 。可利用涡旋、超声或水浴加热等方法助溶;
(2) 一定要按顺序加入溶剂 (助溶剂) 。