| 规格 | 价格 | |
|---|---|---|
| 500mg | ||
| 1g | ||
| Other Sizes |
| 靶点 |
Cannabinoid receptor
|
|---|---|
| 体外研究 (In Vitro) |
CP55940以独立的浓度方式恢复线粒体膜电位(ΔΨm)并抑制PSEN1 E280A ChLN中ROS的产生。[2]
CP55940以CB1受体非依赖的方式恢复ΔΨm,但减少PSEN1 E280A ChLN中部分依赖CB1受体的ROS产生。[2] CP55940以CB1Rs非依赖的方式减少细胞内sAβPPβf聚集,但它减少了PSEN1 E280A ChLN中部分依赖CB1Rs的氧化DJ-1。[2] CP55940以独立于CB1Rs的方式阻断PSEN1 E280A ChLN的凋亡。[2] CP55940以独立于CB1Rs的方式抑制tau磷酸化PSEN1 E280A ChLN。[2] CP55940降低了PSEN 1 E280A ChLN中独立于CB1Rs的eAβ42蛋白片段的水平。[2] CP55940不能恢复PSEN1 E280A ChLN中的Ca2+失调。[2] BAY 59-3074[3-[2-氰基-3-(三氟甲基)苯氧基]苯基-4,4,4-三氟-1-丁烷磺酸盐]是一种结构新颖的大麻素CB1/CB2受体部分激动剂,具有镇痛作用。[1] 在两种反向激动剂(以下简称SR)存在的情况下,CP几乎完全抑制了细胞内sAβPPβf和p-Tau的聚集,增加了ΔΨm,减少了DJ-1Cys106-SH残基的氧化,并阻断了突变ChLN中c-Jun、p53、PUMA和caspase-3的激活,与CB1Rs信号传导无关。CP还抑制部分依赖CB1R的活性氧物种的产生。尽管CP降低了细胞外Aβ42,但它无法逆转突变ChLN对乙酰胆碱刺激的Ca2+内流失调反应。在SR加CP存在或不存在的情况下,暴露于抗Aβ抗体6E10(1:300)完全恢复了突变ChLN对乙酰胆碱的瞬时[Ca2+]i信号。[2] |
| 体内研究 (In Vivo) |
本研究旨在通过高灵敏度的体内试验确认其受体结合谱。在28次训练后,大鼠(n=10)学会了以固定比例(10,食物强化双杠杆程序)区分BAY 59-3074(0.5mg/kg,口服,t-1h)和载体。BAY 59-3074呈全身剂量依赖性(ED(50):0.081 mg/kg,口服),给药后0.25至4小时可检测到提示。选择性大麻素CB1受体拮抗剂SR 141716A[N-(哌啶-1-基)-5-(4-氯苯基)-1-(2,4-二氯苯基)-4-甲基-1H-吡唑-3-甲酰胺盐酸盐]阻断了BAY 59-3074的鉴别作用(ID50:1.79mg/kg,i.p.)。
腹腔注射BAY 59-3074(ED50值:0.41 mg/kg)和参考大麻素BAY 38-7271[(-)-(R)-3-(2-羟基甲基茚基-4-氧基)苯基-4,4,4-三氟-1-丁磺酸酯,0.011 mg/kg]、CP 55940[(-”-顺-3-[2-羟基-4(1,1-二甲基庚基)苯基]-反-4-(3-羟基丙基)环己醇,0.013 mg/kg]、HU-210[(-WIN55212-2[(R)-4,5-二氢-2-甲基-4(4-吗啉基甲基)-1-(1-萘羰基)-6H-吡咯并[3,2,1-ij]喹啉-6-酮,0.41mg/kg]和(-)-Delta9-四氢大麻酚(0.41mg/kg)。具有镇痛作用的非大麻素,如吗啡、阿米替林、卡马西平、加巴喷丁和巴氯芬,并没有推广到这一线索。结果表明,BAY 59-3074的鉴别刺激作用是由大麻素CB1受体激活特异性介导的[1]。
|
| 酶活实验 |
受体结合试验。[3]
1.CB1测定。使用中国仓鼠卵巢(CHO)细胞的膜制剂测定CB1受体亲和力,其中人大麻素CB1受体与[3H]CP 55940作为放射性配体稳定转染19。在将新制备的细胞膜制剂与[3H]-放射性配体孵育后,加入或不加入测试化合物,通过玻璃纤维过滤器过滤进行结合配体和游离配体的分离。通过液体闪烁计数测量过滤器上的放射性。将至少三次独立测量的IC50值合并,并使用Cheng和Prusoff的假设转换为Ki值。 CB2测定。[3] 使用中国仓鼠卵巢(CHO)细胞的膜制剂测定CB2受体亲和力,其中人大麻素CB2受体与[3H]CP 55940作为放射性配体稳定转染。在将新制备的细胞膜制剂与[3H]-放射性配体孵育后,加入或不加入测试化合物,通过玻璃纤维过滤器过滤进行结合配体和游离配体的分离。通过液体闪烁计数测量过滤器上的放射性。将至少两次独立测量的IC50值合并,并使用Cheng和Prusoff的假设转换为Ki值。 体外药理学。[3] 花生四烯酸释放的测量。用克隆在中国仓鼠卵巢(CHO)细胞中的人CB1受体评估CB1受体拮抗作用。CHO细胞在添加了10%热灭活胎牛血清的Dulbecco改良Eagle培养基(DMEM)培养基中生长。吸取培养基,用DMEM代替,不含胎牛血清,但含有[3H]-花生四烯酸,并在细胞培养炉中孵育过夜(5%CO2/95%空气;37°C;水饱和气氛)。在此期间,[3H]-花生四烯酸被掺入膜磷脂中。在测试日,吸出培养基,用0.5mL含0.2%牛血清白蛋白(BSA)的DMEM洗涤细胞三次。WIN 55212-2刺激CB1受体导致PLA2激活,随后[3H]-花生四烯酸释放到培养基中。这种WIN 55212-2诱导的释放被CB1受体拮抗剂浓度依赖性地拮抗。试验化合物的CB1拮抗效力表示为pA2值。 P-糖蛋白测定。[3] 评估了人MDR1 P-糖蛋白泵在PK1 LLC MDR细胞单层上转移化合物的能力。使用文献31中基本描述的运输方法。在实验开始时,以1μg/mL的浓度将化合物添加到细胞层的一侧。测量了底部到顶部的运输以及顶部到底部的运输。P-糖蛋白(Pgp)因子表示为自下而上运输和自上而下运输的比率。膜通过率表示为在添加化合物后3小时从底部到顶部和从顶部到底部运输的化合物的平均百分比。使用LC/MS法进行化合物检测。 |
| 细胞实验 |
细胞分析[2]
检测方案[2] WT和PSEN1 E280A ChLNs细胞培养测定的方法是相同的。初始CP 55940筛选在10 nM和1μM之间进行了至少两次,一式三次。随后,确定CP 55940(1μM)为进一步实验的最佳浓度。ChLN分为四组:1)未治疗组;2) 分别用终浓度为1μM的SR141716(CB1受体反向激动剂)和SR144528(CB2受体反向激动器)治疗(以下简称SR);3) CP 55940(或CP);4) RS+CP55940(也称为SR+CP鸡尾酒)。为了阻断eAβ42,在分化后,在有或没有CP或CP+RS的情况下,将野生型和突变型ChLN与抗Aβ42抗体6E10(RCm中1:300)一起孵育四天。 野生型(WT)和PSEN1 ChLN仅暴露于CP(1μM)或在CB1和CB2受体(CB1R、CB2Rs)反向激动剂SR141716(1μM)和SR144528(1μM.)存在的情况下暴露24小时。对未治疗或治疗的神经元进行生化和功能分析评估[2]。 |
| 动物实验 |
In Vivo Pharmacology. 1. CP 55940 Induced Hypotension in Rat. Male normotensive rats (225−300 g; Harlan, Horst, The Netherlands) were anaesthetized with pentobarbital (80 mg/kg ip). Blood pressure was measured, via a cannula inserted into the left carotid artery, by means of a Spectramed DTX-plus pressure transducer (Spectramed B. V., Bilthoven, The Netherlands). After amplification by a Nihon Kohden Carrier amplifier (Type AP-621G; Nihon Kohden B. V., Amsterdam, The Netherlands), the blood pressure signal was registered on a personal computer (Compaq Deskpro 386s), by means of a Po-Ne-Mah data-acquisition program (Po-Ne-Mah Inc., Storrs, USA). Heart rate was derived from the pulsatile pressure signal. All compounds were administered orally as a microsuspension in 1% methylcellulose 30 min before induction of the anesthesia which was 60 min prior to administration of the CB1 receptor agonist CP-55,940. The injection volume was 10 mL kg-1. After haemodynamic stabilization the CB1 receptor agonist CP-55,940 (0.1 mg kg-1 i.v.) was administered and the hypotensive effect22 established. Typical blood pressure after administration of CP-55,940 was approximately 60% as compared to vehicle treated animals.[3]
|
| 参考文献 |
[1]. Eur J Pharmacol.2004 Nov 28;505(1-3):127-33.
[2]. J Alzheimers Dis. 2021; 82(Suppl 1): S359–S378. [3]. J Med Chem. 2004 Jan 29;47(3):627-43. |
| 其他信息 |
A series of novel 3,4-diarylpyrazolines was synthesized and evaluated in cannabinoid (hCB(1) and hCB(2)) receptor assays. The 3,4-diarylpyrazolines elicited potent in vitro CB(1) antagonistic activities and in general exhibited high CB(1) vs CB(2) receptor subtype selectivities. Some key representatives showed potent pharmacological in vivo activities after oral dosing in both a CB agonist-induced blood pressure model and a CB agonist-induced hypothermia model. Chiral separation of racemic 67, followed by crystallization and an X-ray diffraction study, elucidated the absolute configuration of the eutomer 80 (SLV319) at its C(4) position as 4S. Bioanalytical studies revealed a high CNS-plasma ratio for the development candidate 80. Molecular modeling studies showed a relatively close three-dimensional structural overlap between 80 and the known CB(1) receptor antagonist rimonabant (SR141716A). Further analysis of the X-ray diffraction data of 80 revealed the presence of an intramolecular hydrogen bond that was confirmed by computational methods. Computational models and X-ray diffraction data indicated a different intramolecular hydrogen bonding pattern in the in vivo inactive compound 6. In addition, X-ray diffraction studies of 6 revealed a tighter intermolecular packing than 80, which also may contribute to its poorer absorption in vivo. Replacement of the amidine -NH(2) moiety with a -NHCH(3) group proved to be the key change for gaining oral biovailability in this series of compounds leading to the identification of 80. [3]
Background: Alzheimer’s disease (AD) is characterized by structural damage, death, and functional disruption of cholinergic neurons (ChNs) as a result of intracellular amyloid-β (Aβ) aggregation, extracellular neuritic plaques, and hyperphosphorylation of protein tau (p-Tau) overtime. Objective: To evaluate the effect of the synthetic cannabinoid CP 55940(CP) on PSEN1 E280A cholinergic-like nerve cells (PSEN1 ChLNs)—a natural model of familial AD. Methods: Wild type (WT) and PSEN1 ChLNs were exposed to CP (1μM) only or in the presence of the CB1 and CB2 receptors (CB1Rs, CB2Rs) inverse agonist SR141716 (1μM) and SR144528 (1μM) respectively, for 24 h. Untreated or treated neurons were assessed for biochemical and functional analysis. Results: CP in the presence of both inverse agonists (hereafter SR) almost completely inhibits the aggregation of intracellular sAβPPβf and p-Tau, increases ΔΨm, decreases oxidation of DJ-1Cys106-SH residue, and blocks the activation of c-Jun, p53, PUMA, and caspase-3 independently of CB1Rs signaling in mutant ChLNs. CP also inhibits the generation of reactive oxygen species partially dependent on CB1Rs. Although CP reduced extracellular Aβ42, it was unable to reverse the Ca2+ influx dysregulation as a response to acetylcholine stimuli in mutant ChLNs. Exposure to anti-Aβ antibody 6E10 (1:300) in the absence or presence of SR plus CP completely recovered transient [Ca2+]i signal as a response to acetylcholine in mutant ChLNs. Conclusion: Taken together our findings suggest that the combination of cannabinoids, CB1Rs inverse agonists, and anti-Aβ antibodies might be a promising therapeutic approach for the treatment of familial AD.[2] BAY 59-3074 [3-[2-cyano-3-(trifluoromethyl)phenoxy]phenyl-4,4,4-trifluoro-1-butane-sulfonate] is a structurally novel cannabinoid CB1/CB2 receptor partial agonist with analgesic properties. The present study was performed to confirm its receptor binding profile in a highly sensitive in vivo assay. Rats (n=10) learned to discriminate BAY 59-3074 (0.5 mg/kg, p.o., t-1 h) from vehicle in a fixed-ratio: 10, food-reinforced two-lever procedure after a median number of 28 training sessions. BAY 59-3074 generalized dose-dependently (ED(50): 0.081 mg/kg, p.o.) and the cue was detectable between 0.25 and 4 h after administration. The selective cannabinoid CB1 receptor antagonist SR 141716A [N-(piperidin-1-yl)-5-(4-chlorophenyl)-1-(2,4-dichlorophenyl)-4-methyl-1H-pyrazole-3-carboxamide hydrochloride] blocked the discriminative effects of BAY 59-3074 (ID50: 1.79 mg/kg, i.p.). Complete generalization was also obtained after i.p. administration of BAY 59-3074 (ED50 value: 0.41 mg/kg), and the reference cannabinoids BAY 38-7271 [(-)-(R)-3-(2-hydroxymethylindanyl-4-oxy)phenyl-4,4,4-trifluoro-1-butanesulfonate, 0.011 mg/kg], CP 55940 [(-)-cis-3-[2-hydroxy-4(1,1-dimethylheptyl)phenyl]-trans-4-(3-hydroxy-propyl)cyclohexanol, 0.013 mg/kg], HU-210 [(-)-11-OH-Delta8-tetrahydrocannabinol dimethylheptyl, 0.022 mg/kg], WIN 55,212-2 [(R)-4,5-dihydro-2-methyl-4(4-morpholinylmethyl)-1-(1-naphthalenylcarbonyl)-6H-pyrrolo [3,2,1-ij] quinolin-6-one, 0.41 mg/kg] and (-)-Delta9-tetrahydrocannabinol (0.41 mg/kg). Non-cannabinoids with analgesic properties, such as morphine, amitriptyline, carbamazepine, gabapentin and baclofen, did not generalize to the cue. It is concluded that the discriminative stimulus effects of BAY 59-3074 are specifically mediated by cannabinoid CB1 receptor activation.[1] |
| 分子式 |
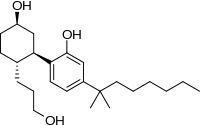
C24H40O3
|
|---|---|
| 分子量 |
376.57
|
| 精确质量 |
376.297
|
| 元素分析 |
C, 76.55; H, 10.71; O, 12.75
|
| CAS号 |
83002-04-4
|
| PubChem CID |
104895
|
| 外观&性状 |
Typically exists as solid at room temperature
|
| 密度 |
1.0±0.1 g/cm3
|
| 沸点 |
494.4±45.0 °C at 760 mmHg
|
| 闪点 |
209.2±23.3 °C
|
| 蒸汽压 |
0.0±1.3 mmHg at 25°C
|
| 折射率 |
1.526
|
| LogP |
5.97
|
| tPSA |
60.69
|
| 氢键供体(HBD)数目 |
3
|
| 氢键受体(HBA)数目 |
3
|
| 可旋转键数目(RBC) |
10
|
| 重原子数目 |
27
|
| 分子复杂度/Complexity |
408
|
| 定义原子立体中心数目 |
3
|
| SMILES |
CCCCCCC(C)(C)C1=CC(=C(C=C1)[C@@H]2C[C@@H](CC[C@H]2CCCO)O)O
|
| InChi Key |
YNZFFALZMRAPHQ-SYYKKAFVSA-N
|
| InChi Code |
InChI=1S/C24H40O3/c1-4-5-6-7-14-24(2,3)19-11-13-21(23(27)16-19)22-17-20(26)12-10-18(22)9-8-15-25/h11,13,16,18,20,22,25-27H,4-10,12,14-15,17H2,1-3H3/t18-,20-,22-/m1/s1
|
| 化学名 |
2-[(1R,2R,5R)-5-hydroxy-2-(3-hydroxypropyl)cyclohexyl]-5-(2-methyloctan-2-yl)phenol
|
| 别名 |
CP55940; CP-55940; 83003-12-7; 83002-04-4; 2-[(1r,2r,5r)-5-hydroxy-2-(3-hydroxypropyl)cyclohexyl]-5-(2-methyloctan-2-yl)phenol; CP55,940; CP-55,940; 8YX8JK1BQG;
|
| HS Tariff Code |
2934.99.9001
|
| 存储方式 |
Powder -20°C 3 years 4°C 2 years In solvent -80°C 6 months -20°C 1 month |
| 运输条件 |
Room temperature (This product is stable at ambient temperature for a few days during ordinary shipping and time spent in Customs)
|
| 溶解度 (体外实验) |
May dissolve in DMSO (in most cases), if not, try other solvents such as H2O, Ethanol, or DMF with a minute amount of products to avoid loss of samples
|
|---|---|
| 溶解度 (体内实验) |
注意: 如下所列的是一些常用的体内动物实验溶解配方,主要用于溶解难溶或不溶于水的产品(水溶度<1 mg/mL)。 建议您先取少量样品进行尝试,如该配方可行,再根据实验需求增加样品量。
注射用配方
注射用配方1: DMSO : Tween 80: Saline = 10 : 5 : 85 (如: 100 μL DMSO → 50 μL Tween 80 → 850 μL Saline)(IP/IV/IM/SC等) *生理盐水/Saline的制备:将0.9g氯化钠/NaCl溶解在100 mL ddH ₂ O中,得到澄清溶液。 注射用配方 2: DMSO : PEG300 :Tween 80 : Saline = 10 : 40 : 5 : 45 (如: 100 μL DMSO → 400 μL PEG300 → 50 μL Tween 80 → 450 μL Saline) 注射用配方 3: DMSO : Corn oil = 10 : 90 (如: 100 μL DMSO → 900 μL Corn oil) 示例: 以注射用配方 3 (DMSO : Corn oil = 10 : 90) 为例说明, 如果要配制 1 mL 2.5 mg/mL的工作液, 您可以取 100 μL 25 mg/mL 澄清的 DMSO 储备液,加到 900 μL Corn oil/玉米油中, 混合均匀。 View More
注射用配方 4: DMSO : 20% SBE-β-CD in Saline = 10 : 90 [如:100 μL DMSO → 900 μL (20% SBE-β-CD in Saline)] 口服配方
口服配方 1: 悬浮于0.5% CMC Na (羧甲基纤维素钠) 口服配方 2: 悬浮于0.5% Carboxymethyl cellulose (羧甲基纤维素) 示例: 以口服配方 1 (悬浮于 0.5% CMC Na)为例说明, 如果要配制 100 mL 2.5 mg/mL 的工作液, 您可以先取0.5g CMC Na并将其溶解于100mL ddH2O中,得到0.5%CMC-Na澄清溶液;然后将250 mg待测化合物加到100 mL前述 0.5%CMC Na溶液中,得到悬浮液。 View More
口服配方 3: 溶解于 PEG400 (聚乙二醇400) 请根据您的实验动物和给药方式选择适当的溶解配方/方案: 1、请先配制澄清的储备液(如:用DMSO配置50 或 100 mg/mL母液(储备液)); 2、取适量母液,按从左到右的顺序依次添加助溶剂,澄清后再加入下一助溶剂。以 下列配方为例说明 (注意此配方只用于说明,并不一定代表此产品 的实际溶解配方): 10% DMSO → 40% PEG300 → 5% Tween-80 → 45% ddH2O (或 saline); 假设最终工作液的体积为 1 mL, 浓度为5 mg/mL: 取 100 μL 50 mg/mL 的澄清 DMSO 储备液加到 400 μL PEG300 中,混合均匀/澄清;向上述体系中加入50 μL Tween-80,混合均匀/澄清;然后继续加入450 μL ddH2O (或 saline)定容至 1 mL; 3、溶剂前显示的百分比是指该溶剂在最终溶液/工作液中的体积所占比例; 4、 如产品在配制过程中出现沉淀/析出,可通过加热(≤50℃)或超声的方式助溶; 5、为保证最佳实验结果,工作液请现配现用! 6、如不确定怎么将母液配置成体内动物实验的工作液,请查看说明书或联系我们; 7、 以上所有助溶剂都可在 Invivochem.cn网站购买。 |
| 制备储备液 | 1 mg | 5 mg | 10 mg | |
| 1 mM | 2.6555 mL | 13.2777 mL | 26.5555 mL | |
| 5 mM | 0.5311 mL | 2.6555 mL | 5.3111 mL | |
| 10 mM | 0.2656 mL | 1.3278 mL | 2.6555 mL |
1、根据实验需要选择合适的溶剂配制储备液 (母液):对于大多数产品,InvivoChem推荐用DMSO配置母液 (比如:5、10、20mM或者10、20、50 mg/mL浓度),个别水溶性高的产品可直接溶于水。产品在DMSO 、水或其他溶剂中的具体溶解度详见上”溶解度 (体外)”部分;
2、如果您找不到您想要的溶解度信息,或者很难将产品溶解在溶液中,请联系我们;
3、建议使用下列计算器进行相关计算(摩尔浓度计算器、稀释计算器、分子量计算器、重组计算器等);
4、母液配好之后,将其分装到常规用量,并储存在-20°C或-80°C,尽量减少反复冻融循环。
计算结果:
工作液浓度: mg/mL;
DMSO母液配制方法: mg 药物溶于 μL DMSO溶液(母液浓度 mg/mL)。如该浓度超过该批次药物DMSO溶解度,请首先与我们联系。
体内配方配制方法:取 μL DMSO母液,加入 μL PEG300,混匀澄清后加入μL Tween 80,混匀澄清后加入 μL ddH2O,混匀澄清。
(1) 请确保溶液澄清之后,再加入下一种溶剂 (助溶剂) 。可利用涡旋、超声或水浴加热等方法助溶;
(2) 一定要按顺序加入溶剂 (助溶剂) 。